ucp2基因敲除斑马鱼的模型建立及其铝暴露神经毒性相关研究
2021-08-13汪雪雁贺亚南李行舟赵宝全
汪雪雁,谈 勇,张 芳,陈 豪,贺亚南,李行舟,赵宝全*
基因敲除斑马鱼的模型建立及其铝暴露神经毒性相关研究
汪雪雁1,谈 勇1,张 芳1,陈 豪1,贺亚南1,李行舟2,赵宝全2*
(1. 安徽农业大学茶与食品科技学院,合肥 230036;2. 军事科学院军事医学研究院毒物药物研究所,北京 100850)
利用CRISPR/Cas9技术敲除斑马鱼基因,研究基因在铝致斑马鱼痴呆中的作用。针对斑马鱼基因设计并制备gRNA,通过显微注射技术将gRNA与Cas9-mRNA混合注入斑马鱼单细胞胚胎中,利用酶切和基因测序筛选出发生突变的F0代斑马鱼,与野生型斑马鱼杂交得到F1代斑马鱼杂合子,分析其突变类型,将突变类型一致的斑马鱼杂合子杂交,获得F2代。在酸性AlCl3中暴露F2代斑马鱼胚胎,暴露组的斑马鱼个体行为出现异常,移动距离、移动速度和移动频率皆显著下降(< 0.01),体内活性氧(ROS)水平显著升高(< 0.01);其中KO + AlCl3组导致的异常更为明显,和mRNA转录水平显著上调(< 0.01)。在铝致斑马鱼痴呆中起到重要作用,可能是其关键的治疗预防靶点。
CRISPR/Cas9;斑马鱼;基因;阿尔茨海默病;铝
铝是自然界含量丰富的金属元素之一,一般认为机体吸收少,且无生理功能,却具有神经毒性, 可通过转运体系从血液入脑,导致铝在脑内慢性蓄积,造成神经毒性,其中,铝所致的AD样改变是研究最多的神经疾病。阿尔茨海默病(Alzheimer’s disease,AD)是以学习记忆障碍为特征的一种年龄相关的神经退行性疾病,其病理特征为脑内β-淀粉样蛋白沉积形成的老年斑(Senile plaques,SP)、神经元内纤维缠结(Neurofibrillary tangles,NFTs)和神经元数量减少等[1],发病机制尚不清楚。解偶联蛋白2(Uncoupling protein 2,ucp2)是1997年Fleury首次发现并克隆的又一个UCPs家族成员,与UCP1、UCP3同源性高度相似,只在线粒体亚细胞中表达,在人体骨骼肌、棕色脂肪组织、免疫系统和脑等组织部位分布[2]。在各种能量代谢、ROS生成、细胞凋亡等过程中起到重要作用,与局部脑缺血、非酒精性脂肪肝病、动脉粥样硬化症、Ⅱ-型糖尿病以及神经退行性疾病等都有着密切关系[3-6]。CRISPR/Cas9(Clustered regularly interspersed short palindromic repeats)系统是一种细菌和古细菌用于对抗病毒和外源遗传物质的适应性免疫防御系统,与传统的基因编辑技术相比,在设计、效率、成本等方面优势明显[7]。本研究采用CRISPR/Cas9技术构建基因敲除的斑马鱼模型,并利用该敲除模型初步研究在铝长期暴露所致AD中的作用,以期为阿尔茨海默病的预防和治疗提供新的靶点。
1 材料与方法
1.1 材料
基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒均购于北京赛音图科技有限公司;PCRMix购于TaKaRa公司;Ⅰ和AⅠ核酸内切酶均购于NEB公司;MEGAscriptTMT7和mMESSAGE mMACHINETMSP6试剂盒均购于Thermo Fisher公司;显微注射仪和体式显微镜均购自日本尼康;PN-30拉针仪购于日本成茂;PCR仪购于美国BIO-RAD;pT7-gRNA质粒、pCS2-ncas9n质粒购于Addgene公司;AB品系斑马鱼由北京大学生命科学院提供,利用本实验室循环养殖系统进行驯养繁殖。
1.2 方法
1.2.1基因敲除靶点的设计 通过Esembl网站查询斑马鱼的基因组DNA外显子序列及其功能区。根据CRISPR/Cas9介导的斑马鱼基因组突变靶点设计原则,对基因进行靶点设计。靶点要求:结构须满足5'-GG-N18-NGG-3'。其中5'端的GG是T7启动子的一部分,是为了增加转录效率,设计基因敲除靶点时可以不考虑该因素,但3'端须满足PAM(即NGG)结构,N为任意碱基。
1.2.2 gRNA和Cas9-mRNA的制备 根据设计靶点序列合成两个oligo,上游:5'-TAGGGCCACGC AGTCTCTACAG-3',下游:5'-AAACCTGTAGAG ACTGCGTGGC-3'。退火程序:95 ℃,5 min;以0.1 ℃·s-1的速度降到50 ℃;50 ℃,10 min;以1 ℃·s-1的速度冷却至4 ℃,反应结束后放置–20 ℃保存备用。接着用B I核酸内切酶对pT7-gRNA质粒进行单酶切,反应体系:1 μg的pT7-gRNA质粒,1 μL的Buffer 3.1,1 μL的B I核酸内切酶,加ddH2O 至50 μL。在55 ℃水浴锅中温育4 h,最后进行琼脂糖凝胶电泳检测并切胶回收。将退火合成的DNA片段与酶切回收的pT7-gRNA载体于4 ℃过夜连接、转化,筛选阳性克隆。分别用H I核酸内切酶和I核酸内切酶对pT7--gRNA质粒和pCS2-ncas9n质粒进行酶切,酶切体系:质粒1 μg,核酸内切酶1 μL,CutSmart Buffer 5 μL,加ddH2O 至50 μL,37 ℃水浴4 h,然后进行琼脂糖凝胶电泳检测并切胶回收。利用体外转录试剂盒对线性化的pT7--gRNA质粒和pCS2-ncas9n质粒进行体外转录反应,并对转录后的RNA采用氯化锂沉淀法进行纯化。最后进行浓度检测,分别稀释至100和600 ng·μL-1,–80 ℃保存备用。
1.2.3 显微注射 通过显微注射将2 nL的Cas9- mRNA(50 ng·μL-1)和gRNA(300 ng·μL-1)混合液注射到斑马鱼受精卵单细胞中。迅速收集注射后的受精卵于E3培养液中,尽量除去破裂的胚胎和杂物,放置28 ℃生化培养箱中孵化。期间,可以通过体式显微镜观察胚胎表型是否发生变化,并且筛选正常发育的斑马鱼胚胎来验证靶位点有效性。
1.2.4 体内活性检测 随机挑选5个(受精后48 h)注射组和野生型斑马鱼胚胎于PCR离心管中,进行基因组DNA的提取,具体步骤如下:将胚胎去膜后放入 PCR管中;加入50 μL的50 mmol·L-1NaOH溶液(每个胚胎10 μL);95 ℃ 10 min,4 ℃保存;振荡混匀后加入1/10体积1 mol·L-1Tris(pH 8.0)中和NaOH,充分振荡混匀。PCR扩增目的序列引物设计如下:上游:5'-CGGGATAACCTGAAG ATGCA-3',下游:5'-GCTGACCTGAGCCTGAAA CC-3'。PCR扩增反应体系(50 μL):2×PCRMix 25 μL,引物各取1.5 μL,基因组DNA 2 μL,加ddH2O至50 μL。反应条件:94 ℃预变性 3 min;35个循环:94 ℃变性30 s,55 ℃退火30 s,72 ℃ 30 s;72 ℃延伸5 min。将PCR产物用1.5%琼脂糖凝胶进行电泳并对其纯化回收。利用A I核酸内切酶对PCR扩增产物进行酶切实验,反应体系:PCR扩增产物25 μL,A I核酸内切酶1 μL,CutSmart Buffer 5 μL,ddH2O 19 μL,55 ℃水浴4 h,用1.5%琼脂糖凝胶进行电泳,在紫外灯下观察是否出现多条带,分析靶点的有效性。把剩余的PCR扩增产物送至生工生物工程(上海)有限公司测序。
1.2.5 斑马鱼突变体的筛选 将注射后检测有突变的斑马鱼养至2~3个月进行F0代突变体筛选。具体流程为:剪取每条斑马鱼鱼尾2~3 mm,提取基因组DNA,PCR扩增目的序列,A I酶切快速筛选,将出现多条带的F0代斑马鱼单独培养。将A I酶切检测结果与预期条带大小符合的PCR扩增产物送往生工测序,根据测序峰图进一步验证斑马鱼是否发生突变,筛选出突变率高的F0代斑马鱼。接着将F0代斑马鱼突变体与野生斑马鱼交配筛选出F1斑马鱼杂合子,然后通过单克隆测序分析F0和F1代斑马鱼的突变类型,将F1代敲除类型一致的斑马鱼雌雄个体杂交获得F2代纯合子。

表1 实时定量PCR的引物序列
1.2.6敲除对铝致斑马鱼AD的影响 (1)斑马鱼幼鱼AlCl3暴露实验。实验分为4组,正常对照组是将野生斑马鱼幼鱼于E3培养液中培养,氯化铝暴露组(AlCl3)是将野生斑马鱼幼鱼于AlCl3溶液中培养,敲除组(KO)是F2代斑马鱼胚胎于E3培养液中培养,KO+AlCl3是F2代斑马鱼胚胎于AlCl3溶液中培养。AlCl3的浓度为150 μg·L-1,pH 5.8[8],斑马鱼挑选为受精后3日龄且表型正常的胚胎,于100 mm培养皿中培养,每皿分别放入50枚和相应溶液10 mL,置于生化恒温培养箱(28 ℃)中培养96 h。实验重复3次。(2)斑马鱼幼鱼运动行为测定。AlCl3暴露后,每组随机选取8条斑马鱼幼鱼置于96 孔板(斑马鱼行为学检验专用平板)中,每孔1条。将96孔板放入Noldus视频采集系统观测平台上,采用EthoVision XT10.0 软件追踪采集3 min内斑马鱼幼鱼的自发运动路线图,并计算各组斑马鱼的移动距离、移动速度和移动频率,实验重复3次。(3)斑马鱼幼鱼体内ROS的检测[9]。每组取10条幼鱼放入1.5 mL离心管中,用预冷的PBS(pH值7.4)洗涤2次,然后在预冷的缓冲液(0.32 mmol·L-1蔗糖,20 mmol·L-1HEPES,1 mmol·L-1MgCl2和0.5 mmol·L-1PMSF,pH值为7.4)中研磨均匀。12 000 r·min-1,4 ℃离心20 min,把上清液转移到新的离心管中待用。然后,分别取20 μL的上清液于96孔板中,室温放置5 min,接着每孔加入100 μL PBS(pH 7.4)和8.3 μL DCFH-DA原液(DMSO溶解,10 mg·mL-1),37 ℃温育30 min。最后,用多功能酶标仪(激发光485 nm,发射光530 nm)测定ROS浓度,单位为DCF·mg-1(protein)。实验重复3次。(4)RT-qPCR检测。每组各取20条斑马鱼幼鱼进行总RNA提取和cDNA反转录,具体步骤同上。RT-qPCR反应体系:SYBR PremixTM,10 μL;上下游引物各0.6 μL;cDNA,2 μL;ddH2O,6.8 μL。反应条件95 ℃ 5 min,40个循环:95 ℃ 10 s,60 ℃ 30 s。反应结束后,同样利用LightCycler® 96自带的软件进行相应的数据分析。
1.3 数据统计分析
实验数据以`x±s表示。主要利用GraphPad软件进行单因素方差分析,采用检验进行两组间的比较,统计学检验水平为0.05,< 0.05表示有显著差异。
2 结果与分析
2.1 Cas9-mRNA与gRNA的获得
成功获得Cas9-mRNA和gRNA,大小约2 000和100 bp(图1),纯化后保存。条带大小与预期完全符合。

M: DNA Marker; 1 and 2: Cas9-mRNA; 3: gRNA。
Figure 1 The electrophoretogram of Cas9-mRNA and gRNA
2.2 斑马鱼ucp2基因敲除后代突变体筛选与鉴定
如图2所示,1—8号斑马鱼目的片段A I酶切后在500、300和200 bp左右出现了3条带,表明了这些斑马鱼发生基因突变,为所需突变体;而9号斑马鱼只在300和200 bp左右出现条带,说明它能被A I酶完全酶切,没有发生突变,舍去不用。如图3所示,F1代斑马鱼具有多种突变类型,出现缺失2、3和12个碱基以及插入3个碱基等情况,随着F1代与野生型AB鱼不断杂交至突变类型稳定,我们筛选到稳定缺失1及2个碱基的突变类型,并将缺失类型一致的F1代斑马鱼分别进行自交,得到缺失1个及2个的F2代突变体,具体见图4。选择缺失1 bp的F2代斑马鱼进行实验,缺失1 bp的F2代纯合斑马鱼测序结果见图5。

M: DNA Marker; 1—9: F1 generation zebrafish; C: Wild type zebrafish。
Figure 2 The results of F1generation zebrafish digested byA I
2.3 基因敲除斑马鱼幼鱼及铝暴露幼鱼的行为学评价
观察斑马鱼幼鱼的运动轨迹图,可知正常斑马鱼幼鱼的游动规律是沿着四周壁慢慢活动,偶尔从中间穿过,活动距离较长;敲除组(KO)和AlCl3暴露组的斑马鱼游动没有规律,只是在中心位置来回游动,活动距离与正常斑马鱼幼鱼相比明显缩短;KO+AlCl3组斑马鱼游动更加缓慢,只在某一区域活动,没有探索意向(图6A,=10,排除个体差异)。与正常组相比,其他组的斑马鱼幼鱼的移动距离、移动速度和频率皆出现明显下降(< 0.01)。与KO+AlCl3组相比,敲除组和AlCl3暴露组的斑马鱼幼鱼移动距离和移动速度则出现明显的增加(< 0.05),但频率没有明显的变化(图6B、C和D)。结果表明基因在铝致AD中起到了重要作用,的敲除加重铝致AD的行为异常。

注:下划线标记表示ucp2基因靶点序列,虚线表示缺失位置,对于每条突变序列后面的标记表达意思为:“-”表示碱基缺失,“+”表示碱基插入,中括号内数据则是突变单克隆的数量,WT表示野生斑马鱼。
Figure 3 The genetic maps of mutated F1generation zebrafish

图4 稳定遗传的F1代突变斑马鱼测序结果
Figure 4 The sequencing results of stability mutated F1generation zebrafish

图5 F2代突变斑马鱼序列测序结果
Figure 5 The sequencing result of F2generation zebrafish
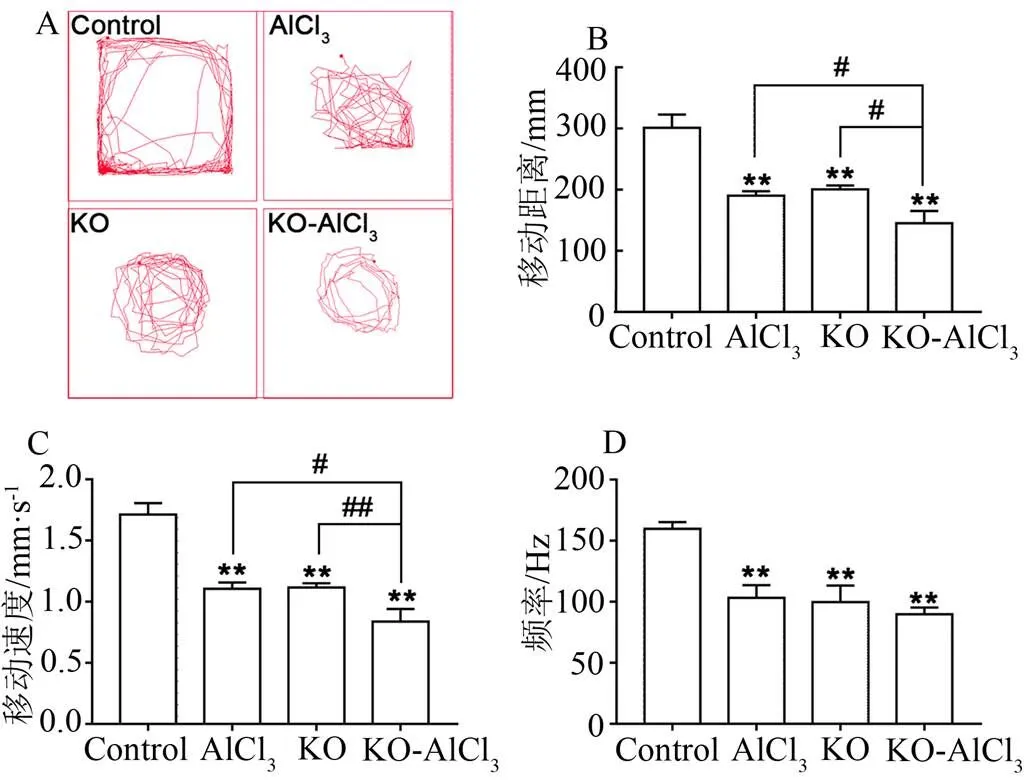
A. 斑马鱼游动的轨迹图;B. 斑马鱼移动距离分析结果;C. 斑马鱼移动速度分析结果;D. 斑马鱼频率分析结果。**P < 0.01,与空白对照组相比;# P < 0.05,## P < 0.01,与KO+AlCl3组相比(n = 24)。
Figure 6 The locomotor activity of gene knockout zebrafish larvae and the exposed to AlCl3
2.4 ucp2敲除促进斑马鱼体内ROS的生成
活性氧簇(ROS)是需氧细胞在代谢过程中产生的,浓度过高会造成细胞的凋亡甚至坏死。实验结果显示,与空白对照组相比,敲除组、AlCl3暴露组和KO+AlCl3组的斑马鱼的ROS水平显著增加(< 0.01);与KO+AlCl3组的斑马鱼相比,AlCl3暴露组和敲除组的ROS明显下降(< 0.05)(图7)。表明敲除会增加斑马鱼体内ROS的产生,联合铝暴露则会导致更多ROS的生成。
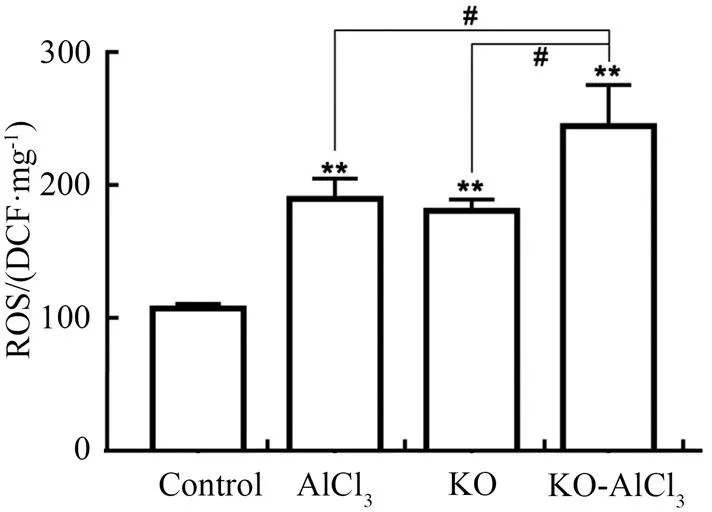
** P < 0.01,与空白对照组相比;#P < 0.05,与KO+AlCl3组相比(n =10)。
Figure 7 The ROS level in zebrafish larvae

*P < 0.05,**P < 0.01,与空白对照组相比(n = 20)。
Figure 8 The expressions of genes related to nerves inknockout zebrafish exposed to AlCl3by RT-qPCR assay
2.5 ucp2敲除联合铝暴露增加神经相关基因表达上调
与空白对照组相比,未暴露AlCl3的敲除组的各基因表达变化不明显。AlCl3暴露组中,斑马鱼的和mRNA转录水平皆出现上调,其中的基因表达具有统计学意义(< 0.05)。而KO+AlCl3组中,和mRNA 转录水平出现极显著上调(< 0.01),和mRNA 转录水平出现明显上调(< 0.05)(图8)。表明敲除联合铝暴露可以增加和的基因表达。
3 讨论
本研究通过CRISPR/Cas9系统构建基因敲出的斑马鱼模型,并利用该模型初步研究在铝致斑马鱼痴呆中的作用。首先通过相关网站设计一个合理的敲除靶点,确保能够影响其基因功能。然后,构建pT-ucp2-gRNA质粒以获得特异性gRNA,将特异性gRNA和Cas9-mRNA混合液显微注射至斑马鱼单细胞的受精卵中,体内活性检测验证了所设靶点的有效性。并且利用A I酶切验证、测序分析以及TA克隆成功筛选出缺失一个碱基的F2代纯合突变体,造成移码突变,影响基因功能的表达。此外,本研究还利用酸性氯化铝对敲除的F2代斑马鱼进行暴露处理,发现敲除组和AlCl3暴露组的斑马鱼皆出现行为异常,行为学显示该组斑马鱼只在某一区域活动,没有探索意向,多次重复结果一致,生化水平检测显示体内ROS水平明显增加,KO+AlCl3组表现更为严重,表明敲除联合铝暴露会增加体内ROS的产生,加快认知功能的衰退。已有文献报道敲除往往会增加细胞内ROS水平,诱导星形胶质细胞和小胶质细胞增殖活化,干扰神经细胞的增殖,引起内质网应激及其介导的细胞凋亡,加重神经元损伤[10]。同时的大量表达可以降低线粒体膜电位以及抑制ROS生成,对细胞具有保护作用,推测可能是治疗衰老相关疾病的关键靶点[11]。另外,敲除会增加星形胶质细胞线粒体ROS的产生,从而激活NLRP3炎症小体,导致产生,抑制神经再生,加重星形胶质细胞NLRP3炎症小体激活介导的炎症反应[12]。可以通过抑制ROS的生成来保护Aβ暴露处理的原代神经元[13]。而RT-qPCR结果也显示的敲除会导致和基因表达显著上调。其中和的基因表达增加,往往会促进Aβ的形成,进而导致AD的发生[14];和是炎症细胞因子,它们表达上调会加快神经细胞的凋亡,引起神经炎症,导致神经系统疾病的发生[15]。可能是治疗预防阿尔茨海默病的关键靶点。
[1] 毛吾丽旦木·迪力夏提, 努尔买买提·艾买提. 阿尔茨海默病的危险基因与疾病发病机制[J]. 新疆医科大学学报, 2016, 39(7): 923-925.
[2] PHEIFFER C, JACOBS C, PATEL O, et al. Expression of UCP2 in Wistar rats varies according to age and the severity of obesity[J]. J Physiol Biochem, 2016, 72(1): 25-32.
[3] LI C, SUN H, ARRICK D M, et al. Chronic nicotine exposure exacerbates transient focal cerebral ischemia-induced brain injury[J]. J Appl Physiol, 2016, 120(3): 328-333.
[4] JIN X, XIANG Z, CHEN Y P, et al. Uncoupling protein and nonalcoholic fatty liver disease[J]. Chin Med J (Engl), 2013, 126(16): 3151-3155.
[5] MARGARYAN S, WITKOWICZ A, PARTYKA A, et al. The mRNA expression levels of uncoupling proteins 1 and 2 in mononuclear cells from patients with metabolic disorders: obesity and type 2 diabetes mellitus[J]. Postepy Hig Med Dosw (Online), 2017, 71(0): 895-900.
[6] SU J, LIU J, YAN X Y, et al. Cytoprotective effect of the UCP2-SIRT3 signaling pathway by decreasing mitochondrial oxidative stress on cerebral ischemia-reperfusion injury[J]. Int J Mol Sci, 2017, 18(7): 1599.
[7] LI M Y, ZHAO L Y, PAGE-MCCAW P S, et al. Zebrafish genome engineering using the CRISPR-Cas9 system[J]. Trends Genet, 2016, 32(12): 815-827.
[8] HE X, ZHONG Z M, CHE Y. Locomotor activity and learning and memory abilities in Alzheimer's disease induced by Aluminum in an acid environment in Zebrafish[J]. Zool Res, 2013, 33(2): 231-236.
[9] DENG J, YU L, LIU C, et al. Hexabromocyclododecane-induced developmental toxicity and apoptosis in zebrafish embryos[J]. Aquat Toxicol, 2009, 93(1): 29-36.
[10] 刘洋. 线粒体解耦联蛋白2与帕金森病的相关性[D]. 南京: 南京医科大学, 2011.
[11] 郭鑫. 解耦联蛋白2对线粒体氧化损伤诱导端粒依赖性衰老的干预和机制[D]. 南昌: 南昌大学, 2013.
[12] 吴芳芳. 线粒体解耦联蛋白2与抑郁症的相关性研究[D]. 南京: 南京医科大学, 2013.
[13] JUN Z, IBRAHIM M M, DEZHENG G, et al. UCP2 protects against amyloid beta toxicity and oxidative stress in primary neuronal culture[J]. Biomed Pharmacother, 2015, 74: 211-214.
[14] JAYNE T, NEWMAN M, VERDILE G, et al. Evidence for and against a pathogenic role of reduced γ-secretase activity in familial Alzheimer's disease[J]. J Alzheimers Dis, 2016, 52(3): 781-799.
[15] SOKOLIK V V, MALTSEV A V. Cytokines neuroinflammatory reaction to the action of homoaggregatic and liposomal forms of b-amyloid 1-40 in rats[J]. Biomed Khim, 2015, 61(3): 373-380.
Effects of knockout ofgene on zebrafish dementia model induced by aluminum
WANG Xueyan1, TAN Yong1, ZHANG Fang1, CHEN Hao1, HE Yanan1, LI Xingzhou2, ZHAO Baoquan2
(1. School of Tea and Food Science & Technology, Anhui Agricultural University, Hefei 230036;2. China Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850)
In order to explore the role ofgene in aluminum-induced zebrafish dementia, we establishedgene knockout zebrafish model on wild type zebrafish using CRISPR/cas9 system. We selected the-targeting region by bioinformatics analysis, constructed and transcribed gRNA plasmid, and con-injected mixed gRNA and Cas9 mRNA into single-cell stage fertilized embryo. We screened out the mutant F0generation zebrafish by enzyme digestion and Sanger sequencing, chose mutant successfully F0outcrossed with the wild-type zebrafish to get the F1generation zebrafish, and used the same methods to get F2generation zebrafish. The larvae of F2zebrafish were exposed in acidic AlCl3. Compared with the control group, the individual behavior of the zebrafish exposed to AlCl3were abnormal, the distance, speed and frequency of swim for zebrafish significantly decreased (< 0.01), while the ROS level was significantly increased (< 0.01), and the mRNA transcription levels of,,andwere up-regulated significantly (< 0.01). In conclusion, we successfully establishedgene knockout zebrafish model, which could speed up the process of AD (Alzheimer’s disease).
CRISPR/Cas9; zebrafish;; Alzheimer’s disease; aluminum
S917
A
1672-352X (2021)03-0397-06
10.13610/j.cnki.1672-352x.20210706.018
2021-7-7 11:44:13
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210706.1649.036.html
2020-07-08
国家“重大新药创制”科技重大专项(2018ZX09J18102-001-003)资助。
汪雪雁,副教授。E-mail:wxy700303@ahau.edu.cn
赵宝全,副研究员。E-mail:baoquanzhao@126.com
