肿瘤坏死因子-α诱导对膀胱癌细胞株NF-κB信号通路分子表达及细胞增殖水平的影响*
2021-08-13路蔓,付强,张静△
路 蔓,付 强,张 静△
空军军医大学第二附属医院:1.检验科;2.泌尿外科,陕西西安 710038
目前,越来越多的研究证实,恶性肿瘤的发生与炎症密切相关[1]。膀胱癌患者普遍存在炎性反应,肿瘤坏死因子-α(TNF-α)是一种常见的炎性反应指标,有研究表明TNF-α水平与恶性肿瘤的进展相关[2]。有研究发现,在肝细胞肝癌、前列腺癌、膀胱癌等恶性肿瘤中,核因子-κB(NF-κB)信号通路存在异常激活的现象,并且该因子直接影响着炎症与癌症的关系[3]。本研究拟了解TNF-α诱导对膀胱癌细胞NF-κB通路分子表达及细胞增殖水平的影响,现报道如下。
1 材料与方法
1.1材料 人膀胱癌细胞2株,即T24和5637,均统一由中科院广州研究所提供。
1.2仪器与试剂 酶标仪(Bio-Rad 680,美国伯乐公司);实时荧光PCR仪(ABI 7500,德国Eppendorf公司);RPMI 1640培养基(批号:8114641,上海信帆生物科研所);胎牛血清(批号:56H4627,上海江林生物科技有限公司);重组人TNF-α试剂(批号:CYT-233-a,默克生命科学);CCK-8试剂盒(批号:WZ736,上海酶联生物科技有限公司)。
1.3方法
1.3.1培养并处理膀胱癌细胞 选取人膀胱癌细胞株T24和5637,采用含10%胎牛血清的RPMI 1640培养基进行培养,在37.5 ℃、5%二氧化碳(CO2)条件下培养至对数生长期。观察培养的情况,待以一定浓度铺板生长后,对T24和5637进行处理。需要注意的是,在处理之前必须要同步化处理,具体操作要求为使用无胎牛血清培养液进行饥饿处理。根据不同的处理方法,分为两组,TNF-α处理组采用50 ng/mL TNF-α处理,对照组采用同等体积的磷酸盐缓冲液(PBS)处理。
1.3.2实时荧光定量PCR检测 将对数生长期的细胞株,以(2~3)×107/mL的水平接种于24孔板中,同步化处理之后,将细胞分成3个不同的组,每组设置3个复孔,且独立重复3次。采用TNF-α分别作用1、3、6 h,然后进行细胞的收集。提取细胞总RNA的方法为Trizol法,反转录合成cDNA备用。实时荧光定量PCR反应体系参照文献[4]操作进行。各基因的检测结果按2-ΔΔCt方法计算。
1.3.3癌细胞增殖活性的检测 采用CCK-8法对膀胱癌细胞(T24、5637)的增殖活性进行检测:取对数生长期的细胞,以(1~2)×107/L的水平将其接种于细胞培养液(96孔)中,使用含10%胎牛血清的1640培养液进行常规培养,持续24 h。同步化处理:处理完成之后,设置TNF-α处理组和对照组,每孔设置5个复孔,独立重复5次。处理24 h,检测膀胱癌细胞的增殖活性,检测时严格参照CCK-8试剂盒要求和说明进行操作。需要注意的是,为提高检测的质量,在检测前应更换培养液,每孔加入100 μL培养液和10 μL的CCK-8试剂,继续培养2 h。采用酶标仪对450 nm波长处各孔的吸光度进行检测,并计算细胞存活率。按照以下方法计算细胞存活率:细胞存活率=(A处理组-A空白对照组)/(A阴性对照组-A空白对照组)×100%。
1.4观察指标 分析TNF-α处理对不同膀胱癌细胞株NF-κB信号通路中RelA、RelB两种基因表达的影响。比较TNF-α处理对不同膀胱癌细胞株细胞增殖能力的影响。

2 结 果
2.1TNF-α对膀胱癌T24细胞株NF-κB信号通路的影响 TNF-α处理T24细胞株后,TNF-α处理组的RelA、RelB基因表达水平均高于对照组(P<0.05),且TNF-α处理后,不同时间RelA、RelB基因表达水平比较差异有统计学意义(P<0.05),随着时间的延长基因表达水平不断上升。见表1。

表1 TNF-α对膀胱癌T24细胞株NF-κB信号通路的影响
2.2TNF-α对膀胱癌5637细胞株NF-κB信号通路的影响 TNF-α处理5637细胞株后,RelA基因表达水平在作用3 h后明显上升,与对照组相比,差异有统计学意义(P<0.05),但是RelB基因表达水平与对照组相比差异无统计学意义(P>0.05)。见表2。

表2 TNF-α对膀胱癌5637细胞株NF-κB信号通路的影响
2.3TNF-α处理对不同膀胱癌细胞株增殖活性的影响 膀胱癌细胞株T24和5367经TNF-α处理后,对照组、TNF-α处理组的细胞存活率比较,差异均无统计学意义(P>0.05)。见表3。
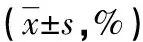
表3 两组不同膀胱癌细胞株细胞存活率的比较
3 讨 论
根治性膀胱全切除术是膀胱癌治疗的重要手段,科学、合理地制订手术方案,将病灶予以切除,有利于提高患者的生存质量,延长患者的生存期[5]。但是,对于膀胱癌的根治性手术治疗,必须要建立在对该恶性肿瘤全面了解的基础上,以便能够最大限度地提高治疗水平,满足患者的治疗需求。因此,有必要加强对膀胱癌发病机制、原因的分析。
随着临床对膀胱癌研究的不断深入,人们发现炎性反应与其发生、发展密切相关[6]。研究表明,在肿瘤微环境中,经常能够检测到高水平的炎性细胞因子或缺氧现象的存在,而细胞因子和缺氧应激均是NF-κB信号通路激活的刺激物,NF-κB信号是连接炎症与肿瘤的关键通路之一[4,7]。TNF-α是重要的促炎细胞因子,高度参与了相关炎性反应,并且也参与了NF-κB信号通路的激活,从而“嫁接”起NF-κB信号通路和恶性肿瘤,使二者保持密切联系[8-10]。为此,本研究以膀胱癌细胞株T24和5637为研究对象,对TNF-α这一促炎因子对NF-κB信号通路的影响展开分析。本研究结果显示,TNF-α处理T24细胞株后RelA基因的表达水平均有所上调,而5637细胞株在处理3 h后有明显上升(P<0.05)。但RelB基因的表达与RelA基因不同,在TNF-α作用1 h后显著上调,可仅局限于T24细胞株,5637细胞株在各作用时间点均无明显变化(P>0.05)。进一步分析发现,在TNF-α作用时间不断延长的情况下,T24细胞株RelB基因的表达上调幅度逐渐下降,这一结果提示TNF-α对NF-κB信号的非经典通路可能存在负反馈调节机制来维持微环境的稳定[2,10-11]。需要注意的是,TNF-α在作用6 h后,T24细胞株的RelB基因表达水平上调,5367细胞株的RelB基因表达水平则下调。由此可以看出,TNF-α作用前后的2个信号通路基因表达水平改变并不是完全一致,这在很大程度上表明了TNF-α对NF-κB信号的经典和非经典通路的作用机制具有选择性,作用的过程可能不同。分析TNF-α处理对膀胱癌细胞增殖活性的影响,结果显示无论是作用于T24细胞株还是5367细胞株,差异均无统计学意义(P>0.05),因此从这一结果可以认为TNF-α可能对膀胱癌细胞株的增殖活性无较大影响。
综上所述,TNF-α可诱导膀胱癌细胞NF-κB信号通路RelA、RelB基因的表达,并且主要作用于早期阶段,但对细胞株增殖活性的影响甚微。
