lncRNA H19通过MACC1/MET/EGFR途径逆转胰腺癌细胞迁移和侵袭的研究
2021-08-13易基群江高峰
王 林,易基群,李 理,江高峰
1.广州市红十字会医院,暨南大学医学院附属广州红十字会医院肿瘤科,广东 广州 510220; 2.武汉科技大学天佑医院转化医学中心
胰腺癌是消化道恶性肿瘤,被称为“癌中之王”,一般出现症状时已属晚期并发生远处转移[1]。因此,对胰腺癌浸润、转移机制的深入探索将有助于开发更多的治疗策略。
人类基因组中具有组编码蛋白质功能的基因不足2%,大部分基因组则不表达蛋白质,其被称为非编码RNA。其中长度超过200个碱基的非编码RNA被称为长链非编码RNA(lncRNA)[2]。近年来研究表明,lncRNA参与调控细胞增殖、侵袭、迁移、凋亡、分化等生物学进程,其异常表达与临床许多疾病尤其是肿瘤发生发展关系密切[3-4]。lncRNA H19作为一个典型的lncRNA,研究发现,其在多种肿瘤中表达异常,而且在不同肿瘤类型和细胞背景中,lncRNA H19发挥的作用也不尽相同,发挥致癌或抑癌的不同生物学功能[5-8]。lncRNA H19参与调控染色体重构、DNA甲基化,也可作为miRNA前体并对组蛋白进行修饰,继而参与蛋白翻译水平调控,同时影响多种基因的表达调控网络。但到目前为止,lncRNA H19在肿瘤细胞迁移和侵袭中的作用仍然不完全为人所知。
结肠癌转移相关基因1(metastasis-associated in colon cancer 1,MACC1)最初被发现是结直肠癌的转移相关基因[9],是HGF/c-Met信号通路的一个关键调节因子,在细胞生长、侵袭、迁移等过程中发挥重要作用。随后越来越多的研究表明,MACC1不仅与结肠癌,而且与多种肿瘤如肺癌、胃癌、肝癌以及胰腺癌的发生、发展和转移密切相关[10-11]。那么它参与胰腺癌转移的机制、是否与H19调控有关现仍未完全阐明。为进一步探讨H19在胰腺癌转移中的作用,本研究通过稳定敲低H19胰腺癌细胞株,观察胰腺癌细胞侵袭、迁移、MACC1变化以及下游细胞信号通路变化,以期为胰腺癌治疗提供新的见解。
1 材料与方法
1.1 细胞培养PANC-1细胞培养于含质量浓度为100 g/L的胎牛血清(10099141C GIBCO)的RPMI-1640培养基(C11875500BT、GIBCO、Scotland、UK)中,在37 ℃和体积分数为5%的CO2条件下培养。
1.2 RNA分离与qRT-PCR将处于对数生长期的细胞经胰酶消化,离心重悬后按RiboPureTMRNA纯化试剂盒(AM1924,Invitrogen)说明提取总RNA。采用一步法qRT-PCR测定H19的表达,引物设计如下:H19-Fwd:5′-ATCGGTGCCTCAGCGTTCGG-3′;H19-Rev:5′-CTGTCCTCGCCGTCACACCG-3′;MACC1-Fwd:5′-GGCATTGTCCTGGTGTGGT-3′;MACC1-Rev:5′-CACTCCTTCACCCCTGCTATCT-3′;根据GoTaq®1-Step qRT-PCR System(A6020,Promega)试剂盒说明书配置反应体系,qRT-PCR反应条件:反转录45 ℃ 10 min;预变性95 ℃ 5 min;变性95 ℃ 10 s;退火60 ℃ 45 s;溶解曲线分析按照说明书进行,共30个循环。进行相对定量分析,ΔCt=Ct(目的)-Ct(内参),ΔCt=ΔCt(研究样本)-ΔCt(对照样本),实验重复3次。
1.3 H19 shRNA慢病毒的构建将含有GFP报告基因的慢病毒载体LV-008(Forevergen Bio-sciences,China)用于表达靶向H19(5′-CCAACATCAAAGACACCAT-3′)和干扰对照(5′-TGGTTTACATGTCGACTAA-3′)序列的shRNA。用包装载体将LV-008-shH19质粒转染到HEK 293T细胞中。转染后72 h收集含有感染慢病毒的上清液,并通过在Beckman Coulter SW40转子(Fullerton,CA,USA)中以100 000g超速离心2 h来浓缩慢病毒,并重悬于PBS中。然后将PANC-1细胞接种在24孔板中,并在5~10 μg/ml Polybrene存在下用慢病毒感染,后用2 μg/ml嘌呤霉素筛选H19敲低细胞10~15 d。
1.4 MACC1 RNAi的构建为了敲低MACC1在细胞中的表达,合成了19 bp siRNA(正义:5′-CACCAUAGCUUGCAAAGUA-dTdT-3′,反义:5′-UACUUUGCAAGCUAUGGUG-dTdT-3′,来自Ribo公司)。对于siMACC1转染,在转染前12 h将6×105个细胞接种到6孔板中,根据标准程序使用Lipofectin 2000(11668-27,Invitrogen,USA)进行siMACC1转染细胞。
1.5 细胞迁移和侵袭测定使用在12孔板中的8 μm孔透射室进行Transwell迁移测定。无血清RPMI-1640处理过夜后,将细胞悬浮液(1×105个细胞/ml,100 μl)接种到上层中,在下层内RPMI 1640培养基,再培养12 h后,4%多聚甲醛的PBS溶液,并用Giemsa染色。最后,在光学显微镜(200倍)下计算迁移至下室的细胞。细胞侵袭测定与细胞迁移相似。Transwell膜预涂有50 μg/μl Matrigel®(BD Biosciences,Franklin Lakes,NJ,USA),然后将细胞悬浮液接种到上室中,并将细胞再培养48 h,以与细胞迁移测定相同的方式计数迁移至下层细胞。
1.6 Western blotting分析将各处理组细胞重新悬浮并在裂解液(50 mmol/L Tris、100 mmol/L NaCl、1% NP-40和0.5%脱氧胆酸盐,1 mmol/L苯甲基磺酰基uoride)中裂解20 min,4 ℃。然后通过10% SDS-PAGE凝胶电泳,并转到聚二氟乙烯(PVDF)膜上。将此膜在含有5%(W/V)脱脂奶粉的TBST(0.05%吐温20)封闭1 h,并与第一抗体(1∶1 000)一起孵育2 h,然后洗涤3 h。用TBST洗涤10 min,然后与二抗(1∶5 000,NA934-100UL,Amer-sham Pharmacia Biotech)孵育1 h,TBST洗涤3次,通过增强的化学发光系统(ECL;Amersham Pharmacia Biotech)观察。使用以下抗体:抗MACC1,KLF4以及抗VEGF(ab226803、ab215036、ab32152、abcam),GAPDH购自Santa Cruz Biotechnology(sc-47724)。结果进行半定量分析以分析蛋白质表达。

2 结果
2.1 构建稳定的H19敲低PANC-1细胞为了探索lncRNA H19与胰腺癌细胞侵袭、迁移之间的关系,通过使用慢病毒介导的RNAi技术建立了稳定的H19敲低PANC-1细胞系。筛选H19敲低细胞并通过qRT-PCR评估敲低效应。如图1所示,与Scramble细胞相比,PANC1-shRFC3细胞中H19 mRNA减少约50%(P<0.01)。

注:**P<0.05。
2.2 敲除H19增加了胰腺癌细胞的迁移和侵袭在建立H19敲低PANC-1细胞系后,我们进行Transwell迁移实验以检测敲除H19后PANC-1细胞的迁移活性(见图2A)。测量shH19-PANC1迁移细胞的数量,结果显示H19的敲低增加了迁移细胞数量。此外,继续对细胞侵袭进行研究,如图2B所示,与对照组相比,当H19被敲低时,迁移细胞的数量显著增加至约2倍。总之,这些结果表明,H19在胰腺癌侵袭、转移过程中起抑制作用。

注:**P<0.05,***P<0.001。
2.3 敲除H19导致MACC1上调为了进一步揭示H19调节PANC-1细胞侵袭的机制,我们通过qRT-PCR和Western blotting分析shH19-PANC1细胞中MACC1的表达。结果表明,shH19-PANC1细胞中的MACC1 mRNA和蛋白质水平明显上调(见图3)。
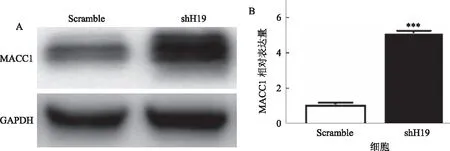
注:***P<0.01。
2.4 敲低MACC1下调胰腺癌细胞的迁移能力为了探索敲低H19增加PANC-1细胞迁移能力上调是否与上调MACC1有关,我们进一步在shH19-PANC1细胞中敲低MACC1(见图4A),并且进行Transwell测定(见图4B),结果显示,敲低MACC1可以明显抑制shH19-PANC1细胞的迁移能力。
2.5 敲除H19导致MACC1下游信号蛋白的上调研究[12]表明,MACC1激活HGF/c-Met信号可以与EGFR协同刺激下游基因,因此,我们分析这些蛋白的表达。
如图5所示,HGF/c-Met以及EGFR均在shH19-PANC1细胞中上调。更重要的是,H19敲低后,磷酸化c-Met(p-cMet)的刺激作用明显高于未磷酸化c-Met,这表明H19的敲低不仅增加了c-Met的表达水平,而且刺激了其磷酸化水平。总之,这些结果表明,H19的敲低诱导MACC1的上调,导致下游信号蛋白的刺激和活化。

注:A:MACC1 mRNA表达情况,**P<0.05; B: PANC-1细胞的迁移能力。

图5 敲除H19上调HGF、EGFR、c-Met和p-cMet的表达
3 讨论
胰腺癌转移是其治疗失败主要原因,如更好地了解胰腺癌转移的分子机制,可能会发现更有效的治疗策略。lncRNA既可作为抑癌基因,亦可作为参与肿瘤发生的癌基因[13]。lncRNA H19在肿瘤发展中起重要作用,但其在肿瘤细胞迁移和侵袭中的作用仍不清楚。在本研究中,我们发现lncRNA H19的敲低显著增加了胰腺癌细胞的迁移和侵袭。进一步的研究结果表明,lncRNA H19的敲低诱导MACC1的上调,并随后刺激HGF/c-Met以及EGFR信号传导途径的激活。
MACC1与c-Met的启动子结合以刺激其转录,随后导致HGF/c-Met信号传导途径的激活[14]。在肿瘤细胞中,c-Met激活触发了一系列参与细胞增殖和侵袭的信号网络[15],我们的实验也证明MACC1的敲除显著降低了肿瘤的迁移和侵袭。先前的研究表明,HGF/c-Met的过度表达表明肿瘤侵袭的增加和癌症患者预后不良的迹象[16]。MACC1上的lncRNA H19部分是由于H19编码的miRNA靶向MACC1基因或其上游基因。我们结果发现,lncRNA H19的敲低导致MACC1的上调,增加MACC1可能会刺激HGF。因此,HGF结合诱导c-Met受体同源二聚化和磷酸化,并且最终导致HGF/c-Met信号传导途径的激活。
现已在多种肿瘤细胞中已经证实了c-Met和EGFR之间的相互作用[17]。活化的c-Met可正向调节表皮生长因子受体(EGFR),激活后的EGFR进一步刺激激活下游信号蛋白。我们也发现当lncRNA H19被敲除时,EGFR的表达水平被上调,增加的HGF/c-Met信号传导与EGFR信号传导协同作用,刺激下游信号通路的激活以及肿瘤生长和转移的增加[18-19]。
总之,我们研究证实lncRNA H19的敲低增加了胰腺癌细胞的迁移和侵袭。进一步研究表明,lncRNA H19的敲低诱导了MACC1的上调,并随后刺激了HGF/c-Met以及EGFR信号通路的激活。这些结果表明lncRNA H19可能在胰腺癌侵袭、转移过程中起重要作用,有可能为胰腺癌转移的临床诊治提供新的思路。但本研究仅观察敲低H19对胰腺癌转移调控作用,与MACC1以及下游HGF/c-Met、EGFR变化。至于是否存在其他机制以及后续体内试验需进一步验证。
