房水中IL-17、VEGF、TNF-α表达水平与先天性白内障摘除术后无晶状体眼青光眼的相关性
2021-08-12唐晓蕾张然李倩韩双羽代艳
唐晓蕾,张然,李倩,韩双羽,代艳
(绵阳市中心医院眼科,四川 绵阳 621000)
无晶状体眼青光眼(aphakic glaucoma,AG)属于继发性青光眼,是先天性白内障摘除后常见的并发症,严重威胁患者视力,发生率高达15.0%~58.7%[1]。AG类型较多,发病机制复杂,主要包括慢性炎症反应、玻璃体产生毒性物质或房角堵塞导致的白内障合并房角发育不良等[1]。目前,关于AG的研究主要集中在其发生后的治疗方面,如药物及手术治疗,而在分子层面对AG病因防治的研究报道极少[2]。虽然国内外研究已经证实包括白细胞介素、血管内皮生长因子等多种因子与某些类型青光眼发病机制关系密切[3],且针对上述因子采取相应防治措施已取得了较理想的效果,但青光眼发生率及对视功能带来的不可逆损害得到有效的降低[4]。然而,先天性白内障摘除手术后无晶状体眼青光眼患者房水中白细胞介素17(interleukin,IL-17)、肿瘤坏死因子α(tumor necrosis factor,TNF-α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)是否同样存在异常表达,及其与AG发病之间是否存在一定的相关性尚不清楚[5-6]。本研究拟通过对白内障摘除手术后无晶状体眼房水中IL-17、TNF-α、VEGF含量测定,探讨其与AG发病之间的关系,望为临床防治青光眼提供新的方法。
1 资料与方法
1.1 一般资料
采用前瞻性随机对照研究的方法将2019年8月至2020年8月在绵阳市中心医院诊断为先天性白内障、并接受白内障摘除手术未植入人工晶状体的150例患儿纳入研究。本研究取得医院伦理委员会批准及患儿家长知情同意。纳入标准:(1)符合白内障诊断标准,即眼球的轴向长度小于正常年龄眼轴长度的两个标准差,并达到手术指征[7];(2)年龄≤6岁;(3)先天性白内障、并接受白内障摘除手术未植入人工晶状体;(4)患儿家长知情同意。排除标准:(1)术前存在青光眼、眼前节发育异常者;(2)患有合并玻璃体增生症等眼部疾病者。根据术后随访期内是否发生青光眼将其分为青光眼组(AG组)及非青光眼组(非AG组)。先天性白内障摘除手术后青光眼的定义[8]:眼压≥21 mmHg及合并以下至少一项:(1)眼角膜增大;(2)双眼不对称合并角膜增大或眼轴增长;(3)视杯进行性增大,杯盘比值增加0.2及以上;(4)必须采用手术控制眼压。青光眼组(AG组)和非青光眼组(非AG组)性别、年龄等常规临床资料比较,差异无统计学意义(P>0.05)。见表1。
1.2 观察指标
房水采集:所有患儿术中均采集一次房水,手术眼常规眼部消毒、铺巾,开睑器开睑,用带有25 G针头的注射器在角膜缘内l mm处行前房穿刺,抽取房水0.1~0.2 mL,置入1.5 mL灭菌eppendof 离心管中,-20 ℃保存。术后随访4个月、8个月和12个月,均在口服水合氯醛后进行房水采集,方法同上述操作。采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测IL-17、VEGF、TNF-a的水平。所用试剂盒购自R&D公司(货号:D6050,M6000B,DY206-05),并根据产品说明书进行相关操作。将特异性抗体与固相载体连接,形成固相抗体:洗涤除去未结合的抗体及杂质,加受检标本:使之与固相抗体接触反应一段时间,让标本中的抗原与固相载体上的抗体结合,形成固相抗原复合物,洗涤除去其他未结合的物质。加酶标抗体,使固相免疫复合物上的抗原与酶标抗体结合,彻底洗涤未结合的酶标抗体。此时,固相载体上酶的量与标本中受检物质的量呈正相关。加底物,根据颜色反应的程度进行该抗原的定性或定量分析。
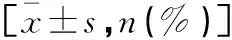
表1 两组一般资料比较
眼压及相关指标测定:采用Goldmann压平眼压计测量年长可配合患儿的眼压,对于年幼欠配合患儿,可在口服水合氯醛麻醉下,使用Icare回弹式眼压计进行测定。角膜直径、眼轴可通过IOL-MASTER测定;视杯形态及杯盘比值可通过直接检眼镜、光学相干断层显像检查(optical coherence tomography,OCT)测得。
术后随访时间及青光眼处理:术后每隔4个月随访一次并采集房水,同时行眼压及其他相关数据测定,持续至术后1年。随访过程中若发现AG患者,均及时给予降眼压药物治疗,对药物治疗无效者则考虑手术治疗。
1.3 统计学分析
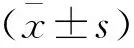
2 结果
2.1 两组房水中IL-17、VEGF、TNF-a水平比较
术中,两组房水IL-17、VEGF、TNF-a水平比较,差异无统计学意义(P>0.05);术后4个月、8个月和12个月,AG组患儿房水中IL-17、VEGF、TNF-a水平与术中比较明显升高,且三者均高于对照组(P<0.05)。见表2。
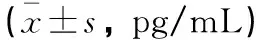
表2 两组房水中IL-17、VEGF、TNF-a水平比较
2.2 两组不同时间点眼压情况比较
术后4个月、8个月和12个月,AG组患儿眼压高于非AG组患儿各时间点的眼压,差异有统计学意义(P<0.05)。见表3。
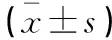
表3 两组不同时间点眼压情况比较
2.3 房水IL-17、VEGF、TNF-a水平与眼压的相关性分析
经Pearson相关性分析表明,AG组患儿术后4个月、8个月和12个月房水IL-17、VEGF、TNF-a水平与眼压呈正相关(P<0.05)。见表4。
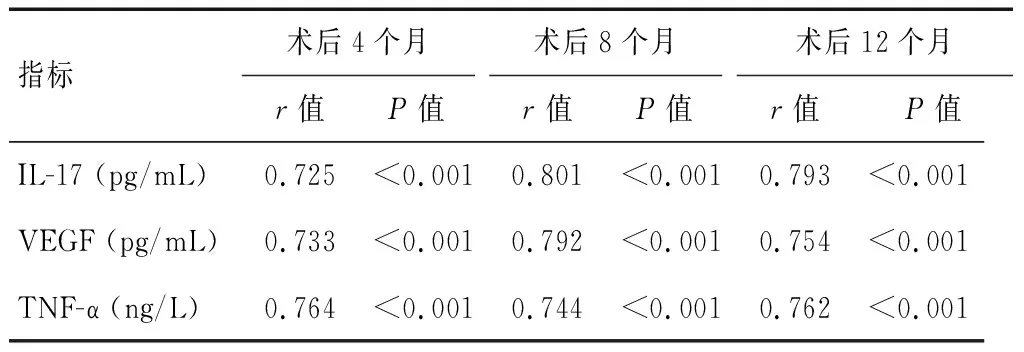
表4 房水IL-17、VEGF、TNF-a水平与眼压的相关性分析
2.4 房水IL-17、VEGF、TNF-a对无晶状体眼青光眼患者的诊断价值
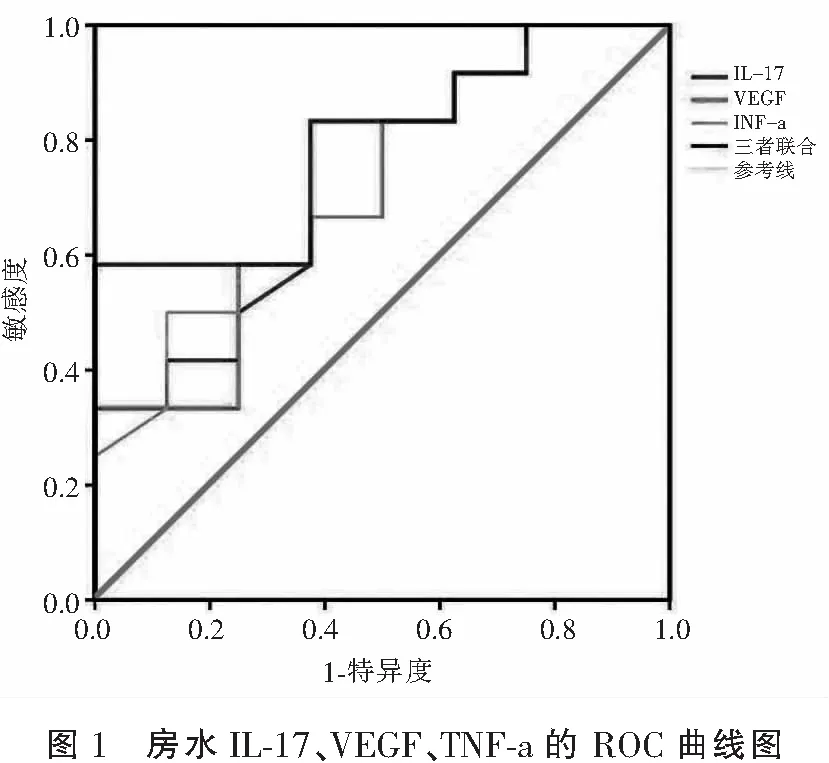
IL-17、VEGF、TNF-a的ROC曲线下面积(area under curve,AUC)分别为0.714,0.708,0.724,均大于0.7,具有一定的诊断价值。此外,三者联合检测的AUC值为0.792,诊断价值较单个指标高,见表5及图1。
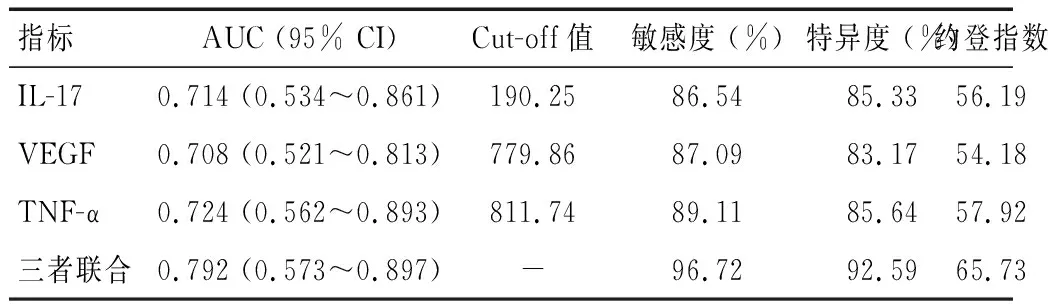
表5 房水IL-17、VEGF、TNF-a对无晶状体眼青光眼患者诊断的ROC参数
3 讨论
无晶状体青光眼发生后,常用药物治疗,其中包括β受体阻滞剂、前列腺素类药物、碳酸酐酶抑制剂等。但因患者多为儿童[9],药物的选择需依循低浓度、影响小等原则,治疗效果不尽理想,因此不少患儿最终需进行手术治疗[9]。小梁切开术是较常用的术式,临床效果较明显,然而手术有一定的风险,易对患儿眼球造成不可规避的创伤和术后并发症,术后仍需维持药物治疗,并须终身随访眼压,给患儿家庭带来了一定的经济负担[10]。青光眼是由眼压(intraocular pressure,IOP)升高引起一系列的机体应激病症,譬如,IOP升高诱发的视网膜神经节细胞(retinal ganglion cells,RGCs)进行性损伤可导致视神经退化、视神经轴突受损、视网膜神经节细胞进行性丧失[11];视神经轴突受压,轴浆流被阻断,逆行神经营养因子的运输受干扰,进而引发细胞凋亡[12]。因此,青光眼的治疗可通过滴眼液、口服药物、激光治疗或手术等手段以降低眼压。但仅依靠眼压的降低并不能抑制视神经细胞调亡[13],生长因子和炎症反应在青光眼相关组织维持眼内稳态中也起着重要作用[14-15]。
青光眼多由眼房水流出紊乱引起IOP升高,降低眼压是减缓或阻止其进行性损害的方法之一,而监测房水中多种细胞因子的表达水平可为青光眼及其他眼部疾病发生发展及防治提供一定的借鉴[16]。在青光眼的发病机制中,VEGF可促进炎症反应,增加血管的通透性,诱导新血管的形成。IL-17作为T细胞诱导的炎症反应的早期启动子,可通过促炎因子IL-1和TNF-α而加重炎症[17]。TNF是一种具有多种生物学作用的细胞因子,与细胞膜上的特定受体结合,诱导凋亡通路、NF-kappaB通路、JNK信号通路,实现细胞生长、分化、凋亡和炎症反应。其中,TNF-α作为一种促炎因子,与炎症、凋亡和细胞增殖密切相关,可激活多种下游级联反应,如通过诱导细胞凋亡和炎症等损害小梁细胞的生物功能。本研究发现,AG患者术后4个月、8个月和12个月房水IL-17、VEGF、TNF-a水平、眼压与术中比较明显升高,且高于对照组。IL-17、VEGF、TNF-a水平与眼压呈正相关,表明房水IL-17、VEGF、TNF-a在先天性白内障摘除手术后无晶状体眼青光眼发生发展过程中发挥着重要作用。此外,本研究还发现,术后4个月房水IL-17、VEGF、TNF-a的ROC下AUC值分别为0.714,0.708,0.724,均大于0.7,具有一定的诊断价值,而三者联合检测的AUC值为0.792,诊断价值更高。但本研究所涉及的样本量有限,且仅为单中心研究,具体结果仍需要进行大样本量的多中心研究加以验证。
综上所述,房水IL-17、VEGF、TNF-a水平在先天性白内障摘除手术后无晶状体眼青光眼患者中异常表达,且与眼压呈正相关,三者联合检测的诊断价值较高,有望成为无晶状体眼青光眼早期诊断和治疗的生物检测指标之一。
