猪毛蒿精油及其活性成分萜品-4-醇对黄曲霉的抑制作用研究
2021-08-11令利军赵云花马稳霞冯升来杨彩云涂艺馨
令利军,赵云花,马稳霞,冯升来,杨彩云,涂艺馨,张 继
(西北师范大学生命科学学院,兰州 730070)
黄曲霉Aspergillusflavus为黄曲霉属真菌,可导致玉米、小麦和花生等多种粮食霉变[1],其中花生是最容易受黄曲霉感染的农作物之一。黄曲霉通过分生孢子或菌核进行繁殖,菌落生长迅速且在自然界的分布广泛。黄曲霉的主要危害是其在生长过程中可以产生高毒性的次生代谢产物黄曲霉毒素[2],1993年世界卫生组织(World Health Organization, WHO)的癌症研究机构将黄曲霉毒素B1划定为Ⅰ类致癌物质[3]。因此,农作物黄曲霉污染严重威胁着人类和动物的健康,并给农业经济和畜牧业带来了巨大的经济损失[4]。目前主要通过人工合成的化学防腐剂来控制黄曲霉病害,但是化学防腐剂的长期使用易产生抗药性,杀菌剂残留和表面污染等问题[5],因此亟需开发天然、安全和高效的抗真菌剂。
植物精油是从植物组织中提取出来的具有高度生物安全性的挥发性油状液体,其主要成分为醛、酮、醚和酯等物质[6],多种植物精油具有抗真菌活性[7-9]。猪毛蒿Artemisiascoparia为菊科蒿属多年生草本植物,在我国分布广泛,对猪毛蒿精油的研究主要集中在其杀虫作用[10-13]及成分分析[14,15]等方面,未曾检索到猪毛蒿精油抑制真菌的研究报道。萜品−4−醇(Terpinen−4−ol)又名(−)−萜品−4−醇,是一种无色液体,是猪毛蒿精油及其他多种植物精油的重要组成成分[16,17]。萜品−4−醇能够通过抑制细胞迁移并诱导凋亡和亚G1细胞周期阻滞,在Hep−G2肝癌细胞中表现出强大的体外和体内抗癌作用[18]。此外,萜品−4−醇具有潜在的抗霉菌作用和广泛的应用范围,可被用作防止真菌污染的新型天然真菌抑制剂[19]。猪毛蒿精油和萜品−4−醇具有挥发性,采用熏蒸法对黄曲霉进行体内和体外防治不仅便捷,而且可以有效减少食品表面的残留。
本试验通过水蒸气蒸馏法提取猪毛蒿精油,采用气相色谱−质谱(GC−MS)联用技术对其成分进行了分析鉴定;采用DPPH自由基清除率测定其抗氧化能力测定;并以黄曲霉为研究对象,通过熏蒸法检测了猪毛蒿精油及其成分萜品−4−醇对黄曲霉的抑菌能力。旨在为了解猪毛蒿精油组成成分和抗氧化能力,及萜品−4−醇的抑制黄曲霉活性,为其在花生贮藏过程中的生物防治提供理论基础。
1 材料与方法
1.1 研究材料
猪毛蒿植株于2019年8月采自甘肃省兰州市榆中县(E 104°07′40.69",N 36°05′52.06"),全株阴干后置于水蒸气蒸馏系统中蒸馏3~4 h,收集提取物,用无水硫酸钠干燥后于4 ℃冰箱中保存备用。萜品−4−醇(CAS:20126−76−5)购自梯希爱(上海)化成工业发展有限公司。
黄曲霉 AS3.3950由西北师范大学生命科学学院微生物与植物互作实验室提供。黄曲霉孢子悬液的制备:在固体马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上接种黄曲霉AS3.3950,28 ℃培养8 d后,用无菌生理盐水将黄曲霉孢子洗出,调节孢子悬液浓度为105cfu/mL, 4 ℃冰箱保存备用。
1.2 猪毛蒿精油的化学成分分析
通过气相色谱−质谱联用(GC−MS)技术对猪毛蒿精油进行成分分析[20]。色谱柱:毛细管柱为HP−5 MS(30 m×0.25 mm×0.25 μm);参照文献[21]设置色谱柱分析程序。将1 μL样品(用己烷稀释至1%)以1:20的分流比注入。载气为氦气(99.999%),流速为1.2 mL/min。在相同条件下测定标准正构烷烃混合物(C5—C36),计算保留指数值(RI)。通过比较质谱并计算保留指数(RI)值,NIST05和Wiley275文库鉴定成分。通过平均GC−FID峰面积报告获得精油各个成分的相对百分比[21]。
质谱参数:电子轰击(E1)离子源70 eV;离子源温度230 ℃;接口温度270 ℃;扫描范围30.00~500.00 m/z;延迟时间3 min;程序时间35.33 min[22]。
1.3 猪毛蒿精油抗氧化活性的测定
参照罗亚飞等[23]的方法测定猪毛蒿精油对1,1−二苯基−2−三硝基苯肼(DPPH)中自由基的清除效果来计算其抗氧化能力。称取适量DPPH溶于无水乙醇中,配置成浓度为2×10−4mol/L的DPPH溶液,4 ℃冰箱避光储存备用;分别取适量猪毛蒿精油用无水乙醇溶解,得到浓度梯度为1、5、10、20和40 μL/mL的猪毛蒿精油溶液。
取2 mL的DPPH溶液和2 mL无水乙醇于试管中,记作A0;取2 mL浓度为1 μL/mL的猪毛蒿精油和2 mL DPPH溶液于试管中,记作A1;取2 mL浓度为1 μL/mL的猪毛蒿精油和2 mL无水乙醇于5 mL试管中,记作A2;摇匀,避光放置30 min后在517 nm下测量吸光值。同理检测其他不同浓度的猪毛蒿精油的吸光值。用以下公式计算猪毛蒿精油DPPH的自由基清除率,SR(%)=(A0―A1―A2)/A0×100。
1.4 猪毛蒿精油及萜品-4-醇对黄曲霉菌丝生长的抑制率
采用熏蒸法检测猪毛蒿精油及萜品−4−醇对黄曲霉菌丝生长的抑制作用[24],将培养7 d的黄曲霉菌饼(6 mm)接种至固体PDA(20 mL)培养基中央,在培养皿盖中央均匀的放置直径为6 mm的无菌滤纸片。分别吸取不同量猪毛蒿精油和萜品−4−醇于滤纸片上,使得猪毛蒿精油和萜品−4−醇的最终浓度分别为18.2、36.4、54.5、72.7、90.9、181.8、272.7、363.6、545.5和727.3 μL/L,以无菌培养基为对照。封口膜密封后置于(28±2)℃生化培养箱培养7 d后,通过十字交叉法测量菌落直径,每个处理3个平行。参考文献[25]的方法计算猪毛蒿精油和萜品−4−醇对黄曲霉菌丝生长的抑制率 MGI(%)=(dc+dt)/dc×100,其中MGI(%)为猪毛蒿精油及萜品−4−醇对黄曲霉菌丝生长的抑制率,dc(cm)为对照组的菌落直径,dt(cm)为试验组的菌落直径。
培养2 d后,无菌丝生长的猪毛蒿精油和萜品−4−醇浓度被定义为最小抑菌浓度(Minimum inhibitory concentration,MIC),并根据几率值分析法求毒力回归方程和50%的有效剂量(ED50),MIC及ED50值作为后续试验主要浓度。
1.5 猪毛蒿精油及萜品-4-醇对黄曲霉菌丝及孢子形态的影响
向新培养的黄曲霉平板内加入MIC和ED50剂量的猪毛蒿精油和萜品−4−醇,以等量的无菌水作为对照,熏蒸培养7 d后,通过扫描电子显微镜观察其对黄曲霉菌丝及孢子形态的影响。用无菌手术刀划取4 mm×4 mm,厚度约1.5 mm的黄曲霉菌块,将菌块放置在装有2.5%戊二醛固定液的青霉素小瓶中固定24 h。采用PBS缓冲液将固定的菌丝块洗涤3次后,乙醇(30%,50%,70%,85%,90%,100%)梯度脱水。自然干燥后,将菌块置于导电胶上,镀金并通过扫描电子显微镜(SEM)进行观察并拍照。
1.6 猪毛蒿精油及萜品-4-醇对黄曲霉孢子萌发的影响
吸取100 μL(107cfu/mL)的黄曲霉孢子悬浮液于PDA固体培养基上并涂布均匀,添加MIC(727.3 μL/L)和 ED50(472.7 μL/L)剂量的猪毛蒿精油以及 MIC(272.7 μL/L)和 ED50(158.1 μL/L)剂量的萜品−4−醇熏蒸培养,以等量的无菌水作为对照,(28±2)℃培养箱中培养3 d后观察并拍照。
1.7 猪毛蒿精油及萜品-4-醇对花生中黄曲霉菌数的影响
参照屈璐璐[26]的方法分别探究了猪毛蒿精油和萜品−4−醇对花生中黄曲霉菌落数的影响。取2.5 g健康无病变的花生于10 mL无菌摇菌管中,移液枪吸取200 μL 浓度为105cfu/mL的黄曲霉孢子悬液于花生中,充分摇匀后在摇菌管盖子中央分别加入 MIC(27.3 μL/L)和 ED50(472.7 μL/L)剂量的猪毛蒿精油以及MIC(272.7 μL/L)和ED50(158.1 μL/L)剂量的萜品−4−醇,用封口膜密封后放置在(28±2)℃生化培养箱中熏蒸培养5 d后测定霉菌数防控效果,以不加猪毛蒿精油及萜品−4−醇的花生作为空白对照。分别使用5 mL生理盐水洗脱对照组和处理组中的孢子,振荡20 min使样品中的孢子均匀地悬浮于生理盐水中。分别取100 μL孢子悬浮液加入3个无菌PDA培养基中,涂布均匀后在(28±2)℃生化培养箱中倒置培养2 d观察记录。选取适宜稀释倍数下的培养基统计菌落数。样品霉菌菌落数按下式计算,样品菌落数(cfu/g)=(3个平板菌落数的平均值×稀释倍数)/2.5。
1.8 数据统计与分析
使用SPSS 20.0软件对数据进行统计分析,根据 Duncan’s 新复极差法检验在P<0.05 水平的差异显著性。用Origin Pro 9.0软件作图。
2 结果与分析
2.1 猪毛蒿精油的GC-MS分析结果
猪毛蒿精油的GC−MS结果分析如表1所示。猪毛蒿精油含有24种化合物,占精油总量的99.99%。其主要成分为桉叶油醇(43.8%)、反 2,7−二甲基−4,6−辛二烯醇−2(11.16%)、大根香叶烯(8.88%)、松香芹酮(6.26%),其中萜品−4−醇在猪毛蒿精油中的含量为2.81%。
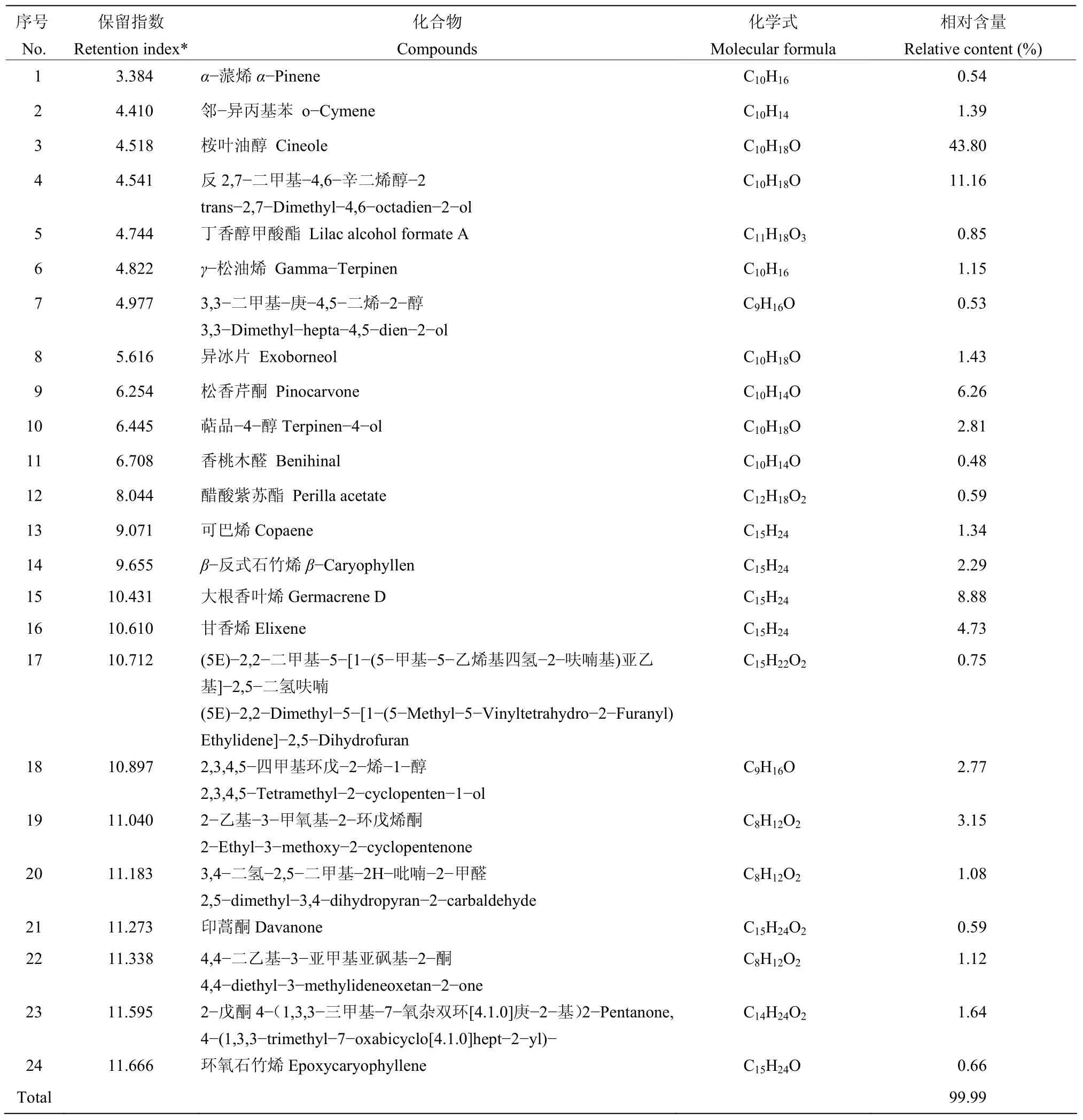
表1 猪毛蒿精油的化学成分Table 1 Chemical composition of the essential oil derived from A.scoparia
2.2 抗氧化活性
猪毛蒿精油对DPPH自由基的清除率如图1所示,猪毛蒿精油对DPPH自由基的清除率与浓度呈正相关。当浓度为40 μL/L时,猪毛精油对自由基的清除率为79.3%;当猪毛蒿精油浓度为20 μL/mL时,自由基清除率为56.9%。
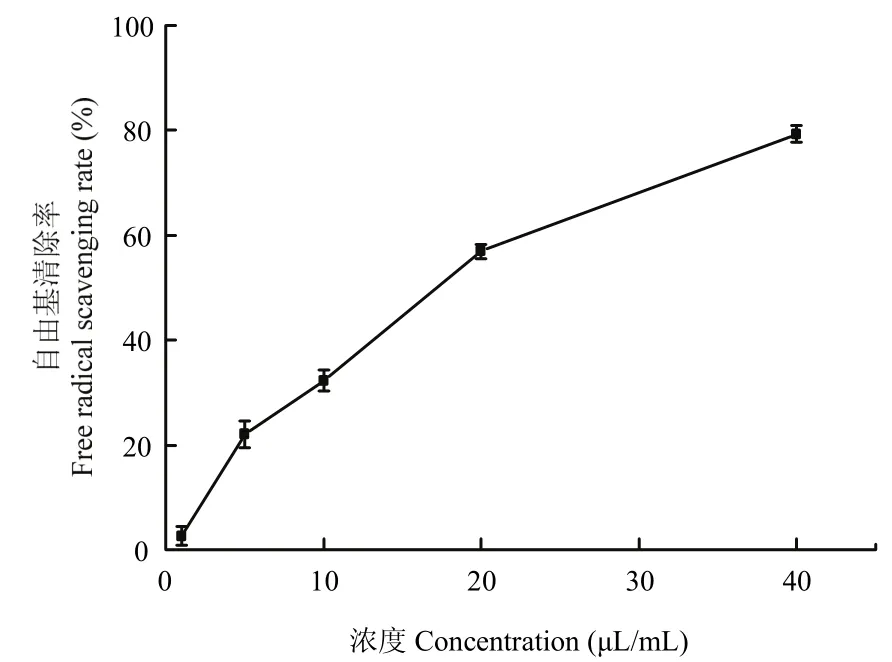
图1 猪毛蒿精油对DPPH自由基的清除能力Fig.1 Scavenging effect of essential oil from A.scoparia (EOA) on DPPH radical
2.3 菌丝生长抑制率
猪毛蒿精油和萜品−4−醇对黄曲霉菌丝生长都具有良好的抑制活性,且抑制活性与浓度呈正相关(图2)。高浓度的猪毛蒿精油和萜品−4−醇在熏蒸处理的2 d后,完全抑制了黄曲霉菌丝的生长,取这两个值为最小抑菌浓度MIC做后续研究。由表2可知,在同一浓度熏蒸处理2 d后,萜品−4−醇对黄曲霉菌丝生长的ED50低于猪毛蒿精油,猪毛蒿精油和萜品−4−醇的ED50分别为727.3和272.7 μL/L。萜品−4−醇对黄曲霉的防治效果更最佳。

图2 猪毛蒿精油和萜品-4-醇对黄曲霉菌丝生长的抑制率Fig.2 Inhibitory effects of essential oil from A.scoparia (EOA)and terpinen-4-ol on the mycelial growth of A.flavus
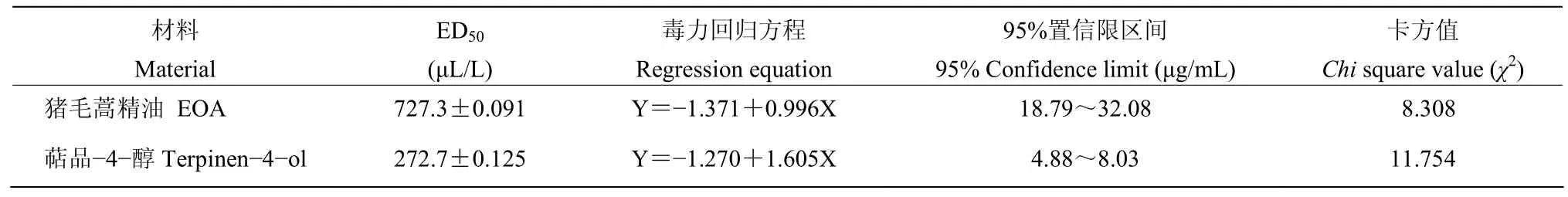
表2 猪毛蒿精油和萜品-4-醇对黄曲霉的毒杀活性Table 2 Insecticidal activity of essential oil from A.scoparia (EOA) and terpinen-4-ol of A.flavus
2.4 猪毛蒿精油及萜品-4-醇对黄曲霉超微结构的影响
为了进一步探究猪毛蒿精油和萜品−4醇对黄曲霉的抑菌机理,分别以MIC和ED50为目标浓度,熏蒸处理5 d后,对黄曲霉的超微结构进行扫描电镜观察。猪毛精油及萜品−4−醇对黄曲霉超微结构的影响如图3所示,对照组黄曲霉菌丝表面平整均匀,具有较好的线性,粗细均一(图3A);黄曲霉分生孢子头结构圆整,分生孢子呈圆形(图3B)。与对照组相比较用ED50(472.7 μL/L)猪毛蒿精油熏蒸培养5 d后,黄曲霉的菌丝表面出现了严重的皱缩,菌丝粗细变得不均一(图3 C);黄曲霉孢子头不再是完整的圆形,孢子表面凹陷甚至破裂(图3C)。猪毛蒿精油MIC(727.3 μL/L)熏蒸处理后的黄曲霉菌丝皱缩扭曲,出现疣状表面,并且抑制了黄曲霉孢子的产生,在扫描电镜下未看到有黄曲霉孢子产生(图 3C)。在 ED50(158.1 μL/L)和 MIC(272.7 μL/L) 萜品−4−醇熏蒸处理 5 d后,与对照相比(图3C)并未引起黄曲霉孢子头及孢子显微结构出现明显的变化(图3G,I);但是菌丝形态都出现了明显的变化,ED50(158.1 μL/L)浓度的萜品−4−醇可导致菌丝破裂并皱缩(图3F),MIC(272.7 μL/L)浓度的萜品−4−醇在引起菌丝皱缩的同时还会导致菌丝末端膨大,菌丝失去线性并折叠(图3H)。
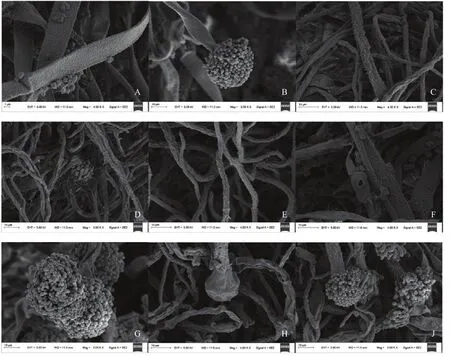
图3 猪毛蒿精油和萜品-4-醇对黄曲霉超微结构的影响扫描电镜图Fig.3 Scanning electron micrographs of A.flavus after treatment with essential oil from A.scoparia (EOA) and Terpinen-4-ol
2.5 孢子萌发
为了探究猪毛蒿精油和萜品−4−醇对黄曲霉孢子萌发的影响,同样采取熏蒸法。熏蒸培养72 h后,对照组PDA培养基表面呈现肉眼可见浓密菌丝,菌丝表面呈黄绿色(图4A)。在ED50(472.7 μL/L)浓度的猪毛蒿精油熏蒸培养72 h后,与承载猪毛蒿精油的滤纸片正对的PDA培养基上肉眼未见菌丝,未与滤纸片正对的PDA培养基表面呈现出浓密的白色菌丝,但没有色素合成(图4B)。MIC(727.3 μL/L)浓度的猪毛蒿精油熏蒸培养72 h后,PDA培养基表面肉眼未见菌丝(图4 C)。与对照组相比,分别与浓度为ED50(158.1 μL/L)和MIC(272.7 μL/L)浓度的萜品−4−醇共培养72 h后,PDA培养基表面都出现了肉眼可见的菌丝,很明显黄曲霉菌丝的量随着萜品−4−醇浓度的增大而减少(图4 D,E)。

图4 猪毛蒿精油和萜品-4-醇对黄曲霉孢子萌发的影响Fig.4 Inhibitory effect of essential oil from A.scoparia (EOA) and terpinen-4-ol on the spore germination of A.flavus
2.6 花生体内黄曲霉菌数
花生体内抑菌试验结果显示,浓度为 MIC和 ED50的猪毛蒿精油和萜品−4−醇熏蒸处理可以显著降低花生体内霉菌数(图5)。在浓度为MIC(727.3 μL/L)和 ED50(472.7 μL/L)的猪毛蒿精油熏蒸处理5 d后,花生中黄曲霉的菌落数分别为3.6×104和 5.64×105cfu/g,而浓度为和MIC(272.7 μL/L)和ED50(158.1 μL/L)萜品−4−醇熏蒸处理的花生中菌落数分别为4.24×105和1.46×106cfu/g,都显著低于对照组花生中的霉菌数1.32×107cfu/g(P<0.05)。

图5 猪毛蒿精油和萜品-4-醇对花生中霉菌数的影响Fig.5 Effect of essential oil from A.scoparia (EOA) and terpinen-4-ol on peanut mold counts
3 讨论
GC−MS结果表明,猪毛蒿精油中已鉴定的化合物种类有24种,与已报道的猪毛蒿精油的成分分析相比较[27,28],发现不同猪毛蒿精油有效的种类及含量都各不相同,这可能与猪毛蒿生长的地域及时间不同有一定的关系。研究发现,精油的抗菌活性并非由主要成分决定,次要成分也起着重要的角色[29]。精油的抗氧化能力对食品防腐具有一定的贡献,Karoui和Hassoun[30]研究发现,罗勒叶精油因其具有较好的抗氧化能力在防止脂质氧化方面更有效。
由于植物精油的疏水亲脂性,精油可以扩散到微生物的细胞膜中从而增加其渗透性导致细胞内成分流失[31],达到抑菌作用。有研究表明,植物精油可以通过破坏真菌细胞壁的完整性,从而抑菌真菌的生长[32],本文扫描电镜结果显示,猪毛蒿精油与其成分萜品−4−醇导致黄曲霉菌丝形态扭曲、塌陷、皱缩、甚至破损,这与Wang等[33]的结果一致。Oliveira等[34]发现百里香精油可以通过破坏黄曲霉细胞膜和诱导细胞凋亡达到抗真菌的效果。本研究发现,猪毛蒿精油和萜品−4−醇不仅可以通过破坏黄曲霉菌丝的形态,抑制黄曲霉菌丝的生长,还可以有效地抑制黄曲霉孢子的萌发,其原因可能是猪毛蒿精油可以通过破坏黄曲霉细胞膜来抑制黄曲霉。
精油作为保鲜材料已经成为目前研究的热点,Burt等[35]研究发现,肉桂醛和香芹酚可以防治猕猴桃被致病菌的侵染;小茴香精油可以影响花生贮藏中黄曲霉群落,达到保鲜的效果[36];Tahmasebi等[37]发现,肉桂精油可减少致病真菌对油桃的损害;萜品−4−醇做成壳聚糖材料,可以作为一种新型的抗真菌防腐剂来改善玉米样品的货架期,防止真菌和黄曲霉毒素的污染[38]。本研究通过猪毛蒿精油及萜品−4−醇对花生保鲜研究发现,两者均可以达到保鲜效果。
综上所述,猪毛蒿精油及其成分萜品−4−醇可以显著抑制黄曲霉菌丝生长和孢子萌发,为进一步探究猪毛蒿精油及萜品−4−醇抑制黄曲霉菌的实际应用价值,体内抑菌试验发现,猪毛蒿精油及萜品−4−醇可以显著减少花生中黄曲霉的菌落数,防止花生被黄曲霉侵染。
