1株高效降烟碱烟草内生菌的筛选、鉴定及其代谢途径研究
2021-08-11林智慧王雪仁韩晓刚
苏 丹,林智慧,王雪仁,封 磊,宋 萍,韩晓刚,李 航,游 凯,刘 洁,黄 楠
(1.福建农林大学a.资源与环境学院,b.林学院,福州350002;2.福建省烟草公司三明市公司,福建三明365000)
烟碱(Nicotine),又名尼古丁,是一种高毒性且不易降解的环境污染物[1],过量摄入能抑制中枢神经系统,使呼吸停止和心脏麻痹[2]。同时,作为烟草中生物碱的主要成分,烟碱又是衡量烟叶品质的关键指标,过高的含量会对其工业可用性产生不利影响。因此,如何降低并控制烟碱含量对于环境保护及改善烟草质量均具有重要意义。常见的降解烟碱方法主要包括物理法、化学法及生物法。其中,生物法降解烟碱因具有见效快、专一性强、污染性低等特点,而展现出良好的应用潜力[3]。YUAN等[4]从烟草种植土壤中分离并鉴定出1株高效尼古丁降解菌中间苍白杆菌(Ochrobactrum intermedium)DN2,在含有0.5~4.0g·L-1的尼古丁基础培养基中能降解所有尼古丁;RUAN等[5]从烟草废弃物的土壤中筛选到节杆菌(Arthrobacter sp.)aRF-1,该菌株降解尼古丁的最佳条件为30℃,pH 7.0,可降解烟碱浓度高达0.8g·L-1。WANG等[6]从土壤中分离筛选出1株具有尼古丁较高降解能力的恶臭假单胞菌(Pseudomonas putida),13h可完全降解0.4g·L-1的尼古丁,其耐受质量浓度高达0.6g·L-1;YAO等[7]从烟草废弃物中分离出1株具有尼古丁降解能力的节杆菌株(Arthrobacter sp.),预测了尼古丁降解质粒pAO1的尼古丁分解代谢基因,但未发现编码于质粒上的代谢功能基因。综上所述,尽管国内外在有关微生物降解烟碱方面已有较多报道,但其研究对象主要集中在假单胞菌属、节杆菌属、苍白杆等少数几类菌属[4-7],且大多来源于土壤或烟草废弃物[8-10]。而近年来,随着植物内生菌研究领域的不断扩大,一些生长在烟草体内的内生菌也引起了研究者的广泛关注。张天栋等[11]从烤烟烟叶中分离出1株内生粗糙脉孢霉菌(Neurospora crassa),其发酵液添加到成品烟叶中,可有效降低33.9%的烟碱含量。赵丽萍等[12]从62个烟叶样品中筛选出1株内生细菌,该菌在烟碱为1‰的培养基中培养54h,降解率为98.76%。迄今为止,有关烟草内生菌的研究工作尚处于初始阶段,特别是有关内生菌降解烟碱方面仅有少量几篇报道,研究内容也多集中在菌株的分离鉴定方面,而不同类型内生菌对烟碱降解机制的相关研究,则尚未见报道。本研究以从福建三明烟区分离出的1株具有降解烟碱功能内生菌为研究对象,测定该菌株的生长及其对烟碱的降解特性,并初步探究该菌株的烟碱降解途径,其研究成果对于提升烟碱污染治理手段以及丰富微生物烟碱的降解机制具有重要的参考价值。
1 材料与方法
1.1 材料
供试烟草植株为福建三明烟区种植的云烟87,2019年3月采集并用于分离内生菌。供试烟碱分析纯(质量分数97%)购自罗恩公司;烟碱标准品(HPLC≥98%)购自麦卡希;甲醇色谱级(质量分数≥99%)购自阿拉丁公司;磷酸氢二钠,磷酸二氢钾纯度均为色谱纯,其他试剂均为AR级试剂。
供试培养基为烟碱培养基:K2HPO4·3H2O13.3 g,MgSO4·7H2O 0.2g,微量元素溶液(MnSO4·7H2O 0.4g,Ca-Cl2·2H2O 0.2g,FeSO4·7H2O 0.2g使用0.1mol·L-1HCl定容至100 mL)0.5mL,水1000mL,pH值为7.0,于121℃灭菌20min[13]。烟碱灭菌后用0.22μm有机滤膜过滤,根据需要添加。上述烟碱培养基中加入18g琼脂即为烟碱固体培养基。
1.2 方法
1.2.1 烟碱降解内生细菌的筛选与纯化 采用组织分离和涂布平板法分离内生菌[14],从三明烟区选取健康的烟草植株,对其根、茎、叶进行清洗、消毒。以最后一次清洗的无菌水为空白对照,以此检验表面消毒效果。将植物组织研磨成匀浆,稀释涂布在烟碱固体培养基上,30℃恒温培养箱培养3d。挑取不同形态的单菌落多次划线纯培养,直至得到纯菌。
1.2.2 菌株形态特征观察 将分离出的纯菌接种到NB平板培养基中,置于恒温生化培养箱30℃培养2~3d,形成明显的菌落,观察平板上菌落的大小。
挑取纯化后的菌落接种于装有NB液体培养基的三角瓶中,将其放于150r·min-1、30℃的振荡器中培养至稳定期。培养液经过8000r·min-1离心30min去掉上清液保留菌体,菌体用无菌水反复洗涤,收集。将收集到的菌体加入2.5%的戊二醛溶液,并置于4℃下保存固定,用PBS缓冲液洗涤菌体3次,然后依次用乙醇和醋酸异戊酯脱水、置换,经过冷冻真空干燥后,喷金制样。利用扫描电子显微镜下(Phenom ProX SEM)观察菌体形态特征。
1.2.3 菌株16S rDNA序列测定 取菌株在NB培养基上划线培养3d,采用FastDNA SPIN Kit试剂盒提取DNA,对该菌株16S rDNA基因序列进行分析。16S rDNA扩增的引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR 反应程序:95℃预变性5min,95℃30s,56℃30s,72℃90s,25 次循环,72℃延伸10min,4℃保存。DNA 纯化和测序工作委托上海美吉生物公司完成。测序结果在NCBI 上的Blast进行同源性比对,下载同源性较高的已知分类菌种的16S rDNA 碱基序列。系统发育树图采用MEGA6软件的Neighbor-Joining法构建。
1.2.4 菌株生长曲线动力学研究 取菌株到NB 液体培养基中,在150r·min-1、30℃的恒温振荡器中培养24h后作为种子液。种子液以1%的接种量接至新鲜的液体烟碱培养基中,烟碱浓度为0.5g·L-1,然后继续在150r·min-1、30℃的恒温振荡器中培养,每3h对培养液进行取样,测量其在600nm 波长下的OD 值。以菌液的培养时间为横坐标,600nm波长下的OD值为纵坐标,以同时间取出离心后的液体烟碱培养基为空白,绘制菌株的生长曲线。
利用Slogistic模型对菌株进行生长曲线动力学拟合[15]。通过拟合得到的模型参数,计算出最大比生长速率μmax和微生物生长的延滞期λ。
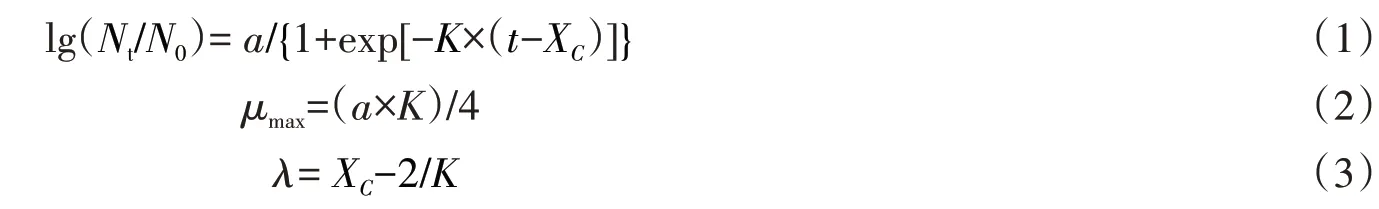
式中:t为时间;Nt和N0为在t时和初始时间的微生物数量;a为最大菌数Nmax与初始菌数N0的差值;XC为达到最大生长速率的时间;K为在时间点XC的最大生长速率;μmax为最大比生长速率;λ为生物生长的延滞期。
1.2.5 菌株的生长抑制浓度 在烟碱浓度为0.1、0.5、1.5、2.0、3.0、4.0、5.0g·L-1的液体培养基中,接种1%的种子液,150r·min-1、30℃下恒温培养至24h后测定其在600nm下的OD值。每个处理3组重复。
1.2.6 烟碱浓度测定 采用高效液相色谱(赛默飞U3000)测定烟碱浓度[16]。色谱柱为Agilent ZORBAX Eclipse Plus C18(4.6×250mm,5μm),紫外检测器,检测波长为254nm。流动相为甲醇:0.02mol·L-1磷酸盐缓冲溶液(pH=6.5)=60∶40,流速0.6mL·min-1,进样量10μL,柱温35℃。
1.2.7 降解特性 将培养24h的种子液接种到烟碱培养基中,设置pH值分别为5.0,6.0,7.0,8.0,9.0;接种量分别为1%,2%,5%;烟碱浓度分别为0.5、1.5、2.0、3.0g·L-1,测定菌株Y5的生长情况及对烟碱的降解情况。
1.2.8 降解动力学模型 采用一级反应动力学公式(4)对不同烟碱浓度下,菌株降解结果进行拟合。

式中:C0为体系中烟碱的初始浓度(mg·L-1);Ct为t时刻体系中烟碱的浓度(mg·L-1);k为烟碱降解速率常数(h-1);t为降解时间(h)。
1.2.9 降解产物分析 利用GC-MS(岛津GCMS-TQ8040)对不同时间段烟碱降解产物进行分析。色谱柱为SH-Rxi-5Sil MS色谱柱(Column, 30m×0.25mm×0.25μm)。程序升温:60℃保持2min,以10℃·min-1速率升温至280℃,保持10min。离子源温度为250℃,扫描范围28~500m/z,载气为氦气,流速为1.0mL·min-1。采集完的数据,经过GCMS Postrun Analysis定性处理,检索谱库为NIST14谱库。
2 结果与分析
2.1 烟碱降解菌的筛选和鉴定
利用烟碱作为唯一的碳源、氮源,从烟草叶片中分离筛选出1株高效降烟碱内生细菌Y5。菌株Y5为不透明的淡橘色湿润菌体,菌落呈不规则杆状(图1)。该菌株在扫描电子显微镜下的形态特征显示菌体为直的短杆菌,菌株大小约为(0.4~0.8)μm×(1.3~2.2)μm。
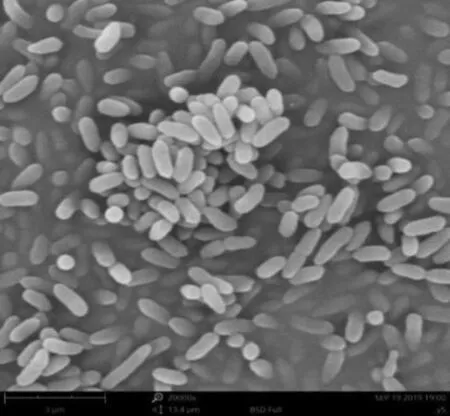
图1 菌株Y5的扫描电子显微镜图Figure 1 Scanning electron microscope image of strain Y5
该菌株的16S rDNA 基因序列与NCBI 数据库中许多假单胞菌属基因序列同源性为99%。通过MEGA6软件中Neighbor-Joining 法构建系统发育树。由图2 可知,菌株Y5 与假单胞菌属位于同一分支。推测菌株Y5属于假单胞菌,命名为Pseudomonassp.Y5。向GenBank数据库提交序列,注册登录号为MN515143。

图2 菌株Y5的系统进化树Figure 2 Evolutionary tree of strain Y5
2.2 菌株Y5生长曲线的动力学研究
采用Slogistic 模型对该菌株的生长曲线进行拟合(图3),发现该模型的拟合程度较高,R2为0.99385,可以较好地描述Y5的生长情况。菌株Y5在9.1~9.4h达到最大生长速率,Y5的D600值最高达0.13841±0.00458,最大比生长率约为0.04,生长延迟期约为7.5h。

图3 Slogistic模型拟合的菌株Y5生长曲线Figure 3 Growth curve of strain Y5 fitted by Slogistic model
2.3 烟碱对菌株Y5的抑制浓度
由图4 可知,不同浓度的烟碱对菌株Y5 生长产生不同程度的影响,其光密度随着烟碱浓度的增大先增加后减少。当烟碱浓度为0.5~2.0g·L-1时,菌株生长良好。其中,烟碱浓度为2.0g·L-1时菌株生长最好,其OD600为0.270。当烟碱浓度为0.1g·L-1,其光密度仅为0.027,细胞几乎不生长。当烟碱浓度为3.0、4.0、5.0g·L-1,其OD600分别为0.044、0.047和0.048,细胞生长受到抑制。

图4 抑制菌株Y5生长的烟碱浓度Figure 4 Concentration of nicotine that inhibits strain Y5 growth
2.4 菌株Y5的降解特性
2.4.1 pH值对菌株Y5生长及降解能力的影响 由图5a可知,当pH值为7.0~8.0时,菌株Y5对烟碱的降解率分别为98%和88%,其中pH值为7.0时,降解率最高;当pH值为5.0~8.0时,烟碱降解率均为65%以上,说明菌株Y5在pH值为5.0~8.0的范围内,降解活性较高。由图5b可知,在pH为5.0~9.0的范围内,菌株均能生长。当pH为5.0、6.0和9.0时,菌株生长较为缓慢,但是30h后也达到平衡,且平衡时的光密度与pH为7.0时的光密度无明显差异。由此可知,该菌株对pH的生长适应范围较宽;在pH为5.0~8.0范围内,具有较高的降解活性。因此,在实际生产应用中具有潜力。

图5 初始pH值对菌株Y5降解烟碱(a)及生长(b)的影响Figure 5 Effect of initial pH on nicotine degradation (a) by strain Y5 and growth (b)
2.4.2 接种量对菌株Y5生长及降解能力的影响 由图6a可知,培养9h菌株Y5对烟碱的降解率分别为50%、72%和89%。可见,随着接种量的增加,菌株降烟碱的速率逐渐增大。经过12h培养,菌株Y5对烟碱的降解率基本一致,说明接种量对菌株最终的降解率并无明显差异。由图6b可知,在菌株的生长延迟期及对数增长期,增加接种量明显影响了菌体数量的增长,然而在达到生长稳定期,菌体数量并没有明显增加。考虑到接种量的增加对菌株稳定期的生长量并无显著差异,并且在12h烟碱降解率基本一致。因此,在后续试验中接种量仍为1%。
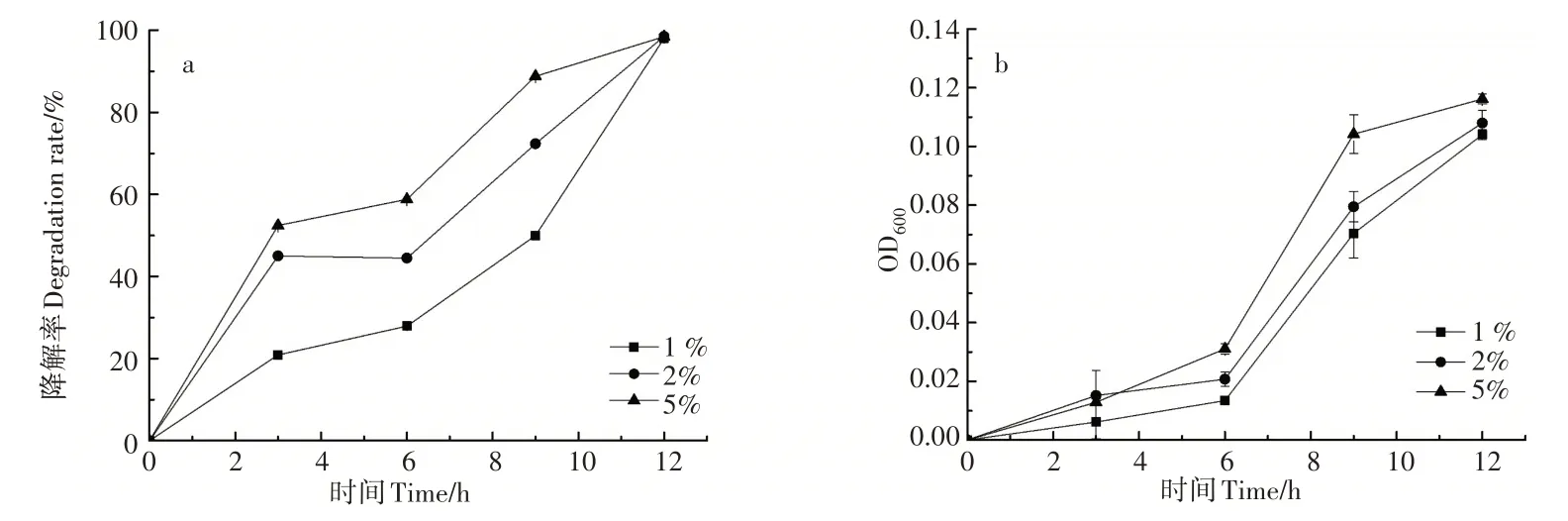
图6 接种量对菌株Y5降解烟碱(a)及生长(b)的影响Figure 6 Effect of inoculum on nicotine degradation (a) by strain Y5 and growth (b)
2.4.3 烟碱浓度对菌株Y5生长及降解能力的影响 由图7a可知,当烟碱浓度为0.5g·L-1时,降解速率最快,在15 h内基本完全降解烟碱。当烟碱浓度为1.5,2.0,3.0g·L-1,菌株Y5在48 h基本完全降解烟碱,降解率分别为99%、99%和96%。由图7b可知,当烟碱浓度低于2.0g·L-1时,菌株的生长随烟碱浓度的增加而增加;在烟碱浓度为2.0g·L-1时,达到最大OD值。当烟碱浓度高于2.0g·L-1时,菌株生长受到抑制。结果表明,该菌株在烟碱浓度为0.5~2.0g·L-1时生长良好,同时对烟碱降解效果明显。当烟碱浓度为3.0g·L-1时,菌株生长受到抑制,但生长菌株适应一段时期后,能够在48h内基本完全降解烟碱。

图7 烟碱浓度对菌株Y5降解烟碱(a)及生长(b)的影响Figure 7 Effect of nicotine concentration on nicotine degradation(a) by strain Y5 and growth(b)
2.4.4 降解动力学分析 采用一级反应动力学公式对测定结果进行拟合。由图8可知,菌株Y5对烟碱浓度为0.5,1.5,2.0,3.0g·L-1的降解速率常数分别为0.30738,0.1142,0.10759,0.07348h-1。结果表明,接种量一定时,随着烟碱浓度增加,菌株降解烟碱的速率减小。
图8 菌株Y5对不同浓度烟碱的降解动力学Figure 8 Degradation kinetics of different concentrations of nicotine by strain Y5
2.5 菌株Y5降解烟碱的代谢产物分析
通过GC-MS 对菌株Y5 烟碱降解过程中的代谢产物进行分析。结果发现,培养液主要成分除烟碱(RT=12.440min)外,还包括3-丙酰基吡啶(RT=10.270min)、2,5-Dimethyl-1H-indol-6-amine(RT=13.3min)、脱甲基尼古丁(RT=13.477min)、N-甲基异烟酰胺(RT=13.565min)、尼古提林(RT=14.277min)、2,6-二叔丁基对甲酚(RT=14.571min)、去氢新烟碱(RT=14.836min)、5-pyridin-3-yloxolan-2-one(RT=15.985min)和可铁宁(RT=17.134 min)等物质。其中,N-甲基异烟酰胺与烟碱脱甲基途径中的N-甲基烟酰胺为异构体。6-二叔丁基对甲酚为烟碱添加的抗氧化剂。去氢新烟碱也称新烟草碱,是烟草中的生物碱成分之一,存在于提取的烟碱中。
研究表明尼古提林(产物I,图9b)、脱甲基尼古丁(产物II,图9c)、可铁宁(产物III,图9d)为烟碱代谢过程中常见的中间产物,这些物质在一些微生物代谢烟碱过程中被检测到,如Pseudomonassp. HF-1[17]、Pseudomonassp. CS3[18]、Shinellasp. HZN1[19]。3-丙酰基吡啶(产物IV,图9e)与5-pyridin-3-yloxolan-2-one(产物V,图9f)为新发现的代谢产物。

图9 菌株Y5降解烟碱的产物质谱图Figure 9 Mass spectrum of nicotine metabolites of strain Y5
2.6 菌株Y5烟碱代谢的可能途径
在本研究中,菌株Y5 代谢烟碱检测到脱甲基尼古丁、3-丙酰基吡啶、可铁宁和尼古提林等物质。如图10所示,菌株Y5 降解烟碱由于作用在吡咯环上的反应不同,可分别生成尼古提林、脱甲基尼古丁和可铁宁。与Pseudomonassp.HF-1类似,脱甲基尼古丁可转化为麦斯明[17],进而生成3-丙酰基吡啶,表明烟碱结构上的吡咯环已经打开。此外,可铁宁可转化为5-pyridin-3-yloxolan-2-one,然后吡咯环开环生成3-琥珀酰吡啶、6-羟基-3-琥珀酰吡啶。以上均是通过攻击烟碱的吡咯环,然后逐渐开环,这个规律与其他假单胞菌属类似。已有的研究表明,吡咯途径是假单胞菌属降解烟碱的主要途径,但是该类微生物具有代谢多样性[8]。本研究观察到菌株Y5中对吡咯烷的初始反应与P. putidaS16中的最初反应具有较大的区别[20]。菌株Y5 的初始反应是对吡咯环的多方面攻击生成尼古提林、脱甲基尼古丁、可铁宁,而P. putidaS16中的第一步是通过烟碱的吡咯烷环上的脱氢生成N-甲基麦斯明。此外,在已报道的P. putidaS16中并未检测到尼古提林、脱甲基尼古丁和可铁宁等物质。故推测菌株Y5 以一条新的吡咯烷代谢途径降解烟碱(图10)。
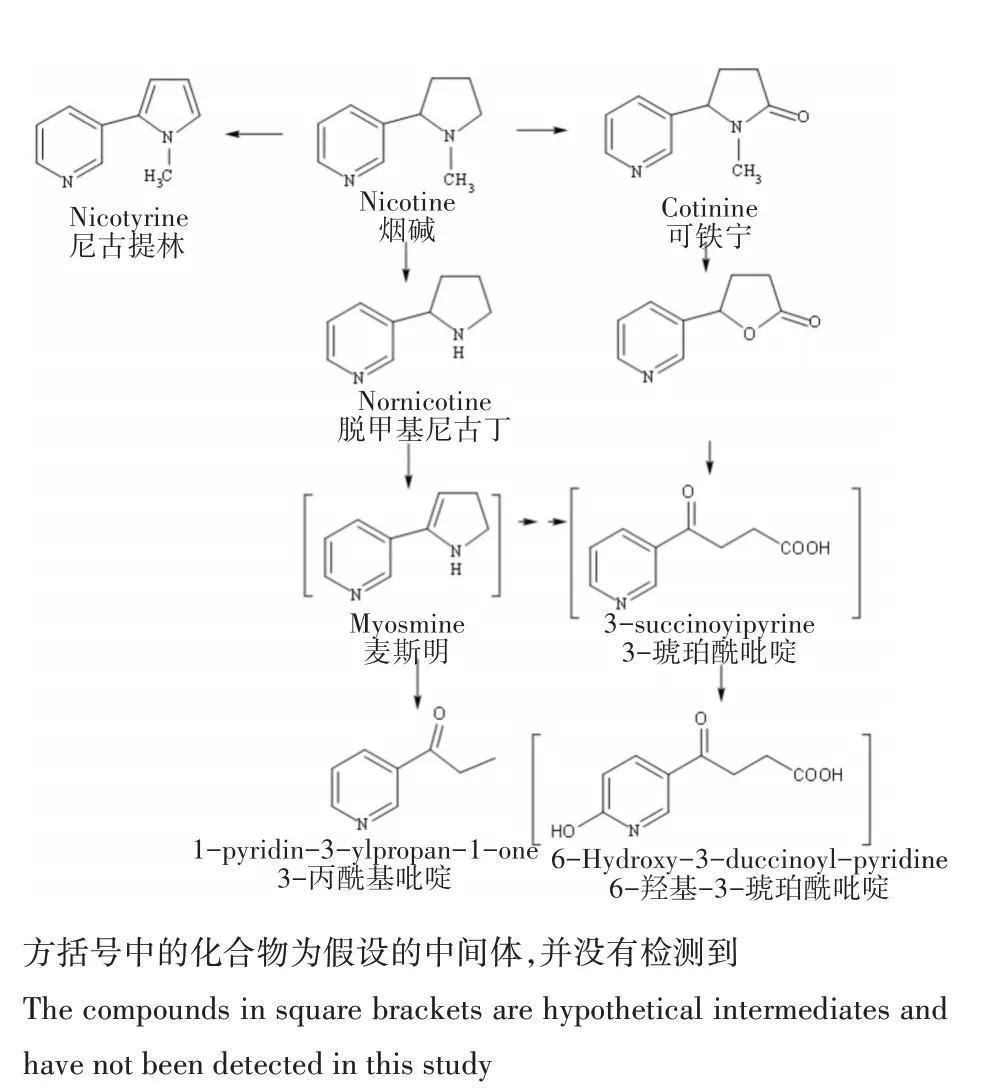
图10 菌株Y5降解烟碱的代谢途径Figure 10 Metabolic pathway of nicotine degradation by strain Y5
3 讨论与结论
在本研究中,根据16S rDNA 序列和菌株形态分析,将具有高效降解烟碱能力的烟草内生细菌Y5 鉴定为假单胞菌(Pseudomonassp.)。烟碱可作为降烟碱微生物的碳源、氮源,为微生物的生长提供营养物质,同时也具有高毒性,过高的烟碱浓度会抑制微生物的生长。本研究中Y5 菌株能够以烟碱为唯一的碳源、氮源,可耐受烟碱为3.0 g·L-1,明显高于Pseudomonassp. HF-1[21]。该菌株在pH 为5.0~8.0 的范围内,生长良好且具有较高的降解活性。与已有报道相比,Pseudomonassp.HF-1 降解烟碱的最适条件为30℃,pH 值仅为6.5~7.5[21]。而Pseudomonas plecoglossicidaTND35在pH为5.5~7.0具有较高的降解活性[22]。此外,随着接种量的增加,Y5菌株对烟碱的降解速率明显增加,但并没有提升对烟碱的最终降解率。尹彪[23]发现Pseudomonassp.CS3 培养24 h,在5%~10% 的接种量下,对烟碱降解率的差异不明显,而1%的接种量对尼古丁降解率显著降低,说明接种量影响菌株CS3对烟碱的降解率。
尽管许多研究表明,降烟碱微生物容易适应被污染的环境,从受烟碱污染的环境中筛选得到大量的细菌、真菌[24],该类微生物能够降解高浓度的烟碱,但是局限于从环境中筛选。最近几年,舒明[9]从烟草提取液中筛选得到的降烟碱假单胞菌JY-Q,最高能降解烟碱浓度为5.0g·L-1。邓娜娜等[25]从烟田土壤中筛选到Arthrobactersp. AH14,最高能在120 h 内将6.0g·L-1的烟碱完全降解,该菌株为目前国内分离得到的降烟碱能力最强的菌株。本研究中Y5 菌株在烟碱浓度为3.0g·L-1时,能够在48h 内对烟碱降解率为96%。而赵丽萍从烟叶样品中筛选出1株内生细菌,达到类似的降解率需要54h[12]。
微生物降解烟碱的途径已被广泛研究,多数集中在细菌和一些真菌。目前,阐述比较完整的代谢途径主要有4种:以真菌为主的脱甲基途径、吡啶途径、吡咯烷途径以及吡啶吡咯烷交叉途径。除了上述报道比较完整的代谢途径外,还存在另外的途径,主要集中在Pseudomonas plecoglossicidaTND35[22]、Pseudomonassp. HF-1[26]、Pseudomonassp. Nic22[3]、Shinellasp. HZN1[19]、Pseudomonas geniculataN1[27]、Pseudomonassp. CS3[18]。这些菌株在降解烟碱过程中,检测到一些不同上述途径的中间产物,如尼古提林、可铁宁和1-Methyl-5-(pyridin-3-yl)pyrrolidin-2-ol等物质。在一些菌株代谢过程中还检测到脱甲基尼古丁、麦斯明和尼古提林。这些菌株具体的代谢途径有关的酶以及降解有关的基因还需进一步研究。本研究,通过GC-MS对Pseudomonassp.Y5在烟碱培养基中进行代谢产物分析,检测到一系列代谢产物,如尼古提林、脱甲基尼古丁、3-丙酰基吡啶、可铁宁和5-pyridin-3-yloxolan-2-one等物质。其中,3-丙酰基吡啶与5-pyridin-3-yloxolan-2-one为新发现的代谢产物,在烟碱的代谢途经中未见报道。根据检测结果,推测菌株Y5以一条新的吡咯烷代谢途径降解烟碱。
