喷雾冷冻干燥技术制备乳双歧杆菌Probio-M8微胶囊制剂
2021-08-11徐鹏飞王昊乾郑新飞包秋华张和平
徐鹏飞,王昊乾,郑新飞,郭 帅,包秋华,张和平
(内蒙古农业大学乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室内蒙古自治区乳品生物技术与工程重点实验室 呼和浩特 010018)
益生菌是一种活的微生物,以适当水平使用时,会给宿主带来益处[1]。随着微生物相关研究技术的成熟,对双歧杆菌的研究也更加深入,并将双歧杆菌作为有益微生物用于食品中。大量研究表明,双歧杆菌因对人体健康的重要影响而被视为重要的肠道益生菌之一,其能够在人体肠道内定植[2]。双歧杆菌在现代食品及食品添加剂中被广泛应用,具有调整肠道菌群,增强免疫功能[3],促进消化吸收,缓解便秘[4]和改善神经调节[5]等益生功能。乳双歧杆菌Probio-M8 是分离自健康妇女母乳中的优良乳源益生菌,具有改善免疫应答功能[6]与较好的耐酸耐胆盐等特性,在功能性食品和医疗行业具有较高的潜在应用价值。
微生物在加工、贮藏、运输过程中的存活率和稳定性是影响其产品品质的主要因素[7]。双歧杆菌是严格厌氧的微生物,在生产利用的每个环节都可能受到氧化损伤。微胶囊化是生产菌制品工艺中最常用的方法[8],可使敏感细菌避免高温[9]、高压,氧气损伤,酸性环境,冷冻过程以及通过胃肠道的影响[10-11]。喷雾干燥和冷冻干燥技术的出现为益生菌用于食品及医疗行业提供了有效的生产方式。目前大部分双歧杆菌制品的生产都是利用冷冻干燥技术生产的,在冷冻干燥过程中不可避免地造成部分双歧杆菌损伤甚至死亡。喷雾冷冻干燥(Spray-freeze-drying,SFD)是一种新型的干燥方式,结合了喷雾干燥及冷冻干燥的优点[12],可以生产优质的产品,在产品品质、结构、生物活性及化合物保有率等方面,喷雾冷冻干燥技术比其它干燥技术更具优势[13-14]。
本研究采用喷雾冷冻干燥技术制备微胶囊,以乳双歧杆菌Probio-M8 干燥后的存活率、水分含量和水分活度为指标,进行喷雾冷冻干燥工艺优化,筛选适合乳双歧杆菌Probio-M8 的喷雾冷冻干燥工艺条件,研究胶囊粉末形态特征、干燥前、后脂肪酸变化及胃、肠液耐受能力,旨在为双歧杆菌Probio-M8 工业化生产应用提供技术支持。
1 材料及方法
1.1 材料与试剂
乳双歧杆菌Probio-M8(Bifidobacterium animalis subsp.lactis Probio-M8,Bifidobacterium lactis Probio-M8),内蒙古农业大学乳酸菌资源库(Lactic Acid Bacteria Collection Center,LABCC)。
脱脂乳、改良MRS 培养基(MRS+0.5% L-半胱氨酸盐酸盐),广东环凯微生物科技有限公司;氯仿(分析纯)、甲醇(分析纯)、甲醇钠(分析纯)、正己烷(分析纯)、胃蛋白酶、胰蛋白酶、牛胆盐,天津市汇杭化工科技有限公司。
1.2 仪器与设备
气相色谱仪(Technologies 6850),安捷伦科技有限公司;智能水分活度测量仪(HD-3A 型),无锡市华科仪器仪表有限责任公司;扫描电镜(TM4000PLUS),日本株式会社日立高新技术那珂事业所;台式高速冷冻离心机(5424R 型),德国Eppendorf AG;离心机(DL-6M 型),湖南湘仪试验室仪器开发有限公司;喷雾冷冻干燥器(YC-3000),上海雅程设备有限责任公司;智能安全型超净工作台(ZHJH-C 型),上海智城分析仪器有限公司;厌氧工作站(DG250),英国DWS 公司。
1.3 方法
1.3.1 菌种活化及增殖培养 将冷冻保存(-80℃) 的乳双歧杆菌Probio-M8 菌种接种于改良的MRS 培养基中,37 ℃恒温培养24 h,活化完成后,用移液枪以2%(体积分数) 的比例接种于种子培养基中,37 ℃恒温厌氧培养24 h,按5%(体积分数)接种量接种于发酵培养基(800 mL)中,37 ℃恒温厌氧培养至稳定期。
1.3.2 菌悬液制备 培养完成后的增殖培养液离心15 min(4 ℃,4 000 r/min),弃上清,取沉淀,用无菌磷酸缓冲液(PBS)洗涤并重新悬浮,上述操作重复3 次。以10%脱脂乳溶液复溶至原体积,充分混匀后喷雾冷冻干燥制备微胶囊。
1.3.3 Box-Behnken 响应面试验优化因素的最佳水平 根据预试验分析,利用Box-Behnken 的中心组合试验设计原理,对3 因素3 水平进行试验设计,采用Design Expert 8.0.6 软件进行响应面试验结果的回归分析。
1.3.4 活菌计数及存活率计算 准确称取5.00 g 喷雾干燥后收集的粉末,使用稀释平板计数法进行活菌计数。选取3 个稀释梯度的菌液1 mL 打入平板,倾入改良MRS 琼脂培养基,混匀后37 ℃倒置培养72 h。记录培养皿上的菌落数量(CFU),菌落数以CFU/g 表示。菌体存活率计算公式:

表1 响应面试验因素与水平Table 1 The factors and levels of response surface test

式中,N——干燥后样品单位体积的活菌数(CFU/g);N0——干燥前样品单位体积活菌数(CFU/g)。
1.3.5 水分含量及水分活度测定 选取水分含量测定仪测定样品的水分含量。称取样品3.00 g,测定,做3 次平行。选取智能水分活度仪测量样品的水分活度,取适量脱脂乳均匀铺平托盘,测定并预热。称取适量样品,均匀铺平托盘,平行测定3 次。
1.3.6 脂肪酸甲酯化提取及含量测定 脂肪酸提取采用Bligh&Dyer 法[15]。将菌体复溶,离心,用无菌磷酸缓冲液(PBS)洗涤2 次,称取0.5 g 菌体,加入1.9 mL 氯仿-甲醇(体积比1∶2)溶液,振荡15 min,加入0.625 mL 氯仿,加入0.625 mL 去离子水,振荡15 min,4 ℃,5 000×g 离心10 min,吸取下层相,用氮气吹干,加入1 mL 甲醇钠-甲醇溶液,置冰中1 min,振荡5 min,加600 μL 正己烷,振荡5 min,4 ℃,5 000×g 离心5 min,取上层相,置气相瓶中,进行气-质谱分析。
脂肪酸含量测定采用GC/MS 法。色谱条件:气相色谱条件:PEG 毛细管填充柱(30 m×0.22 mm 柱内径,0.25 μm 膜厚,Restek);载气:氦气;流速:29.6 mL/min;总流量:0.5 mL/min;柱压:63.4 kPa;进样口温度:260 ℃;检测器温度:280 ℃;柱温升温程序:起始温度100 ℃,保持1 min,随后以4 ℃/min 速率增至250 ℃并在250 ℃保持5 min。计算脂肪酸各峰的峰面积、保留时间及质谱范围,根据标样进行比对(37 种sigma 脂肪酸和C19cyc11的标样),对每个样品重复测定3 次。
脂肪酸含量采用归一化法,所有组分出峰之和按100%计算,各脂肪酸相对含量为该脂肪酸峰面积与总体脂肪酸峰面积和的比值。
1.3.7 形态观察 使用扫描电子显微镜(SEM)观察微胶囊化样品的形态特征。将样品粉末安装在样品架上,镀金,在15 kV 和真空下放大500 倍观察。
1.3.8 胃、肠液耐受能力 评估胶囊化粉末在胃肠道条件耐受性,配制pH 2.5 的灭菌磷酸缓冲液,加入除菌的胃蛋白酶制成模拟人工胃液;配制pH 8.0 的灭菌磷酸缓冲液,加入除菌的胰蛋白酶和1.8%胆盐制成模拟人工胰液。
将收集胶囊化粉末加入5.0 mL 磷酸缓冲液,混匀,作为原菌液,稀释,计数,作为0 h 的数值。取原菌液0.5 mL 置4.5 mL 人工胃液试管中,37℃厌氧培养3 h,计数。取3 h 培养的0.5 mL 菌液置4.5 mL 肠液试管中,37 ℃厌氧培养4 h 和8 h,分别进行活菌计数,37 ℃厌氧培养72 h。
2 结果与分析
2.1 SFD 工艺条件对微胶囊品质的影响
在干燥过程中,细菌受到很多干燥压力,即热、氧化和脱水等。菌体细胞膜、细胞壁、核糖体和DNA 在热冲击下受到影响,导致细菌活力丧失[16]。干燥热的冲击会导致细菌膜和蛋白质的结构和功能完整性发生不可逆转的变化,这些基本功能和结构的保存对于细菌的生存及其功能的保持至关重要。此外,残留水分含量应足够低,以防止在储存过程中产品变质。益生菌粉的水分含量太低也会造成伤害。水分含量低于2%会增加细菌细胞膜中不饱和脂肪酸氧化的风险,并破坏脂肪酸周围的水合单位[17],影响细菌活力。
2.1.1 干燥温度对Probio-M8 微胶囊品质的影响在进料速度15 mL/min,喷嘴直径1.0 mm 条件下喷雾冷冻干燥,测定乳双歧杆菌M8 微胶囊品质,研究干燥温度对微胶囊品质的影响,结果见图1。
由图1可知,在喷雾冷冻干燥过程中,不同干燥温度的菌株存活率存在差异,40 ℃时最高,存活率为72.92%。温度过低时干燥所需能量不足,随干燥时间延长,菌体脱水时间逐渐增加,菌体受损,进而导致死亡。温度过高,超出菌体生长最适温度,破坏细菌结构,导致存活率下降。随着温度升高,水分含量和水分活度下降,而水分含量都保持在2%以上,在此温度范围内,细胞膜不饱和脂肪酸被氧化的风险降低,同时说明菌体的水结合能力也在变化,并且低水分含量和低水分活度在微胶囊后续贮藏过程中起积极作用[18]。

图1 干燥温度对双歧杆菌M8 微胶囊品质的影响Fig.1 Effect of drying temperatures on the quality of Bifidobacterium M8 microcapsules
2.1.2 进料速度对Probio-M8 微胶囊品质的影响制备M8 益生菌悬浮液,在干燥温度40 ℃,喷嘴直径1.0 mm 条件下喷雾冷冻干燥,测定M8 微胶囊的品质,研究进料速度对微胶囊品质的影响,结果见图2。
由图2可知,不同的进料速度对于菌体存活率及微胶囊的水分含量及水分活度影响不明显。这是因为所用细菌属严格厌氧菌,进料速度缓慢,细菌悬液暴露在空气的时间稍长,菌体氧化损伤,影响菌体存活率。加快进料速度,缩短了喷雾冷冻干燥的时间,提高了生产效率。

图2 进料速度对双歧杆菌M8 微胶囊品质的影响Fig.2 Effect of the feed rates on the quality of Bifidobacterium M8 microcapsules
2.1.3 喷嘴直径对Probio-M8 微胶囊品质的影响制备M8 益生菌悬浮液,在干燥温度40 ℃,进料速度15 mL/min 条件下喷雾冷冻干燥,测定M8 微胶囊品质,研究进料速度对微胶囊品质的影响,结果见图3。

图3 不同喷嘴直径对双歧杆菌M8 微胶囊品质的影响Fig.3 Effect of different nozzle diameters on the quality of Bifidobacterium M8 microcapsules
由图3可知,喷嘴直径1.5 mm 时菌体存活率最高,达73.41%。喷嘴直径对微胶囊的水分含量和水分活度影响不显著,微胶囊水分含量均小于5%。在试验喷雾阶段,1 mm 喷嘴偶有堵塞现象,影响黏度过大的悬浮液,在选择喷嘴时需综合考量。
益生菌产品须具有较好的益生特性和贮藏稳定性,并且益生功能的发挥是建立在高存活率益生菌的基础上,因此提高生产过程中益生菌的存活率是关键。
2.2 响应面法优化喷雾冷冻干燥制备微胶囊工艺
在单因素条件对微胶囊品质影响的试验基础上,以存活率为评价指标,设计三因素三水平共17 个点的响应面分析。用来估计误差的零点试验重复5 次,具体设计及结果见表2。

表2 旋转中心组合设计结果Table 2 Design results of combined rotation center
采用Design Expert 8.0 软件响应面分析程序进行二次多项回归拟合,获得3 种工艺参数与存活率的二次多项式回归模型方程:
存活率=73.336-2.25A+0.92B-1.91C+0.07AB+0.45AC+1.03BC-7.27A2-2.65B2-4.00C2。

表3 二次多项式模型的系数及其方差分析Table 3 Coefficients and ANOVA for the developed quadratic polynomial model
对存活率的二次模型进行方差分析,结果表明:二次项A2、C2对喷雾冷冻干燥制备M8 微胶囊的存活率影响极显著(P<0.01),二次项B2对喷雾冷冻干燥制备M8 微胶囊的存活率影响显著(P<0.05)。整体模型为极显著(P<0.01);失拟项的P 值为0.1576>0.05,说明失拟项不显著,无失拟因素存在,表明试验设计误差小,回归方程与实际情况基本符合,可用该回归方程代替真实的试验点做预测;变异系数C.V.(Coefficient of variation)为2.40%(小于5%),表明方程有良好的重现性。此方程模型的系数R2=0.9598,调整后Radj2=0.9081,说明该回归方程与试验数据的拟合度为90.81%,具有较高的可信度。综上所述,此回归方程可用于喷雾冷冻干燥法制备Probio-M8 微胶囊存活率的预测。
由图4a 可知,存活率随干燥温度的增加而上升,40 ℃时达到最大值,之后温度增加导致存活率下降。随进料速度的增加,存活率变化不显著,而干燥温度起积极作用,二者对提高存活率有交互作用。图4b 显示干燥温度与喷嘴直径对存活率的交互影响,两者的增加对提高存活率有促进作用,达到峰值后,两者的增加导致存活率下降。由图4c 可知,进料速度与喷嘴直径交互作用曲面的曲率无明显差别,两者之间交互作用不显著。
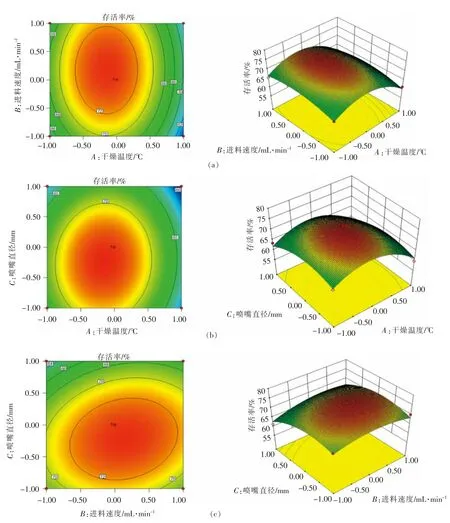
图4 因素交互作用响应面图及相应的等高线图Fig.4 Response surface plot and contour map of interactive effects of various factors
响应面试验结果:干燥温度40 ℃,进料速度15 mL/min,喷嘴直径1.5 mm,此时预测存活率为73.79%。为了验证结果的可靠性,采用优化的工艺条件进行验证,得到平均存活率为73.21%,与理论预测值相比无显著差异(P>0.05)。
2.3 工艺条件对颗粒形态的影响
喷雾冷冻干燥法制备的产品形态对其应用有重要的影响,例如:品质、流动性、溶解性、贮藏时间等。使用扫描电镜(SEM)对不同工艺条件制备的微胶囊粉末进行形态观察。图5a~5i 显示,总体形态都存在近似球状和不规则形状的颗粒及聚集颗粒,而且颗粒表面存在机械裂缝,不同工艺条件产生的形状存在差异。由图5a、5b、5c 可知,不同干燥温度导致颗粒状态差别较大,图5a 显示:30℃时干燥能量低,干燥时间大大增加,颗粒皱缩严重,多颗粒聚集、黏附在一起,类球体结构损伤大,不能较好地包裹菌体;图5c 显示存在多种颗粒形态,部分颗粒皱缩聚集,其余颗粒表面存在塌陷与气孔,相比图5b 所示,40 ℃时产生的颗粒形态较为完整。不同喷嘴直径产生的颗粒大小不同,如图5d、5e、5f 所示,在相同干燥温度下,使用1.5 mm的喷嘴制备微胶囊颗粒比其它2 种口径的喷嘴更为完整,用其它喷嘴直径制备的颗粒表面存在严重的皱缩与塌陷。图5g、5h、5i 所示,不同进料速度对颗粒形成的影响不明显。

图5 不同工艺条件下SEM 观察的微胶囊颗粒形态Fig.5 Morphology of microcapsule particles observed by SEM under different process conditions
喷雾冷冻干燥产品的形态受工艺参数与保护性载体配方的影响[19]。有研究表明喷雾冷冻干燥制备的微胶囊形态大多为球形,颗粒形态基本一致,部分形状不规则是由制备过程中多种因素相互作用产生的[20-21]。颗粒的大小与形态取决于载体溶液配方与工艺参数[21]。颗粒的形状受多种载体溶液复合影响,特定的脱脂乳浓度、糖类、溶液浓度带来不规则的颗粒形状,在工艺参数的影响下,颗粒表面出现变化及聚集现象[22-23]。这与许多研究结果一致,在冷冻干燥过程中大量的颗粒会聚集成团[24]。此外,载体溶液的组成影响溶液的性能、黏度、分散性等,最终导致颗粒形态的不同[23]。
2.4 干燥前、后脂肪酸的变化
细胞膜脂肪酸组成对细菌抵抗外界不良因素有重要影响。外界环境变化时,细菌细胞膜首先受到冲击,细菌作出反应,细胞膜脂肪酸组成发生改变,不饱和脂肪酸增加,维持细胞膜的流动性[25]。在喷雾冷冻干燥过程中,细胞膜的流动性与细胞膜中UFA/SFA(不饱和脂肪酸与饱和脂肪酸的比值)的比值有着紧密的联系。表4列出干燥前、后菌体细胞膜脂肪酸组分的变化。
从表4数据可知,Probio-M8 细胞膜脂肪酸成分主要由C12:0(月桂酸)、C14:0(肉豆蔻酸)、C16:0(棕榈酸)、C16:1(棕榈油酸)、C18:0(硬脂酸)、C18:1w9c(油酸)、C18:3(亚麻酸)、C19cyc11(环丙烷脂肪酸)8 种脂肪酸组成,它们占总脂肪酸含量的87%以上,说明这8 种脂肪酸是M8 主要脂肪酸。此外,还有部分脂肪酸被检出,因含量较低且不能稳定,检测出而未做比较分析。干燥前、后,饱和脂肪酸含量下降7.42%(P<0.05),不饱和脂肪酸含量上升10.53%(P<0.05)。其中,不饱和脂肪酸C16:1、C18:1w9c、C19cyc11在干燥后显著上升(P<0.05)。有研究表明,菌体所处环境变化,产生应激反应,菌体产生环丙烷脂肪酸,影响细胞膜的弹性和伸缩性,增强细胞膜的流动性和细胞应激能力,与本研究中,在干燥后C19cyc11(环丙烷脂肪酸)含量上升相符合[26-27]。干燥后UFA/SFA 的比值提高了0.37,可能是菌体为维持正常的生理代谢,细胞进行适应性改变,提高自身的存活率。

表4 喷雾冷冻干燥前、后菌体膜脂肪酸相对含量Table 4 Relative content of fatty acids in the bacterial cell membrane before and after spray freeze drying
2.5 微胶囊胃、肠液耐受能力分析
为使益生菌充分发挥作用,必须确定益生菌可以抵抗胃肠道中低pH、胃蛋白酶和胆盐等抑菌物质,确保益生菌活着进入胃肠道并发挥作用[13]。本试验选用的菌株具有良好的胃、肠液耐受性。
由表5可知,试验组微胶囊在经模拟人体胃液3 h 与肠液8 h 消化后,活菌数保持的数量级不变,存活率达81.99%,与菌悬液对照组相比,存活率提高1.44%。微胶囊主要在人工胃液阶段丧失部分活力,在人工肠液中存活率达93.93%,保持较好的耐受性。试验表明,Probio-M8 经处理,菌体本身具有的优良的胃、肠液耐受特性没有改变,微胶囊化后耐受性未显著提高。胃、肠液耐受性的提高可能是保护性载体的作用,在喷雾冷冻干燥制备过程中,益生菌被载体包裹,降低进入胃肠道过程中胃酸、胆汁酸等带来的侵害作用。有研究表明将壳聚糖掺入制剂中,可以显着改善保护作用。在配方中使用肠溶性聚合物可以增强微胶囊技术对益生菌的保护能力。除了增加细胞的抗性外,这些聚合物还促进双歧杆菌在人体上层肠道更好的释放,并提高了这些微生物在模拟胃肠道条件下的存活率[28]。

表5 喷雾冷冻干燥制备微胶囊的胃、肠液耐受性Table 5 Tolerance of microencapsulated gastrointestinal fluid prepared by spray freeze drying
3 结论
喷雾冷冻干燥法制备乳双歧杆菌Probio-M8微胶囊结果表明:干燥温度对微胶囊品质起决定作用,适宜的温度会赋予微胶囊高存活率、低水分含量与水分活度,并能基本维持菌体原有结构与基本功能,对贮藏品质与功能产生积极影响。在干燥温度40 ℃,喷嘴直径1.5 mm,进料速度15 mL/min 条件下,以喷雾冷冻干燥法制备的Probio-M8微胶囊具有较为完整的颗粒形态及高存活率。喷雾冷冻干燥前、后菌体细胞膜不饱和脂肪酸含量显著提高,菌体细胞做出适应性改变,以保持菌体完整性。微胶囊化的益生菌M8 在模拟人工胃、肠液中具有良好的耐受能力,消化处理后存活率达81.99%。综上,喷雾冷冻干燥法制备优良微胶囊具有工业化应用潜力。
