乳酸菌抗氧化特性及其katA基因分析
2021-08-11张开屏赵艳红李权威吕金积张海荣田建军
张开屏,赵艳红,李权威,闫 娜,吕金积,张海荣,田建军*,靳 烨
(1内蒙古商贸职业学院食品工程系 呼和浩特 010070 2内蒙古农业大学食品科学与工程学院 呼和浩特 010018 3内蒙古草原晶鑫食品有限公司 内蒙古巴彦淖尔 015000)
乳酸菌(Lactic acid bacteria,LAB)是可以发酵糖类产生乳酸的无芽孢、革兰氏染色阳性(G+)、厌氧或专性厌氧细菌的通称[1]。1857年巴斯德首次发现乳酸菌,1908年Metchnikoff 在发酵酸奶中发现乳酸菌的抗氧化作用[2]。科研人员逐渐发现,乳酸菌不仅可以改变食品的风味,提高食品的营养价值,还具有抑菌,降胆固醇,抗氧化等功能特性[3-4]。乳酸菌在生长过程中产生的醋酸、甲酸、丁酸、乳酸等代谢物能够降低培养体系的pH 值,从而抑制一些不耐酸杂菌的生长[5]。除此之外,有些乳酸菌能够产生具有生物活性的蛋白质、多肽等物质[6],这些物质具有抑菌和抗氧化等功能特性[7]。乳酸菌的抗氧化体系主要分为2 个部分:一部分是活性氧(Reactive oxygen species,ROS)自由基(Free radical)清除系统,另一部分是氧化还原调控系统[8]。ROS、自由基清除系统阻止各种ROS 和自由基的生成,清除已经形成的ROS 和自由基,从而防御ROS 和自由基对细胞的进一步危害[9]。机体内的ROS 主要包括羟自由基(·OH)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、超氧阴离子(O2-)和过氧化氢(H2O2),在分子水平上,这些ROS 可与细胞靶点发生反应,导致蛋白质变性、功能丧失、核酸分子水平上发生突变,形成分子水平上的氧化应激反应[10]。
如今,乳酸菌的抗氧化特性引起广泛关注[11-12],对乳酸菌抗氧化基因的研究也有众多报道。如Kobatake 等[13]发现加氏乳杆菌SBT2055 通过激活JNK 信号增加Nrf2 蛋白水平,上调Sod1-3、Trx1、Hmox1 和NQO1 等靶基因mRNA 表达,从而增强抗氧化应激防御能力。katA 基因是标记H2O2酶的基因,H2O2酶(EC1.11.1.6)属于生物体内抗氧化酶中的一种,在动物、植物、微生物中广泛存在,H2O2酶能够催化细胞内H2O2分解,在细胞中起到抗逆作用[14]。1998年Hammes 等[15]首次提出清酒乳杆菌具有katA 基因。2005年Jamet 等发现katA 在活菌和共生菌中均受氧调控,katA 表达仅在自由生活菌的指数生长阶段检测到,是外源H2O2诱导的唯一的H2O2酶基因[16]。2008年Najjari 等[17]提出清酒乳杆菌具有编码血红素依赖的触酶活性的katA基因。2011年努尔古丽·热合曼等[18]通过研究katA基因的检测方法,发现通过特异性PCR 引物可以将混合乳酸菌种群中的清酒乳杆菌和其它乳酸菌区分开。
目前,乳酸菌抗氧化特性的研究主要集中在乳酸菌完整细胞和发酵上清液的研究上。如Lee等[19]对植物乳杆菌(L.plantarum)KCTC3099 的完整细胞抗氧化活性的研究表明,完整细胞对脂质体过氧化具有高抑制作用,抑制率为38.6%,并且通过试验发现该菌株对超氧阴离子自由基具有一定的清除能力。对乳酸菌抗氧化基因的表达方面还鲜有综合的分析,本试验通过抗氧化基因在乳酸菌中的表达和抗氧化基础指标来研究乳酸菌的抗氧化特性,为以后在分子水平上研究乳酸菌抗氧化作用机理提供支持。
1 材料与方法
1.1 材料与试剂
乳杆菌:ZF6、ZF8、ZF13、ZF22、TR1-1-3、X31为内蒙古农业大学食品科学与工程学院肉品科学实验室保藏、鉴定菌株。
TPY 培养基,北京陆桥技术有限责任公司;细菌基因组DNA 提取试剂盒,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
PCR 仪(VERITI 96WELL),美国Applied Biosystems;凝胶成像系统(Gel Dox XRt)、电泳仪(PowerPac),美国BIORAD;酶标仪(SYNERGY H1),美国Bio Tek 公司;微量紫外分光光度计(80-3006-61),英国BioDrop;高速冷冻离心机(Centrifuge 5430R),德国Eppendorf。
1.3 方法
1.3.1 乳酸菌发酵上清液和完整细胞菌悬液的制备 发酵上清液:菌株传至3 代,1 000 r/min 离心20 min,收集上清液,即为发酵上清液。
完整细胞菌悬液的制备:将培养好的乳酸菌3 代菌液移至离心管中,离心后收集沉淀的菌体并用PBS 洗涤,然后在10 000 r/min 条件下离心15 min,再次收集菌体,重复3 次,最后在菌体中加入PBS 缓冲液,所得溶液即为完整细胞菌悬液。
1.3.2 清除羟自由基能力测定 参照文献[20]和[21],根据结果按公式(1)计算样品的羟自由基清除率。
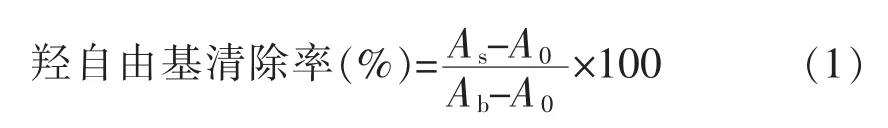
式中,AS——1 mL 的邻二氮菲溶液+1 mL PBS 溶液+1 mL 样品+1 mL FeSO4溶液+1 mL H2O2溶液的OD510nm值;Ab——1 mL 的邻二氮菲溶液+1 mL PBS 溶液+1 mL 蒸馏水+1 mL FeSO4溶液+1 mL 蒸馏水的OD510nm值;A0——1 mL 的邻二氮菲溶液+1 mL PBS 溶液+1 mL 蒸馏水+1 mL FeSO4溶液+1 mL H2O2溶液的OD510nm值。
1.3.3 清除DPPH 自由基能力测定 参照文献[22],根据结果按公式(2)计算样品的DPPH 清除率。
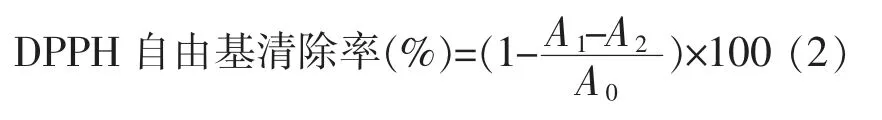
式中,A1——1 mL 的DPPH 溶液+1 mL 样品的OD517nm值;A2——1 mL 无水乙醇+1 mL 样品的OD517nm值;A0——1 mL DPPH 溶液+1 mL 无 水 乙醇的OD517nm值。
1.3.4 清除超氧阴离子自由基能力的测定 参照文献[23],根据测定结果按公式(3)计算样品的超氧阴离子自由基清除率。
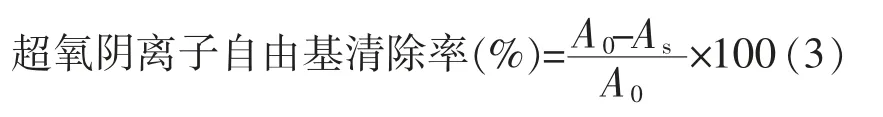
式中,A0——空白样吸光度;AS——待测样品吸光度。
1.3.5 乳酸菌H2O2耐受性的测定 按体积分数2%将培养好的菌液分别接种在添加H2O2的TPY培养基中,H2O2的起始浓度分别为0.00,0.40,0.70,1.00 mmoL/L,37 ℃培养48 h,间隔12 h 取菌液,测定其OD600nm值,共测定4 次[24]。
1.3.6 乳酸菌DNA 的提取 使用生工生物工程(上海) 股份有限公司细菌DNA 基因组抽提试剂盒,将3 代细菌培养液振荡混匀取1.5~2 mL 至离心管中,在4 ℃,10 000 r/min 条件下离心1 min,上清液倒入废液缸,参照试剂盒提取工艺执行,DNA 于-20 ℃条件下保存。
1.3.7 PCR 扩增 katA 基因检测,PCR 条件:上游引物702F:5'-AATTGCCTTCTTCCGTGTA,下游引物310R:5'-AGTTGCGCACAATTATTTTC[25]。
PCR 反应体系(25 μL):DNA 模板1 μg/L,PCR 缓冲液(1.5 mmol/L MgCl2),0.8 mmol/L dNTPmix,每个引物0.8 μmol/L,2U Taq DNA 聚合酶。
反应程序:首先94 ℃预变性5 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1 min,30 个循环;末端延伸72 ℃、10 min。用1.0 g/100 mL 琼脂糖凝胶电泳检测DNA 及PCR 产物[26]。
1.4 数据统计分析
使用软件SPSS 19.0 和Origin 7.5 对试验数据进行分析和做图,全部数据均采取“平均数±标准差”表示。
2 结果与分析
2.1 乳酸菌清除羟自由基能力分析
羟自由基(·OH)是重要的活性氧物质之一,试验通过测定乳酸菌对羟自由基的清除能力来验证6 种乳酸菌的抗氧化性能。6 种乳酸菌的发酵上清液与完整细胞菌悬液的羟自由基清除率的对比结果如图1所示。
由图1可知,6 株试验菌株上清液和菌悬液对羟自由基都有一定的清除能力,试验菌株上清液和菌悬液对羟自由基的清除率的均值分别为31.71%和51.82%,上清液对·OH 清除能力约是菌悬液清除能力的0.61 倍。其中5 株乳酸菌的菌悬液对羟自由基清除能力整体上比发酵上清液的清除能力强,且ZF13 和TR1-1-3 菌株上清液与菌体悬浮液对羟自由基清除率差异显著(P<0.05),其主要原因是乳酸菌的菌悬液代表乳酸菌胞内物质,而发酵上清液主要代表胞外代谢产物,可推测试验菌株对羟自由基的清除能力主要是由胞内物质决定的,胞外代谢物起协同作用。
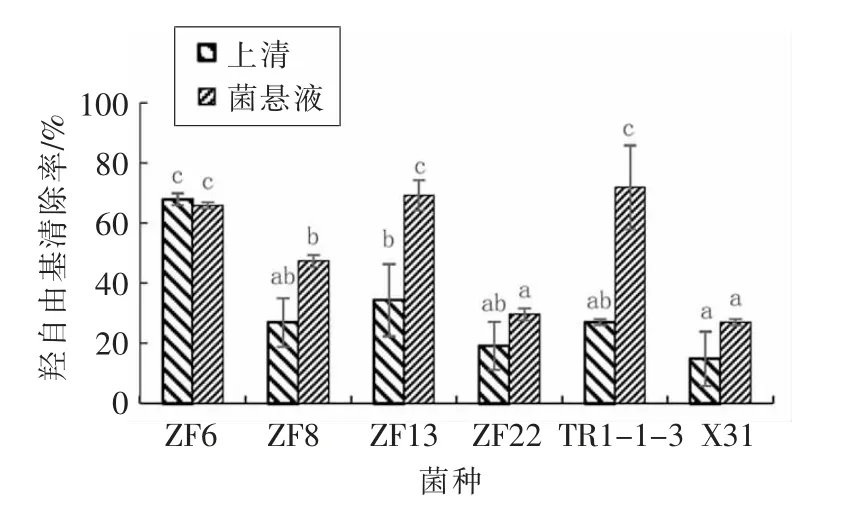
图1 发酵上清液与完整细胞菌悬液的羟自由基清除率的对比图Fig.1 Comparison of hydroxyl radical scavenging rates between fermentation supernatant and intact cell suspension
ZF13、TR1-1-3、ZF6 的菌悬液对羟自由基的清除率分别为69.24%,71.81%,65.84%,清除能力相对较强且与其它菌株相比差异显著(P<0.05)。ZF22 和X31 的菌悬液对羟自由基的清除率分别为29.63%,26.98%,清除能力相对较弱。
试验结果表明,不同乳酸菌对·OH 的清除效果不同,且清除·OH 的活性主要是由胞内物质决定,胞外代谢物起协同作用。TR1-1-3 的完整细胞菌悬液对羟自由基的清除能力最强为71.81%,X31 菌株对羟自由基的清除能力最弱,上清液和菌悬液清除率分别为14.98%和26.98%
2.2 乳酸菌清除DPPH 自由基能力分析
DPPH 是一个稳定的自由基,在体外抗氧化性评价体系中被作为抗氧化成分的典型代表[3];早在1958年就被提出可作为定量测定抗氧化能力的物质,到目前为止仍被广泛运用[27]。乳酸菌发酵上清液与完整细胞菌悬液的DPPH 自由基清除率的对比结果如图2所示。
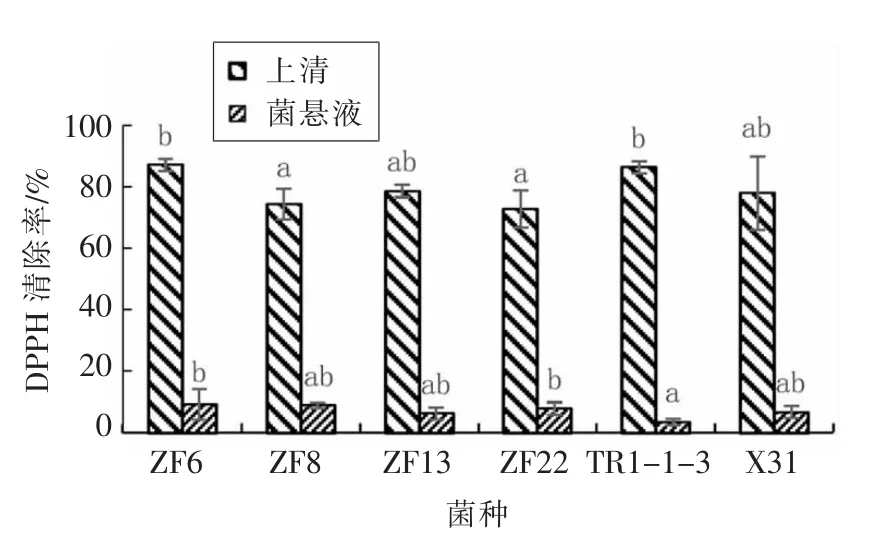
图2 发酵上清液与完整细胞菌悬液的DPPH 自由基清除率的对比图Fig.2 Comparison of DPPH free radical scavenging rate between fermentation supernatant and intact cell suspension
由图2可知,6 株试验菌株上清液和菌悬液对DPPH 自由基都有一定的清除能力,ZF6、TR1-1-3、ZF13、X31、ZF8、ZF22 上 清 液 对DPPH 自 由基的清除率分别为87.37%,86.46%,78.78%,78.06%,74.54%,73.05%,菌株ZF6 和菌株TR1-1-3 上清液对DPPH 自由基的清除能力相对较强,试验菌株上清液和菌悬液对DPPH 自由基的清除率的均值分别为79.71%和7.21%,上清液对DPPH 自由基清除能力约是菌悬液清除能力的11.06 倍。
试验结果表明,不同乳酸菌对DPPH 自由基的清除效果不同,清除DPPH 自由基的活性物质主要存在于发酵上清液中,胞内物质起辅助协同作用。上清液对DPPH 自由基的清除能力相对较强的菌株是ZF6 和TR1-1-3,其清除率分别达到了87.37%和86.46%。
2.3 乳酸菌清除超氧阴离子(O2-·)自由基能力分析
在人体内存在一定数量的超氧阴离子(O2-·)时,若不发生化学反应一般不会对人体造成伤害,然而如果与羟基(·OH)结合,其产物会导致细胞DNA 遭到损坏,可能会引起体内的脂质过氧化,加快机体衰老的过程,并诱发心脑血管疾病,严重时还会破坏人类机体功能。乳酸菌发酵上清液与菌体悬浮液清除超氧阴离子自由基结果如图3所示。
由图3可知,6 株试验菌株上清液和菌悬液对超氧阴离子自由基都有一定的清除能力,TR1-1-3、ZF8、ZF22、ZF6、X31、ZF13 的上清液对超氧阴离子自由基的清除率分别为99.18%,94.94%,93.77%,92.40%,88.15%,87.15%,菌株TR1-1-3和ZF8 的上清液对超氧阴离子自由基的清除能力相对较强,试验菌株上清液和菌悬液对超氧阴离子自由基的清除率的均值分别为92.60%%和22.53%,上清液对超氧阴离子自由基平均清除率约是菌悬液清除率的4.11 倍。
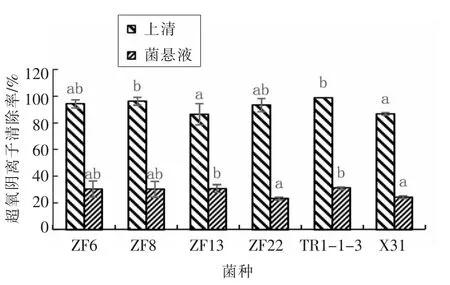
图3 发酵上清液与完整细胞菌悬液对超氧阴离子自由基清除率对比图Fig.3 Comparison of superoxide free radical scavenging rate between fermentation supernatant and intact cell suspension
试验结果表明,不同乳酸菌对超氧阴离子自由基的清除效果不同,清除超氧阴离子自由基的活性物质主要存在于发酵上清液中,胞内物质起辅助协同作用。上清液对超氧阴离子自由基的清除能力相对较强的菌株是TR1-1-3 和ZF8,其清除率分别达到了99.18%和94.94%,相对较强的菌株是X31 和ZF13,其清除率分别达到了88.15%和87.15%
2.4 乳酸菌对H2O2 的耐受能力分析
H2O2是一种强氧化剂,一定含量的H2O2会对人体造成不同程度的伤害,乳酸菌对H2O2的耐受性是筛选缓解氧化应激乳酸菌的重要指标之一[28]。6 株乳酸菌对于不同浓度H2O2溶液的耐受性测试结果如表1所示。
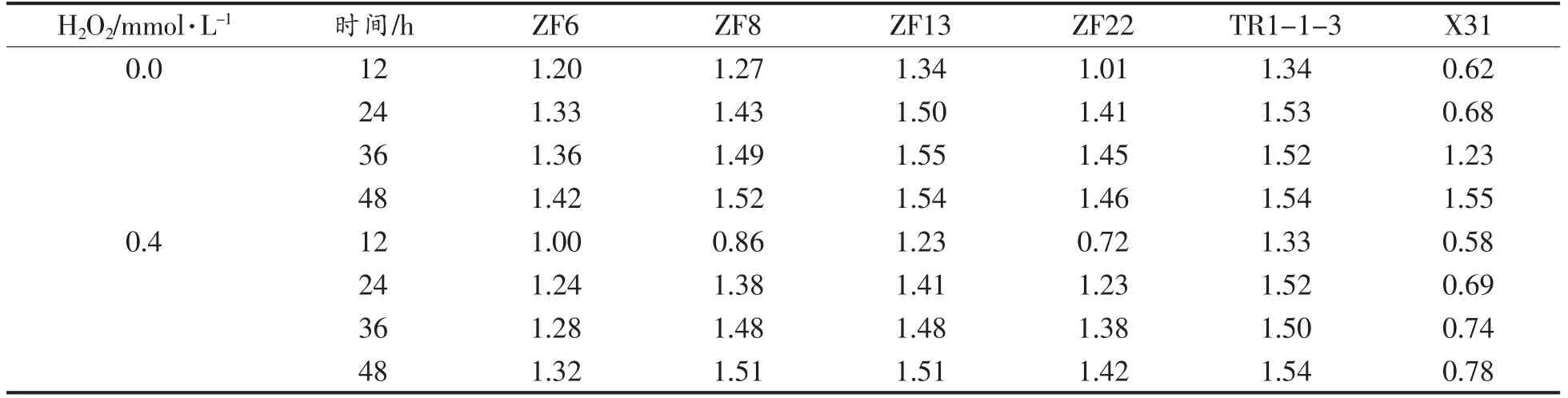
表1 乳酸菌在不同浓度H2O2 溶液中的吸光度Table 1 Absorbance of lactic acid bacteria in different concentrations of H2O2 solution
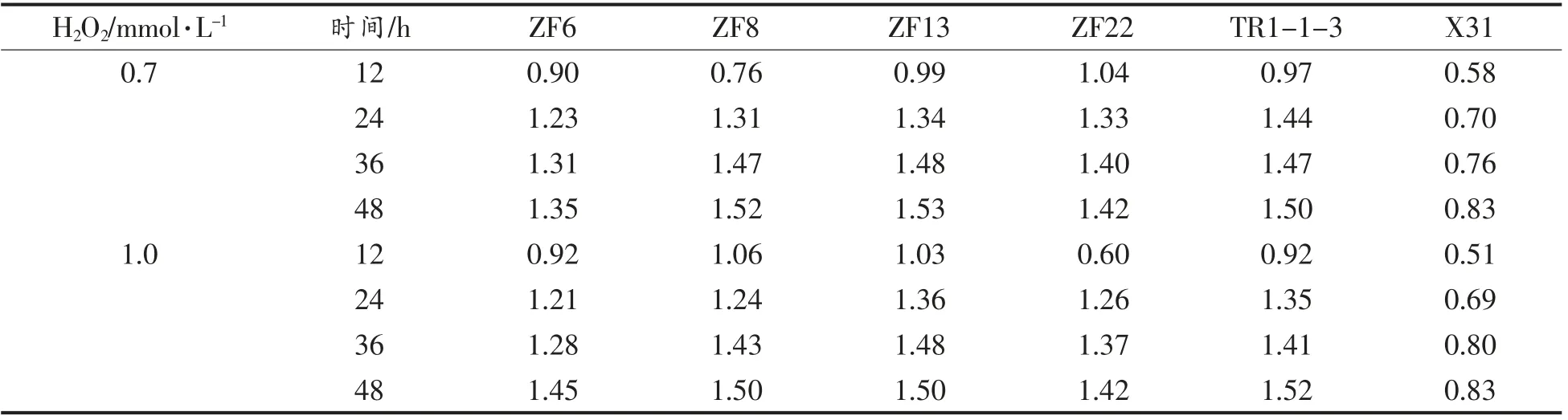
(续表1)
由表1可知,6 株乳酸菌都具有一定的H2O2耐受性,并且随着发酵时间的延长,OD 值逐渐升高,说明随着发酵时间的延长6 株乳酸菌的抗氧化性在不断增强,其中在培养12 h 后的OD 值最低,说明此时乳酸菌的抗氧化性最低,培养48 h后OD 值最高,说明此时乳酸菌的抗氧化性最高。ZF6、ZF8、ZF13、ZF22、TR1-1-3 的OD 值无论在哪个时间段都大于1,而X31 的OD 值普遍小于1,说明ZF6、ZF8、ZF13、ZF22、TR-1-3 这5 株菌对H2O2的耐受性良好,而X31 对H2O2的耐受性较弱。
加入H2O2的菌液在培养12 h 后对乳酸菌的生长具一定影响,其中,浓度为1 mmol/L 的H2O2溶液对乳酸菌的生长抑制最大,而加入H2O2的菌液在培养24,36,48 h 后,除菌株X31 外,对其它乳酸菌的生长几乎没有造成影响,说明菌株在H2O2浓度为0~1 mmol/L 范围内,对H2O2有一定的耐受能力。试验结果表明,具有潜在的抗氧化能力的乳酸菌,对H2O2具有一定的耐受能力。
2.5 抗氧化katA 基因的特异性PCR 检测结果分析
katA 基因是标记H2O2酶的基因,受氧的调控,是外源H2O2诱导的唯一的H2O2酶基因[18]。应用katA 特异性引物对6 株乳酸菌株进行PCR 扩增(702F:5'-AATTGCCTTCTTCCGTGTA,310R:5'-AGTTGCGCACAATTATTTTC),结果如图4所示。
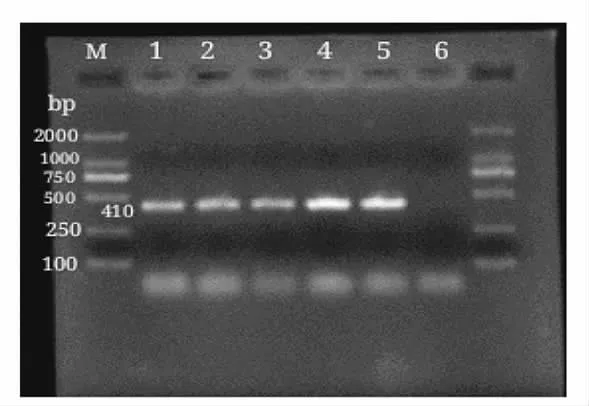
图4 乳酸菌katA 基因条带PCR 产物的琼脂糖凝胶电泳图Fig.4 Agarose gel electrophoresis of PCR amplification products of katA gene from 6 lactic acid bacterial strains
ZF6、ZF8、ZF13、ZF22、TR1-1-3 共5 株乳酸菌都能扩增出长度为410 bp(1 bp=1 碱基对)的明亮的电泳条带,表明这5 株乳酸菌含有抗氧化基因katA 的序列。X31 检测结果为阴性,表明在X31 中不存在标记H2O2酶的抗氧化基因katA,与前面乳酸菌对自由基及其H2O2的耐受性试验结果一致,均表明X31 的抗氧化能力较弱。
试验结果表明,通过表观数据乳酸菌对超氧阴离子(O2-·)、羟自由基(·OH)、DPPH 自由基的清除率以及对过氧化氢(H2O2)的耐受性,结合katA 基因特异性PCR 反应可以作为抗氧化乳酸菌判定的检测方法。
3 结论
试验结果表明,不同乳酸菌对羟(·OH)、DPPH 和超氧阴离子(O2-·)自由基的清除效果不同,试验菌株清除·OH 自由基的活性主要是由胞内物质决定的,而清除DPPH 和超氧阴离子(O2-)主要是由乳酸菌上清液中的代谢产物决定。菌株TR1-1-3 对3 种自由基的清除能力都比较强,清除率分别为71.81%,86.46%,99.18%,而菌株X31对羟自由基(·OH)和超氧阴离子(O2-)的清除率最低且与菌株TR1-1-3 差异显著(P<0.05)。除了菌株X31 外,其它试验菌株在H2O2浓度为0~1 mmol/L 范围内,对H2O2有一定的耐受能力,且在12~48 h 培养时间内,随着培养时间的延长,耐受性逐渐增强。抗氧化katA 基因的特异性PCR 检测结果仅X31 为阴性,其它菌株均为阳性。
综上所述,通过表观数据乳酸菌对超氧阴离子(O2-)、羟自由基(·OH)、DPPH 自由基的清除率以及对过氧化氢(H2O2)的耐受性,结合katA 基因特异性PCR 反应可以作为抗氧化乳酸菌判定的检测方法。
