不同分子质量ε-聚-L-赖氨酸对金黄色葡萄球菌的抑菌机制
2021-08-11廖钰婷王贺莉董天宇唐昆鹏谭之磊贾士儒
廖钰婷,王贺莉,董天宇,杨 萍,唐昆鹏,谭之磊,贾士儒
(天津科技大学生物工程学院 省部共建食品营养与安全国家重点实验室 天津 300457)
ε-聚赖氨酸(ε-Poly-lysine,简称ε-PL)来源于白色链霉菌(Streptomyces albus)发酵产生的代谢产物,是一种高安全性的天然食品保鲜防腐剂[1]。ε-PL 是一种乳白色粉末,有很强的吸湿性,略有苦味。ε-PL 在处理G+、G-、霉菌时均有一定的抑菌效果,且对耐热性芽孢杆菌有一定的抑制作用[2]。此外,ε-PL 还具有抗噬菌体、内毒素选择性移除、抑制胰脂肪酶和抗肿瘤活性等多种功能[3-6]。ε-PL的抑菌机制已有较多报道,如薄涛等[7]研究了ε-PL 对酿酒酵母的抑菌机制,结果表明ε-PL 对酿酒酵母的抑菌活性依赖于其作用浓度的高、低,并且其抑菌活性受二价阳离子的影响。谭之磊等[8]通过研究ε-PL 与卵白蛋白的相互作用,得到ε-PL可与卵白蛋白形成带不同电荷的复合物,导致ε-PL 对大肠杆菌的抑菌效果下降。侯颖等[9]研究了不同致死浓度ε-PL 与抗氧化剂N-乙酰半胱氨酸共同作用对酿酒酵母活性的影响,得出ε-PL 能够诱发ROS 上升,使细胞进入凋亡阶段,抑制细胞活性,此外,N-乙酰半胱氨酸能够降低ε-PL 的抑菌活性。ε-PL 是由不同分子质量肽链组成的混合物,不同分子质量的ε-PL 具有不同的抑菌活性。目前对不同分子质量ε-PL 抑菌活性的研究不多。苏秦之[10]发现ε-PL 抑制酵母菌活性的能力与其分子质量密切相关,相比于低分子质量(<1 ku)ε-PL,高分子质量(1~3 ku 和>3 ku)ε-PL 和ε-PL 产品使细胞膜的穿透活性增强,细胞表面粗糙,出现凹陷和微胶粒,并且高分子质量ε-PL 和ε-PL 产品对糖酵解途径和三羧酸循环有较强的抑制作用。
金黄色葡萄球菌广泛分布于环境中,极易造成食品污染,是常见的食源性致病菌,能引起严重的感染,甚至威胁人类生命,因此,抑制食品中金黄色葡萄球菌的生长繁殖对提高食品的安全性至关重要[11]。为探究不同分子质量的ε-PL 对革兰氏阳性菌的抑菌差异,本文以金黄色葡萄球菌为研究对象,使用SEM、酶标仪等技术探究不同分子质量ε-PL 对金黄色葡萄球菌抑菌活性的影响,采用基于GC-MS 的代谢组学方法研究菌株代谢途径及其代谢物,讨论ε-PL 对革兰氏阳性菌的作用模式。
1 材料与方法
1.1 材料与试剂
ε-PL 产品(纯度≥99%),浙江银象生物技术有限公司;供试菌种:金黄色葡萄球菌(Staphylococcus aureus)ACCC01331,由天津科技大学生化工程研究室提供;PUM 缓冲液;磷酸盐缓冲液【PBS 缓冲液;胞内小分子代谢物提取液:甲醇∶水=1∶1(V/V);内标溶液:1.5 g/L 氘标记丁二酸(Succinic acid,d4)】。
1.2 仪器与设备
UV-2401 紫外-可见分光光度计,日本SHIMADZU 公司;SU-1510 扫描式电子显微镜,日本Hitachi 公司;FA2004 型光电分析天平,上海精科;MULTISKAN MK3 酶标仪,美国Thermo 公司;7890A-5795C GC/MS,美国Agilent Technologies公司;核磁共振仪Inova-500MHz,美国Varian 公司。
1.3 方法
1.3.1 不同分子质量ε-PL 的制备 称取10 g ε-PL 产品溶于1 L 超纯水中,并用0.45 μm 滤膜过滤。使用SY-MU2050 切向流超滤系统(超滤膜的截留分子质量为1 ku 和3 ku) 将滤液分离为<1 ku,1~3 ku,>3 ku 的3 个组分,再将这3 个组分倒入试验用膜分离装置(截留分子质量为400~600 u)进行除盐浓缩。最后通过冷冻干燥制得不同分子质量的ε-PL,并使用核磁共振仪测定各组分的平均分子质量[10]。
1.3.2 不同分子质量ε-PL 对金黄色葡萄球菌的抑菌作用
1.3.2.1 细胞存活率的测定 取一环金黄色葡萄球菌至100 mL LB 培养基中,37 ℃、180 r/min 培养12 h 作为种子液。将种子液加入到100 mL LB培养基中,使其OD600nm=0.02,37 ℃培养至OD600nm=0.2 时,分别加入ε-PL 产品和不同分子质量的ε-PL,分别在2,4 h 取样进行平板计数,对照组不加ε-PL,3 次平行计算金黄色葡萄球菌细胞存活率,按公式(1)计算。

1.3.2.2 最小抑菌浓度(MIC)的测定 用LB 液体培养基配制ε-PL 溶液,使其终质量浓度分别为2 000,1 000,500,250,125,62.5,31.25,15.5 μg/mL。挑取一环金黄色葡萄球菌接种于100 mL LB 液体培养基中,于37 ℃下活化后划线培养;挑取单菌落使其重悬浮于LB 液体培养基中,调整菌悬液OD600nm值至0.4,在96 孔板的每个孔中分别加入100 μL 的ε-PL 溶液和等体积的菌悬液,37 ℃培养24 h 后测定OD600nm值,以确定不同分子质量ε-PL 和ε-PL 产品的最小抑菌浓度。
1.3.2.3 抑菌曲线的测定 金黄色葡萄球菌种子液同1.3.2.1 节,加入到100 mL LB 培养基中,使其OD600nm=0.02,37 ℃培养至OD600nm=0.2 时,加入ε-PL 50 mg,使ε-PL 终质量浓度为500 μg/mL,对照组不加ε-PL。继续培养10 h,每隔1 h 取样测OD600nm值,平行3 次并绘制抑菌曲线。
1.3.2.4 细胞膜完整性的测定 基于碘化丙啶(Propidium iodide,PI)的原理,参考Veerman 等[12]的方法,测定PI 荧光强度来确定不同分子质量ε-PL 对金黄色葡萄球菌细胞膜穿透活性的影响。细胞培养方法同1.3.2.2 节,处理时间为2 h 和4 h。
1.3.2.5 细胞表面疏水性的测定 采用微生物黏着碳氢化合物法(MATH)测定金黄色葡萄球菌细胞的表面疏水性[13],取100 mL 金黄色葡萄球菌种子液(同1.3.2.1 节)4 000 r/min 离心5 min 收集菌体,使用PUM 缓冲液洗涤3 次后悬浮于10 mL PUM 缓冲液中,调整菌悬液浓度至OD600nm=0.5±0.01。取3 mL 调整浓度后的菌悬液,试验组分别取3 mL 质量浓度为500,1 000,1 500 μg/mL 的ε-PL 溶液,对照组加入3 mL PUM 缓冲液。37 ℃水浴,分别在2 h 和4 h 取3 mL 菌液,加入400 μL 十六烷,混匀后静置15 min,取下层水相测定OD600nm值,计算方法见公式(2)。

1.3.2.6 细胞壁表面结构变化的测定 金黄色葡萄球菌培养方法同1.3.2.1 节,试验组加入ε-PL,对照组不加ε-PL,于2 h 后取样,4 000 r/min 离心10 min,采用PBS 缓冲液清洗细胞并收集菌体,真空冷冻干燥后压片进行傅里叶红外光谱扫描测定。
同时,要求学生能将创新性思维更好地融入设计过程中去,这对传统的程序性视觉传达设计教学方法提出了挑战,传统视觉传达设计教学方法不再适应新的教学要求。
1.3.2.7 细胞内活性氧含量的测定 收集经过2 h 和4 h 培养的空白对照组、H2O2(2.5 mmol/L)阳性对照组和经不同分子质量ε-PL 处理的细胞,用PBS 缓冲液清洗3 次并重悬浮,调整细胞浓度至OD600nm值为0.3。向上述样品中加入等体积5 μg/mL DHR123 染色,30 ℃孵育30 min 后用PBS 清洗细胞3 次并重悬浮,通过多功能微孔酶标仪测定荧光,λex=488 nm,λem=525 nm。
1.3.2.8 细胞形态观察 参考Shimada 等[14]的方法,用扫描电子显微镜(SEM)观察采用不同分子质量ε-PL 处理2 h 后的金黄色葡萄球菌细胞。
1.3.3 代谢组学分析
1.3.3.1 胞内代谢物的检测分析 参考Hanna 等[15]的方法提取金黄色葡萄球菌胞内代谢物,分别收集未经处理、ε-PL 产品处理、不同分子质量ε-PL处理以及无水乙醇(添加体积分数为10%)处理的金黄色葡萄球菌细胞。每个样品进行6 次生物学重复。在GC-MS 分析前,参考Ding 等[16]的方法对样品进行衍生化操作。
用Agilent HP-5 色谱柱(60 m×0.32 mm×0.25 μm)分离样品。将衍生样品(1 μL)注入进样口,进样口温度为280 ℃。升温程序:初始温度70 ℃保持2 min,以5 ℃/min 程序升温至290 ℃保持5 min;柱后分流比1∶10;载气为高纯氦气,恒定流量1 mL/min。电离方式为电子轰击电离EI+;离子源温度250 ℃;电子轰击能量70 eV,离子电流40 μA;扫描质量范围50~800 m/z。
1.3.3.2 定性和定量分析 定性分析:采用Mass Hunter Qualification 软件(version B06SP1)分析质谱峰;定量分析:使用SIMCA 软件进行主成分分析(PCA)和偏最小二乘分析(PLS),并用利用HCE(3.5 USA)软件进行层次聚类分析(HCA)。
2 结果与分析
2.1 不同分子质量ε-PL 的制备以及聚合度的确认
通过对分离出的3 个组分进行1H NMR 表征,得出ε-PL 链内的α-H(δ'αH)、ε-H(δ'εH)、C端的δ''αH 和N 端的δ''εH 发生了化学位移。1H NMR 的面积与质子数呈正相关,由 于δ'αH 和δ'αH(δεH 和δ'εH)的化学位移不同,从而获得不同的峰面积AαH和A'αH(AεH和A'εH)。AαH/A'αH(或AεH/A'εH) 表示内部α-H 的重复单元数,AαH/A'αH+1(或AεH/A'εH+1)可以视为平均聚合度()。因此,通过该方法可以估计不同成分的ε-PL 的数均分子质量。从表1可以看出,3 个组分ε-PL 的数均分子质量分别为1 027.44,1 967.77,2 836.39 u,样品如图1所示。

图1 不同分子质量ε-PL 样品Fig.1 ε-PL with different molecular weights
表1 不同组分ε-PL 的平均聚合度及数均分子质量以及对应盐酸盐的数均分子质量Table 1 ,n and ns of different fractions of ε-PL

表1 不同组分ε-PL 的平均聚合度及数均分子质量以及对应盐酸盐的数均分子质量Table 1 ,n and ns of different fractions of ε-PL
注:a.小于1 ku;b.1~3 ku;c.大于3 ku。
?
2.2 不同分子质量ε-PL 对金黄色葡萄球菌的抑菌作用
由图2a 可以得出,ε-PL 产品和不同分子质量ε-PL 均表现出对金黄色葡萄球菌的细胞存活率有影响,并且随着分子质量的增大,细胞存活率显著下降;图2b 为不同分子质量ε-PL(<1 ku,1~3 ku 和>3 ku) 和ε-PL 产品对金黄色葡萄球菌的最小抑菌浓度结果,<1 ku 组分质量浓度达到1 000 μg/mL 时,抑菌作用明显,1~3 ku 和>3 ku 以及ε-PL 产品质量浓度达到250 μg/mL 时,抑菌作用明显,且>3 ku 组分的抑制作用强于1~3 ku 组分和ε-PL 产品。由此表明ε-PL 的抑菌活性与分子质量密切相关,且分子质量大的组分(>3 ku)对金黄色葡萄球菌的抑菌活性高于分子质量小的组分(<1 ku,1~3 ku)以及ε-PL 产品,这与Shima 等[17]的试验结果相似。从图2c 的抑菌曲线得出不同分子质量ε-PL 和产品均对金黄色葡萄球菌有抑制作用,且抑制程度不同。<1 ku 组与对照组菌体生长情况相似,1~3 ku、>3 ku 和产品组对菌体生长抑制较为明显,其中>3 ku 组尤为明显。

图2 不同分子质量ε-PL 对金黄色葡萄球菌的抑菌作用Fig.2 Antibacterial effect of ε-PL with different molecular weights on S.aureus
2.3 不同分子质量ε-PL 对金黄色葡萄球菌细胞表面性质及次级损伤的影响差异
不同分子质量ε-PL 对金黄色葡萄球菌细胞表面疏水性的影响如图3a 所示,1~3 ku 和>3 ku ε-PL 处理组使金黄色葡萄球菌的表面疏水性明显上升,作用时间对细胞表面疏水性的影响较小。根据洪军等[18]的研究,推测由于ε-PL 带正电荷,与带负电荷的磷壁酸接触后,可能使磷壁酸结构发生变化,从而导致细胞表面疏水性上升。由图3b 可知,不同分子质量ε-PL 作用于金黄色葡萄球菌2 h 后,与空白对照组相比,经ε-PL 处理的细胞荧光强度显著增强。作用4 h 后,<1 ku 组和产品组细胞荧光强度几乎不变,1~3 ku、>3 ku 组及对照组则略有上升。因PI 染料不能进入完整的活细胞内,只能穿过破损的细胞膜进入细胞,进而与胞内的DNA 形成复合物。荧光强度增强说明金黄色葡萄球菌细胞膜破损,使得PI 进入细胞与DNA 结合。由此说明1~3 ku 和>3 ku 组对细胞膜影响最大,产品次之,<1 ku 组影响最小。图3c 中,通过DHR123 检测了金黄色葡萄球菌细胞胞内ROS 含量,发现经过不同分子质量ε-PL 作用4 h后,在高分子质量(1~3 ku 和>3 ku)以及产品ε-PL 处理组中ROS 显著积累,荧光强度值分别显著增强1.86 倍、2.75 倍和2.01 倍,低分子质量(<1 ku)处理组则增强了1.38 倍,与阳性对照组处理组结果相似(H2O2处理组增强1.34 倍)。微生物的FTIR 光谱通常分为5 个区域[19],从红外光谱图3d可以看出,对照组的光谱在1 200~900 cm-1位移处出现了细胞壁多糖的特征信号峰。与对照组相比,1~3 ku、>3 ku ε-PL 组以及ε-PL 产品组在作用2 h 后,1 200~900 cm-1位移处峰强度明显减弱,<1 ku ε-PL 组也出现了一定程度的减弱。

图3 不同分子质量ε-PL 对金黄色葡萄球菌的细胞表面性质及次级损伤的影响差异Fig.3 Effects of ε-PL on cell surface properties and secondary damage of S.aureus with different molecular weights
2.4 不同分子质量ε-PL 对金黄色葡萄球菌细胞表面形态的影响
使用SEM 观察不同分子质量ε-PL 和ε-PL产品对金黄色葡萄球菌细胞形态的影响。如图4所示,经ε-PL 处理过的和未经ε-PL 处理过的金黄色葡萄球菌在细胞大小上没有明显变化。经<1 ku ε-PL 处理后,细胞形态没有发生明显变化,某些细胞的细胞膜表面有轻微的凹陷(图4c)。经1~3 ku、>3 ku ε-PL 和ε-PL 产品处理后与对照组相比,细胞形态皱缩且表面变得粗糙,出现明显的凹陷和微小孔洞(图4b,4d,4e)。由此可以得出高分子质量(1~3 ku,>3 ku)ε-PL 的抑菌作用机制与膜损伤机制相似,在Shima 等[17]和Hyldgaard 等[20]对ε-PL 作用机制的报道中也有类似结果。因此,可以推测出高分子质量(1~3 ku,>3 ku)ε-PL 的作用机制是通过与磷壁酸的静电作用吸附到细胞表面与细胞壁接触,破坏肽聚糖层结构,再穿过肽聚糖层与细胞膜接触后,破坏细胞膜的完整性。

图4 扫描电镜观察不同分子质量ε-PL 对金黄色葡萄球菌表面形态的影响(处理时间2 h)Fig.4 Scanning electron microscope to observe the effect of different molecular weight ε-PL on surface morphology of S.aureus(treat for 2 hours)
2.5 胞内代谢
采用GC-MS 对不同分子质量ε-PL 作用后金黄色葡萄球菌细胞的代谢进行测定,对质谱图分析得到共59 种代谢产物,通过非监督模式识别方法-PCA 分析法对多元数据进行分析。PCA 分析法是采用线性投影将原来的多个变量空间转换成一组新正交变量的统计分析方法,其主要应用于高维数据空间降维,从而降低问题的复杂性[21]。从图5可看出,处理时间为2 h 时,1~3 ku 和>3 ku ε-PL 以及无水乙醇处理组不好区分,与其它3 组有明显不同的聚类效果;处理时间为4 h 时,>3 ku ε-PL 和乙醇处理组聚为一类,1~3 ku ε-PL 和产品处理组聚为一类,<1 ku ε-PL 和空白对照组各为一类。

图5 对照组与不同分子质量ε-PL 处理组主成分分析得分图Fig.5 PCA scores plot for control group and ε-PL treated groups
为了进一步验证不同分子质量ε-PL 对金黄色葡萄球菌胞内代谢的影响,在PCA 分析的基础上,采用PLS 分析代谢物含量数据。图6a、6c 分别为偏最小二乘分析第一主成分和第二主成分得分图,显示了处理组样本与空白对照组的聚类结果,与PCA 分析结果相一致,表明不同分子质量ε-PL 处理可能引起金黄色葡萄球菌胞内代谢的系统性改变。
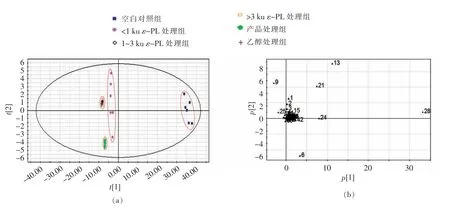
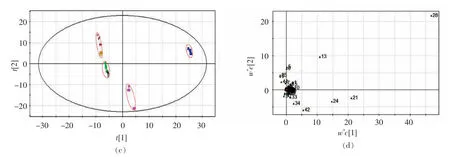
图6 偏最小二乘分析得分图与载荷图Fig.6 Score plot and loading plot generated by PLS
如图7所示,将检测到的代谢物变化映射在金黄色葡萄球菌代谢途径网络中。结果显示,ε-PL和乙醇能促使胞内葡萄糖积累,<1 ku ε-PL 组中金黄色葡萄球菌胞内葡萄糖积累量远小于其它组,>3 ku ε-PL 组和乙醇组葡萄糖积累量最高,1~3 ku ε-PL 和ε-PL 产品组次之。表明糖酵解途径受到不同程度抑制,细胞利用碳源能力下降,从而表现出经不同分子质量ε-PL 处理后生长状况被不同程度抑制。

图7 不同分子质量ε-PL 下金黄色葡萄球菌的中心碳代谢变化情况Fig.7 A model of the central carbon metabolic variations under different molecular weights of ε-PL
在TCA 循环中,高分子质量(1~3 ku,>3 ku)ε-PL、ε-PL 产品和乙醇使柠檬酸的含量分别在2 h 和4 h 时显著积累,<1 ku ε-PL 组没有显著累积;TCA 的中间代谢物琥珀酸和延胡索酸的含量在<1 ku ε-PL 组中,均呈现上升趋势;而高分子质量(1~3 ku,>3 ku)ε-PL、ε-PL 产品和乙醇组中没有此现象。表明细胞内TCA 循环受到影响,且不同分子质量ε-PL 对TCA 循环的影响不同。
糖酵解途径和TCA 循环是微生物获得能量的主要途径,这2 个途径受到抑制会降低胞内ATP 的含量,同时,TCA 循环中的许多中间代谢物是合成其它代谢物的原料。TCA 循环中的柠檬酸可以转化为α-酮戊二酸,α-酮戊二酸继续参与TCA 循环,也可用于合成谷氨酸;而谷氨酸和天冬酰胺是微生物中维持碳氮平衡的2 个重要代谢物,可为细胞内含氮化合物的合成提供氮源[21]。不同处理组中的谷氨酸含量变化有明显差异,<1 ku ε-PL 组中谷氨酸含量与空白组变化趋势相同,1~3 ku、>3 ku ε-PL、ε-PL 产品和乙醇组中谷氨酸含量均下降。表明不同分子质量ε-PL 对TCA 循环具有不同的作用。
2.6 不同分子质量ε-PL 对金黄色葡萄球菌可能的作用模式
通过以上不同分子质量ε-PL 对金黄色葡萄球菌的抑制作用以及代谢分析,由此得出其对金黄色葡萄球菌细胞可能的作用模式:不同分子质量的ε-PL 首先通过静电引力与金黄色葡萄球菌细胞膜表面带阴离子的物质磷壁酸结合;带有较少量正电荷、分子质量<1 ku 的ε-PL 使细胞壁肽聚糖层发生微弱变化,细胞膜磷脂双分子层轻微弯曲,细胞膜结构变得疏松,通透性改变,从而使<1 ku ε-PL 进入金黄色葡萄球菌细胞内部,对糖酵解途径产生轻微抑制作用,金黄色葡萄球菌细胞启动自我保护机制,一些保护性代谢物含量上升,减弱伤害,并启动自我修复机制,维持细胞的机械强度和渗透压平衡,使金黄色葡萄球菌细胞生长受到轻微抑制;而高分子质量(1~3 ku,>3 ku)的ε-PL 作用则在肽聚糖层上形成微小孔洞,借此穿过肽聚糖层与细胞膜接触,磷脂双分子层弯曲,对细胞膜功能产生不同程度的破坏,细胞膜的损伤能够诱导其它次级损伤,干扰胞内的初级代谢途径,最终导致细胞死亡。
3 结论
本试验中采用不同分子质量的ε-PL 作用于金黄色葡萄球菌,结果表明不同分子质量的ε-PL在不同浓度下对金黄色葡萄球菌的抑菌作用有明显区别,分子质量<1 ku 的ε-PL 质量浓度达到1 000 μg/mL 时抑菌作用明显,1~3 ku 和>3 ku 以及ε-PL 产品质量浓度达到250 μg/mL 时,抑菌作用明显。根据抗菌肽抑菌机制,推测较高分子质量(1~3 ku,>3 ku)的ε-PL 是通过与磷壁酸的静电作用,吸附到细胞表面,进而与细胞壁接触,破坏肽聚糖层结构,穿过肽聚糖层与细胞膜接触后,破坏细胞膜的完整性。同时通过代谢组学分析得到,不同分子质量ε-PL 对金黄色葡萄球菌细胞中的糖酵解途径、TCA 循环的影响不同,细胞中的保护性代谢物含量不同,一些保护性氨基酸的含量在<1 ku ε-PL 组中有所积累,然而在高分子质量(1~3 ku,>3 ku)ε-PL 和ε-PL 产品组中均下降,可能由于高分子质量的ε-PL 和ε-PL 产品改变了细胞膜通透性,造成细胞内外渗透压失衡,从而使得自我保护机制失效。
