苯并芘诱导Balb/c小鼠的生理损伤和肠道菌群失调
2021-08-11于雷雷张凌宇翟齐啸田丰伟
于雷雷,张凌宇,张 灏,翟齐啸,田丰伟,陈 卫
(江南大学食品学院 江苏无锡 214122)
食品在熏制和烘烤过程中,会产生大量的多环芳烃(Polycyclic aromatic hydrocarbons,PAHs),危害人体健康[1-2]。其中,苯并芘是多环芳烃中最具特征和毒性的成员[3],在水、大气和土壤[3-5]中广泛存在。据Phillips[6]报道苯并芘的摄入主要来自食品,尤其是加工不当的木炭烧烤食品。国际癌症研究机构(International agency for research on cancer,IARC)已将苯并芘归为人类Ⅰ类致癌物,其主要损伤机制是通过产生活性氧(Reactive oxygen species,ROS)诱导氧化应激和DNA 损伤。苯并芘本身毒性不大,然而,当其被细胞酶系P450 代谢时,可转化为具有高度致癌性的物质7,8-二羟-9,10-环氧苯并芘(7,8-dihydroxybenzopyrene-9,10-oxide,BPDE),其与DNA 结合会对人体造成严重损害。
暴露不同剂量的外源化合物对机体的损害程度也不同。苯并芘是一种在体内反应较为复杂的化合物,关于苯并芘单一剂量对生物体损害的研究很多,并在动物模型中证实其可诱发肺癌和结肠癌[7-10],对人类造成遗传毒性。苯并芘对脑、肺和结肠的氧化应激也有报道[11-12]。通过饮食暴露苯并芘必定会对肠道菌群产生不利影响。肠道菌群在调节宿主健康中起着重要作用[13],其产生的丙酸和丁酸可以很好地抑制炎症[14-16]。然而,关于苯并芘对肠道菌群的影响鲜有研究报道。此外,苯并芘对生物体损害的剂量效应研究较少,因此研究二者的关系具有重要意义。
本研究选择不同苯并芘暴露剂量,研究其对Balb/c 小鼠造成生理损伤剂量效应关系,并探究其损伤机制是否导致肠道菌群失调。
1 材料与方法
1.1 材料与试剂
总超氧化物歧化酶(SOD) 试剂盒、丙二醛(MDA)试剂盒、总胆固醇(TC)试剂盒、总蛋白含量(TP)试剂盒、甘油三酸酯(TG)试剂盒、高密度脂蛋白(HDL)试剂盒、低密度脂蛋白(LDL)试剂盒、碱性磷酸酶(ALP)试剂盒、天冬氨酸转氨酶(AST)试剂盒、丙氨酸转氨酶(ALT)试剂盒,南京建成生物研究所;苯并芘,美国Sigma 公司;FastDNA Spin Kit for Feces 细菌基因组提取试剂盒,美国MPbio 公司;TIANgel Mini Purification Kit 试剂盒,天根生化科技有限公司;Qubit dsDNA HS Assay Kit 试剂盒,美国Thermo 公司;TruSeq DNA LT Sample Preparation Kit、Miseq Reagent Kit,美国Illumina 公司。
1.2 仪器与设备
高速冷冻离心机,德国Eppendorf 公司;MLS-3750 型高温高压灭菌锅,日本SANYO 公司;SWCJ-1CV 型微生物操作超净工作台,苏州安泰空气技术有限公司;多功能酶标仪,美国Thermo 公司;BC-5000 Vet 型全自动生化分析仪,深圳迈瑞医疗有限公司;MiSeq 第二代高通量测序仪,美国Illumina 公司。
1.3 动物实验设计
雄性成年Balb/c 小鼠(8 周),上海斯莱克公司。在12 h/12 h 的明暗循环中,将小鼠饲养在温度(22±1)℃、湿度55%±10%可控的笼中,可以自由获取食物和水。根据体重将小鼠随机分为5 组,每组8 只小鼠,并在实验开始前使其适应环境1周。实验程序如下:第1 组(对照组)给予脱脂乳和玉米油;第2~5 组(干预组)分别给予以12.5,62.5,125,250 mg/kg 体重溶解于玉米油中的苯并芘。连续灌胃7 d,每天1 次。处死前禁食12 h,通过注射戊巴比妥钠进行麻醉后处死,采集的血液在3 000×g 下离心15 min,吸出上清液并保存在-80 ℃进行血清生化分析。解剖后立即用0.9%生理盐水清洗肝、肺和结肠组织,均质并贮存在-80 ℃,用于随后的指标检测。
1.4 血液生化指标测定
小鼠血清中的生化参数,包括总胆固醇(TC)、总蛋白含量(TP)、甘油三酸酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、碱性磷酸酶(ALP)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT),使用自动生化分析仪进行测定。
1.5 氧化还原指标测定
肝脏、肺和结肠中丙二醛(MDA)的水平和超氧化物歧化酶(SOD)的活性氧化应激水平使用南京建成生物研究所的ELISA 试剂盒并根据其说明书进行测定。
1.6 小鼠粪便微生物总DNA 的提取和肠道菌群高通量测序
参照Wang 等[17]的方法使用Fast DNA Spin Kit for Feces 试剂盒从粪便中提取总DNA,并使用通用引物(341F 和806R)对16S rRNA 基因的V3-V4 区进行扩增。之后从2.0%琼脂糖凝胶上切下PCR 产物,按照TIANgel Mini Purification Kit试剂盒说明进行纯化,并通过Qubit dsDNA HS Assay Kit 试剂盒进行定量。使用TruSeq DNA LT Sample Preparation Kit 试剂盒制备文库,并使用MiSeq Reagent Kit 试剂盒在Illumina MiSeq PE300 平台上进行测序。
1.7 统计与分析
实验数据使用SPSS 20.0 和Graphpad 7 进行统计分析。线性判别分析效应大小(LEfSe)使用在线网站(http://huttenhower.sph.harvard.edu/galaxy/)进行分析。微生物群相关分析通过QIIME 和R(版本3.5.0)软件进行。使用单因素方差分析(ANOVA)和Duncan 检验评估差异的显著性。
2 结果与分析
2.1 苯并芘暴露对小鼠体重的影响
暴露于不同苯并芘剂量组(12.5,62.5,125,250 mg/kg 体重)的小鼠体重在第7 天的变化量如图1所示。与对照组相比,62.5 mg/kg 组的小鼠总体重显著增加(P<0.001),250 mg/kg 组显著下降(P<0.001)。
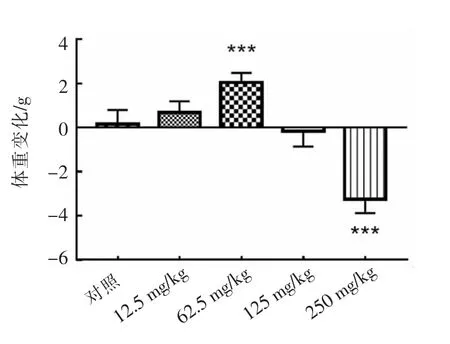
图1 小鼠在不同剂量苯并芘暴露下的体重变化Fig.1 The alteration of body weight in mice exposed to different doses of benzopyrene
2.2 苯并芘暴露对小鼠血液生化指标的影响
如图2所示,苯并芘暴露组与对照组相比,AST 和ALT 水平随苯并芘浓度增加而增加,呈剂量依赖效应,然而变化不显著,仅在250 mg/kg 剂量组显著增加(P<0.05,P<0.001)。如表1所示,HDL-C、LDL-C、TC、TG、ALP 和TP 水平在250 mg/kg 剂量下显著降低(P < 0.05)。而在12.5,62.5,125 mg/kg 组则无显著变化。

图2 小鼠血液中的AST 和ALT 活性Fig.2 The activities of AST and ALT in the blood of the mice

表1 急性苯并芘暴露对小鼠的血液生化指标的影响Table 1 Blood biochemical indexes of the mice fed by benzopyrene
2.3 苯并芘暴露对器官和组织中SOD 活性和MDA 水平的影响
如表2所示,苯并芘暴露对小鼠结肠的氧化还原状态和炎症生物标志物的均无显著性影响。苯并芘暴露组与对照组相比,仅在肝脏中250 mg/kg 剂量组的SOD 活性显著增加(P < 0.05),而在肺中SOD 活性没有显著变化。且所有剂量组对肝脏和肺中的MDA 水平均无显著影响。

表2 小鼠肝、肺和结肠中的SOD 和MDA 活性Table 2 SOD and MDA activities in the liver,lung and colon of the mice
2.4 苯并芘暴露对肠道菌群的影响
2.4.1 高剂量苯并芘对小鼠肠道菌群门水平相对丰度的影响 如图3所示,在门水平,对照组小鼠的肠道菌群组成主要为疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。而250 mg/kg的苯并芘暴露剂量组,变形菌门和厚壁菌门的丰度显著增加,拟杆菌门的丰度显著降低。

图3 不同组别小鼠肠道菌群的门水平丰度Fig.3 The composition of gut microbiota in different groups of mice at phylum level
2.4.2 高剂量苯并芘对小鼠肠道菌群科属水平相对丰度的影响 实验进一步分析了250 mg/kg 的苯并芘暴露剂量组的属水平(图4)小鼠肠道菌群的结构,对照组小鼠肠道菌群主要由阿克曼菌(Akkermansia)、S24-7、梭菌目(Clostridiales)、毛螺菌科(Lachnospiraceae)、瘤胃球菌属(Ruminococcus)和理研菌科(Rikenellaceae)构成,分别占比20.99%,35.86%,13.21%,1.78%和3.30%。250 mg/kg 苯并芘剂量暴露组除了阿克曼菌仍为主要的优势属外,S24-7、梭菌目、毛螺菌科、瘤胃球菌属和理研菌科的丰度显著下降,结合LEfSe 和LDA分析(图5)显示肠杆菌科(Enterobacteriaceae)、乳杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)和Allobaculum 的丰度显著增加,分别占3.93%,9.59%,6.03%,10.50%。
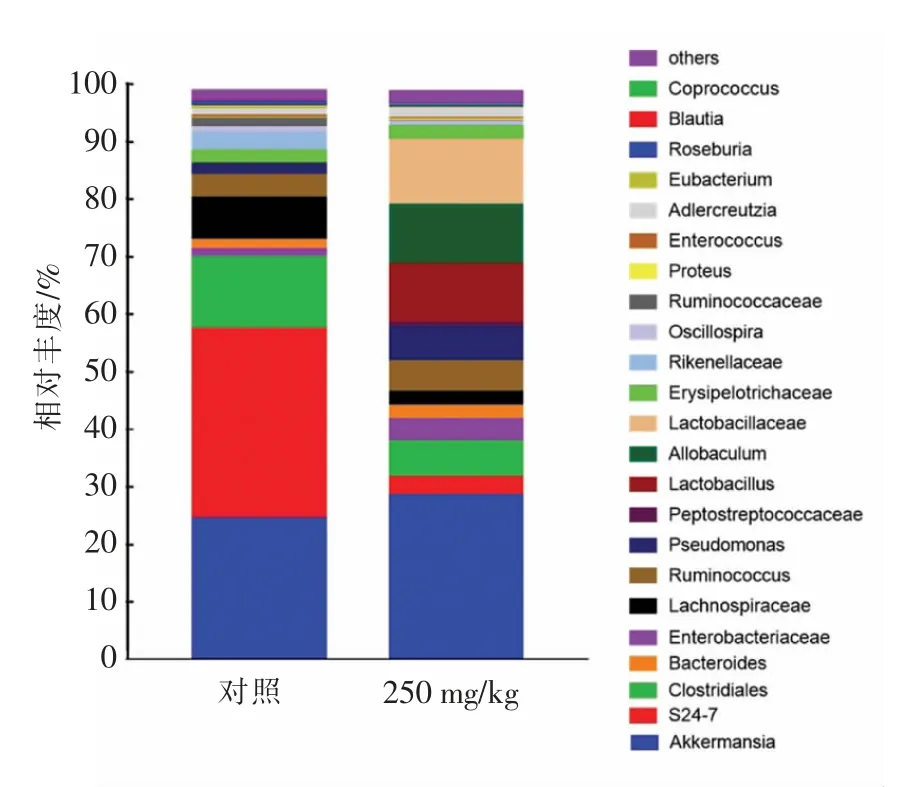
图4 不同组别小鼠肠道菌群的属水平丰度Fig.4 The composition genus level of gut microbiota in different groups of mice at genus level
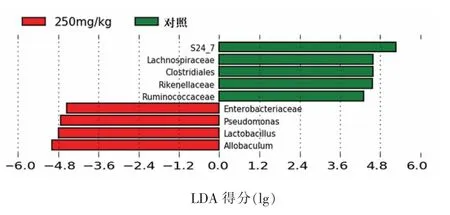
图5 LEfSe 分析对照组和250 mg/kg 剂量组肠道菌群的组成Fig.5 LEfSe-based comparison of gut microbiota composition between control and 250 mg/kg dose groups


图6 250 mg/kg 剂量组丰度显著变化的菌Fig.6 The significant changes of species in 250 mg/kg group
3 讨论
苯并芘是一种对生物体危害极大的环境致癌物,研究结果表明,高剂量的苯并芘(250 mg/kg)导致Balb/c 小鼠第7 天的总体重显著降低,与Ajayi等[18]研究的250 mg/kg 苯并芘暴露剂量下体重变化的结果相一致。此外,在62.5 mg/kg 剂量下小鼠体重显著增加,这可能是由于毒物兴奋效应导致[19]。毒物兴奋效应是生物体的一种适应性反应,即化学污染物在高剂量时对生物体表现为有害影响,而在低剂量时却表现为刺激机体积极应激反应。
在动物模型的肝脏损伤研究中,AST 和ALT通常被作为考察脊椎动物肝脏功能的标志性指标[20-22],本研究在最高剂量(250 mg/kg)下,AST 和ALT 水平显著增加,在12.5,62.5,125 mg/kg 剂量下变化不显著,随苯并芘剂量增加呈增加趋势。Vasanth 等[23]在给鲮鱼摄入质量浓度5.0~25.0 mg/L 蒽的研究中,同样发现AST 和ALT 的浓度随着蒽剂量的增加而增加,这与本课题组的研究结论一致。在250 mg/kg 剂量下,HDL 含量显著下降,表明肝脏处于损伤状态,LDL 含量也显著下降,然而其值均在正常范围内,TC 总胆固醇和TG 甘油三酸酯含量显著降低,表明苯并芘对肝脏造成损害并影响总胆固醇和甘油三酸酯的合成。总血清碱性磷酸酶(ALP)是一种衍生自各种组织的同功酶,在本研究中ALP 的浓度随着苯并芘剂量的增加而降低,并在250 mg/kg 剂量下显著降低。这与Vasanth 等[23]的研究结果相反,结合第7 天体重严重下降,判断小鼠可能发生了营养不良,而营养不良往往导致ALP 含量降低[24-25]。在250 mg/kg 剂量下总蛋白TP 显著下降,表明可能已经发生肝功能损害。因此,高剂量的苯并芘暴露会对小鼠肝功能造成严重损害。
本研究分析了肝脏、肺和结肠内SOD 与MDA的变化情况。与对照组相比,在250 mg/kg 最高剂量下肝脏SOD 活性显著增加,而肺和结肠SOD 活性没有显著变化。据报道,在20 μg/L 的苯并芘剂量下暴露6,12,18 d 后鲤鱼肝脏中的SOD 活性显著增加[26]。同样也有研究报道,给热带鱼腹腔注射1 000 μmol/kg 剂量的苯并芘4 d 后,组织SOD 活性显着增加[27]。给舞毒蛾从第1 龄到第5 龄喂食含有2,20,100,2 000 ng/g 苯并芘的食物后发现组织SOD 活性显著增加[28]。这些结果表明苯并芘代谢产生大量的超氧阴离子自由基,导致高水平的ROS,然后诱导SOD 的活性增加,最终随着ROS水平的增加,SOD 活性也随之增加,需要反应的超氧自由基越多,表明小鼠在最高剂量下处于较高的氧化应激状态。
在不同剂量苯并芘暴露下的生化指标与氧化还原指标测定结果显示,在最高暴露剂量组250 mg/kg 下,所有指标都发生了显著变化。因此,随后研究了对照组与250 mg/kg 暴露剂量组的小鼠肠道菌群的差异。结果显示,在250 mg/kg 剂量组下,肠道菌群结构发生了显著变化,在门水平下,250 mg/kg 的苯并芘暴露剂量组显示,变形菌门和厚壁菌门丰度显著增加,拟杆菌门丰度显著降低。事实上,变形菌门的增加和拟杆菌门的减少通常与多环芳烃有关[29-31]。在属水平,S24-7、梭菌目、毛螺菌科、瘤胃球菌属、理研菌科的丰度显著下降,拟杆菌门S24-7 菌科在肠道菌群中广泛存在,小鼠是最常见的宿主,其平均相对丰度为20%[32],是健康小鼠体内较为主要的菌群,然而高剂量苯并芘的暴露导致S24-7 显著降低,表明苯并芘暴露对小鼠肠道稳定造成了破坏,在给小鼠服用泻药聚乙二醇(PEG)后的报道也显示在引发轻度渗透性腹泻的同时,也伴随着S24-7 这种高丰度菌株的消失,并被拟杆菌科取代[33]。在疾病状态下,梭菌目的丰度往往会减少[34],其丰度的减少标志着小鼠健康状态受损。毛螺菌科是肠道中最重要的正丁酸生产微生物,具有调节宿主能量和黏膜完整性的功能,瘤胃球菌属具有调节结肠黏膜中黏蛋白表达和黏液糖基化的能力[35],这2 种菌株的丰度显著下降,可能说明了高剂量苯并芘暴露对小鼠肠道屏障产生了有害影响。理研菌科能够分解碳水化合物和蛋白质[36],也是正常小鼠中重要的菌群,其丰度的下降可能会导致小鼠摄食减少,与其体重显著降低可能存在一定的关联。250 mg/kg 暴露剂量组下,肠杆菌科、乳杆菌属、假单胞菌属和Allobaculum 的丰度显著增加。肠杆菌科通常是肠道致病菌,其丰度的增加表明此时小鼠健康状态已遭受严重威胁。假单胞菌属是引起急性和慢性感染的主要病原体[37],尤其是在免疫功能低下的人群中较为常见,假单胞菌属的显著增加暗示了小鼠在高剂量苯并芘暴露下免疫力下降的结果。Hayashi 等[38]研究发现,对小鼠进行万古霉素干预后,小鼠肠道稳态失调,造成鼠李糖乳杆菌的丰度显著增加,导致生物素急剧消耗,最终导致小鼠脱发。本研究中乳杆菌属丰度的显著增加可能暗示了小鼠体内相关生物素的消耗,并最终对机体造成损害。在Lai 等[39]的研究中发现,在低剂量全氟辛烷磺酸暴露后,Allobaculum 丰度大大增加,这是一种特定的短链脂肪酸产生细菌,其有助于胰岛素抵抗和肥胖。本研究中Allobaculum 丰度的增加可能是小鼠机体在受到损伤时的一种应激行为。
4 结论
在不同浓度苯并芘剂量暴露下,小鼠体重、血清生化指标和肝脏SOD 活性仅在250 mg/kg 暴露剂量下发生显著变化。AST、ALT 水平随苯并芘浓度增加而增加,呈现苯并芘的浓度依赖效应,然而仅在250 mg/kg 暴露剂量下具有显著性。250 mg/kg 暴露剂量下与对照组相比肠道菌群发生了显著变化,S24-7、梭菌目、毛螺菌科、瘤胃球菌属和理研菌科丰度显著下降,肠杆菌科、乳杆菌属、假单胞菌属和Allobaculum 的丰度显著增加。结果证明肠道菌群失调是苯并芘暴露造成Balb/c 小鼠模型损害的途径之一,然而苯并芘的损伤机制是否涉及肠道屏障功能破坏,机体和菌群代谢紊乱,机体免疫失调等,仍有待深入研究。
