发芽糙米糖蛋白结构表征及抗氧化性能分析
2021-08-11刘晓飞马京求程传兴卢淑雯
刘晓飞,侯 艳,马京求,程传兴,张 娜,卢淑雯
(1黑龙江省农业科学院博士后科研工作站 哈尔滨 150086 2哈尔滨商业大学食品工程学院 哈尔滨 150028)
糖蛋白是由低聚糖链和蛋白质组成的复合蛋白,低聚糖链通常通过糖基化作用与蛋白质连接[1]。糖蛋白的主要生物学功能是细胞或分子的识别作用,参与生物体中各种生物学反应,糖蛋白在生物体中普遍存在,具有多种生物学功能,如抗氧化,抗肿瘤[2],降胆固醇[3]等。目前在临床上使用的重组蛋白药物大多是糖蛋白。随着糖蛋白生物学研究的不断深入,糖蛋白的潜在功能逐渐被发现,从蛋白质折叠、细胞信号、受体结合、免疫识别到调节生物半衰期,都可以追踪到糖蛋白[4]。
发芽糙米是将糙米置于合适的温度、湿度下萌发,直至具有一定的萌发长度,含有芽和胚乳。糙米的发芽过程实际上是提高其营养价值的过程[5]。糙米在萌发过程中,不仅现有的营养物质含量有所增加[6],而且萌发引起的内部化学变化也产生了新的营养物质,如γ-氨基丁酸等[7]。研究表明,糙米中糖蛋白含量在一定程度上会随着萌发时间的延长而增加,且抗氧化性也与萌发时间呈正相关[8]。目前,关于发芽糙米糖蛋白(Germinated brown rice glycoprotein,GBRG)的研究较少,人们对其物理、化学性质及其潜在的结构和生物功能知之甚少,GBRG 尚未得到充分利用。
本试验中采取超声辅助提取GBRG,用DEAE-Cellulose 52 阴离子柱交换层析法和Sephadex G-200 凝胶层析法进行分离纯化。采用高效液相色谱、红外光谱、圆二色性、1H-NMR 谱等方法进行结构分析,评估GBRG 中主要成分的抗氧化作用。本研究旨在拓宽天然糖蛋白来源,为水稻增产和产业链延伸做一些研究和探索。
1 材料与方法
1.1 材料与试剂
1.1.1 发芽糙米粗糖蛋白样品制备 供试粳稻为“龙粳”,用龚谷机去除稻子外壳得到糙米,按照文献[9]的方法将糙米发芽,并制备发芽糙米粗糖蛋白样品,冻干保存备用。
1.1.2 试剂 DEAE-Cellulose 52,日本Pharmacia集团;乙醇(100%)、氢氧化钠、氯化铁、过氧化氢溶液、浓硫酸、乙酸、硫酸铜、邻苯三酚、硫酸亚铁、盐酸、苯酚(分析纯),南京生物化学试剂研究中心;单糖标准品、糖蛋白标准品,Sigma-Aldrich(中国上海)。
1.2 主要仪器
L-8900 型全自动氨基酸分析仪,美国Sigma公司;Nicolet 380 型傅里叶变换红外光谱仪,日本Thermo Electron Corp;MOS-450/AF-CD 圆二色光谱仪,英国Bio-Logic 集团;Ulti Mate 2500 高效液相色谱仪,德国Thermo 企业。
1.3 方法
1.3.1 发芽糙米粗糖蛋白的分离纯化
1.3.1.1 DEAE-Cellulose 52 阴离子交换柱层析纯化 对GBRG 粗品进行层析纯化处理[10],蒸馏水溶解糖蛋白粗品质量浓度为30 mg/mL,取10 mL 上样于溶胀好的DEAE-Cellulose 52,蒸馏水洗柱,流速3 mL/min,5 mL/管,接收10 管后,依次以0.1,0.2,0.3 mol/L NaCl 溶液进行洗脱,各收集10 管,利用考马斯亮蓝法、苯酚-硫酸法测定A490、A595,绘制梯度洗脱曲线,收集各峰,除盐后冻干备用。
1.3.1.2 Sephadex G200 琼脂糖凝胶柱层析 将获得的各峰糖蛋白分别溶于蒸馏水,取2 mL 样品上柱,0.1 mol/L NaCl 溶液洗脱,流速1 mL/min,2 mL/管,收集洗脱液,通过苯酚-硫酸法追踪含糖管,确定梯度洗脱曲线,洗脱峰透析、浓缩后冻干备用。
1.3.2 GBRG 各峰的结构表征
1.3.2.1 GBRG 各峰分子质量的测定 高效凝胶渗透色谱法测定GBRG 的分子质量,采用UniSilTM5-120 C18色谱柱,SFDRI-2000 型示差折光检测器,进样量20 μL,流动相为磷酸盐缓冲溶液,流速0.5 mL/min。以6 种分子质量(6,10,40,100,500,1000 ku)的葡聚糖为标准品,获得保留时间和分子质量lgM 的标准曲线,计算GBRG 各峰的相对分子质量。
1.3.2.2 GBRG 各峰的单糖组分分析 采用高效液相色谱法(HPLC)分析各峰的单糖组分[11]。单糖的参照标品为半乳糖、葡萄糖、甘露糖、阿拉伯糖、木糖、鼠李糖。取2 mg 样品,添加2 mL 三氟乙酸,密封,110 ℃水解7 h,得到水解后单糖混合物。加入少量蒸馏水溶解,将样品的pH 值调至中性,蒸馏水定容到1 mL,备用。将上述几种单糖标准品混合配制成2 mmol/L 的单糖标准混合溶液,纯化各峰经2 mol/L H2SO4在100 ℃水解8 h,水解产物经BaCO3中和后检测。流动相为乙腈∶磷酸缓冲液=8∶2(体积比),流速1 mL/min,进样量为20 mL。
1.3.2.3 GBRG 各峰氨基酸组分分析 取样品0.1 g,精确称重置入真空充氮密闭管中,添加5 mL 6 mol/L 盐酸,110 ℃水解24 h。取50 mL 水解液干燥为1 mL,0.02 mol/L 盐酸溶解,用氨基酸自动分析仪检测。色谱条件:氨基酸PAC-10 柱(3.8 mm×75 mm),流动相:双蒸馏水0.25 mol/L NaOH 和1.0 mol/L NAC,以17 个氨基酸为标准。在同一色谱条件下,根据保留时间计算样品内各氨基酸的含量[12]。
1.3.2.4 GBRG 各峰红外光谱分析 将1 mg GBRG 各峰样品分别与100 mg KBr 混合,研磨10 min 后压片,由Nicolet380 型傅里叶变换红外光谱仪在500~4 000 cm-1波长区域进行扫描[13]。
1.3.2.5 GBRG 各峰糖肽键特性分析 采用β-消除法分析GBRG 各峰糖肽键特性。将2 mg 纯化糖蛋白溶于1 mL 水中,加入1 mL 0.4 mol/L NaOH溶液,45 ℃水浴2 h。以1 mL 蒸馏水为空白对照,于190~350 nm 波长范围内紫外扫描,通过比较β-消除反应前、后的扫描结果变化确定糖肽键的类型。
1.3.2.6 GBRG 各峰的核磁结构分析 将GBRG各峰样品20 mg 溶于0.5 mL D2O 中。1H-NMR 谱在400 MHz、296.9 K 条件下由Bruker-400 NMR核磁分析仪测定[14],数据处理使用MestReNova5.3.1 软件。
1.3.2.7 GBRG 各峰圆二色谱分析 将GBRG 各峰溶解于pH 7.0,10 mol/L 磷酸盐缓冲溶液中,制备1 mg/mL 的样品溶液。扫描温度25 ℃,波长范围190~270 nm,扫描步长1.0 nm,速度5 nm/min,重复3 次。取得相关数据后通过CD Tool 软件进行图谱分析,得到α 螺旋、β 折叠、β 转角、无规卷曲的含量[15]。
1.3.3 GBRG 各峰抗氧化性能分析
1.3.3.1 GBRG 各峰DPPH 自由基的清除能力分析 参考文献[16]将0.5 mL 质量浓度为4.00 mg/mL 的GBRG 各峰和2.5 mL 0.1 mmol/L 的DPPH溶液充分混合,无水乙醇为空白组,抗坏血酸维生素C 为对照组,于517 nm 波长处检测,计算公式如下。

式中,E1——DPPH 的清除率(%);A0——空白组吸光度;A1——待测样品吸光度。
1.3.3.2 GBRG 各峰羟自由基的清除能力分析参考文献[17]将0.1 mL 质量浓度为4.00 mg/mL 的GBRG 各峰样品和1 mL 浓度为0.75 mmol/L 邻二氮菲无水乙醇溶液混合,添加2 mL 0.15 mol/L 的磷酸盐缓冲液,充分混合再加入1 mL 0.75 mmol/L 硫酸亚铁溶液,随后加1 mL 5 mmol/L H2O2溶液,使其体积分数为0.01%。37 ℃水浴1 h,于536 nm 波长处检测,双蒸水为空白组,抗坏血酸维生素C 为对照组。计算公式如下。

式中,E2——羟自由基的清除率(%);B1——样品反应后的吸光度;B2——蒸馏水代替样品;B3——样品和蒸馏水代替H2O2的吸光度。
1.3.3.3 GBRG 各峰超氧阴离子自由基的清除能力分析 参考文献[18]将0.1 mL 4.00 mg/mL 的待测糖蛋白和2.8 mL 0.1 mol/L 的Tris 缓冲液充分混匀。在25 ℃条件下水浴10 min,加入3 mmol/L焦性没食子酸溶液0.1 mL,并且每30 s 于325 nm波长处测1 次吸光度值,持续5 min,记录数据,并计算其回归方程,空白为蒸馏水,对照为抗坏血酸维生素C。计算公式如下。
式中,E3——超氧阴离子自由基的清除率(%);Va——焦性没食子酸氧化速率斜率;Vb——蒸馏水氧化速率斜率。
1.3.3.4 GBRG 各峰总还原能力分析 参考文献[19]在2 mL 4.00 mg/mL 的不同GBRG 中,依次加2 mL 1%铁氰化钾溶液和2 mL 0.1 mol/L 磷酸缓冲液。50 ℃水浴20 min,滴加2 mL 10%三氯乙酸溶液,混合均匀后,3 000 r/min 离心5 min,取2 mL 上清液;在上清液中添加0.4 mL 0.1%三氯化铁溶液及2 mL 蒸馏水,50 ℃水浴10 min,当溶液变色时,于700 nm 波长处检测吸光度值,将加入双蒸水组作为空白组,抗坏血酸维生素C 组为对照组。

2 结果与分析
2.1 发芽糙米粗糖蛋白的分离纯化结果
2.1.1 DEAE-Cellulose 52 阴离子交换柱层析纯化结果 DEAE-Cellulose 52 填料对糖蛋白层析纯化过柱洗脱曲线见图1。

图1 DEAE-Cellulose 52 洗脱曲线Fig.1 DEAE-Cellulose 52 elution curve
糖蛋白粗品所带电荷性质不同,经DEAECellulose 52 分离纯化后,获得蒸馏水洗脱峰1个,命名为WEG,NaCl 溶液洗脱峰2 个,分别命名为SEG-1 和SEG-2。3 个峰于595 nm 和490 nm波长处都有吸收值,是典型的糖蛋白洗脱峰。
2.1.2 Sephadex G200 琼脂糖凝胶柱层析 Sephadex G-200 凝胶洗脱曲线,如图2所示。

图2 Sephadex G-200 洗脱曲线Fig.2 Sephadex G-200 elution curve
WEG、SEG-1、SEG-2 经Sephadex G-200 纯化后,无新峰出现,这3 个组分在585 nm 和490 nm 波长处均有吸收峰,且变化趋势保持一致,表明WEG、SEG-1 和SEG-2 是糖蛋白。
2.2 发芽糙米纯化糖蛋白的结构分析结果
2.2.1 WEG、SEG-1 和SEG-2 分子质量的测定结果 采用高效凝胶渗透色谱测定WEG、SEG-1 和SEG-2 的分子质量,WEG 的分子质量约为9.96 ku;SEG-1 的分子质量约为10.6 ku;SEG-2 的分子质量约为18.9 ku。
2.2.2 WEG、SEG-1 和SEG-2 单糖组分分析结果WEG、SEG-1 和SEG-2 高效液相色谱结果见图3和表1。

图3 单糖标品和3 种GBRG 液相色谱图Fig.3 Monosaccharide standard and liquid chromatography of three kinds of GBRG

表1 GBRG 单糖组成分析Table 1 Analysis of glycoprotein monosaccharide composition in GBRG
由图3和表1可知,水洗糖蛋白WEG 由半乳糖醛酸、阿拉伯糖和葡萄糖组成,其摩尔比为2.4∶2.8∶3.9;SEG-1 由阿拉伯糖和葡萄糖组成,摩尔比为3.6∶1.7;SEG-2 由阿拉伯糖与葡萄糖组成,摩尔比为1.3∶1.1。
2.2.3 WEG、SEG-1 和SEG-2 氨基酸组分分析结果 发芽糙米纯化糖蛋白WEG、SEG-1 和SEG-2氨基酸组分分析如表2所示。

表2 GBRG 中氨基酸组分及占比Table 2 Amino acid component and ratio of the GBRG
如表2所示,3 种GBRG 经氨基酸分析仪检测,其氨基酸总量分别为29.66%,29.64%,28.51%。3 种糖蛋白中氨基酸占比最高是谷氨酸,占比分别为3.12%,3.57%,3.43%;最少的是组氨酸,占比分别为0.69%,0.60%,0.58%。
2.2.4 WEG、SEG-1 和SEG-2 红外光谱分析结果 3 种发芽糙米纯化糖蛋白WEG、SEG-1、SEG-2 红外光谱如图4所示,糖蛋白的红外光谱分析结果如表3所示。

图4 3 种GBRG 的红外光谱图Fig.4 Infrared spectra of three kinds of GBRG

表3 糖蛋白的红外光谱分析结果Table 3 Results of FTIR analysis of glycoproteins
由图4可知,3 种纯化糖蛋白在3 400,2 900,1 640,1 400 cm-1和1 000~1 075 cm-1周围均存在吸收峰,对此,它们均属于糖蛋白、多糖等特征峰。其中,O-H 伸缩振动在3 650~3 200 cm-1左右有强吸收峰,因为分子中-OH 之间具有H 键,能够让吸收峰加宽[20],其强值约在3 429 cm-1附近,表明分子内含有O-H(3 300~3 600 cm-1) 键或-NH2/NH/-NH3的N-H(3 500~3 100 cm-1)键伸缩振动,同时具备分子间或分子内的H 键。在3 000~2 800 cm-1附近属于饱和烃基(-CH2或-CH3)的C-H 伸缩振动峰。在1 640 cm-1附近属于C=O(羧基或酰胺羰基)伸缩振动与N-H 变角振动峰。1 540 cm-1附近属于CONH 基团C=O 键伸缩振动峰,也可以称作肽键的特征峰。在1 020 cm-1附近有吸收峰,表明存在C-O 和C-H 的伸缩振动,在670 cm-1附近为环状扭曲振动峰。WEG 和SEG-2 在1 420 cm-1附近有吸收峰,为亚甲基面内弯曲振动。WEG在1 384 cm-1处的吸收峰,为CH3对称弯曲振动;在1 140 cm-1处的吸收峰是C-O-C 伸缩振动。在1 000~1 075 cm-1存在吸收峰,表明3 种糖蛋白分子均含有吡喃环。
2.2.5 WEG、SEG-1 和SEG-2 糖肽键特性分析结果 糖蛋白峰WEG、SEG-1、SEG-2 经碱处理前后的紫外扫描结果如图5所示。

图5 β-消除前、后3 种GBRG 的紫外扫描图谱Fig.5 β-UV scanning in three kinds of GBRG before and after elimination
通常使用紫外分光度法在280 nm 处检测糖蛋白,以确定样液中是否存在蛋白质、多肽和核酸[21]。WEG、SEG-1、SEG-2 含有蛋白质组分,不含核酸。糖蛋白中糖肽键的常见类型是-O-型和-N-型。-O-衔接一般是通过糖与一些羟基氨基酸(如赖氨酸等)衔接。在稀碱状态影响下,赖氨酸中的糖链会分解,转变为α-氨基丙烯酸、α-氨基丁酸,其峰值均在240 nm 波长处形成。所以,利用对比碱处理前、后该波长处的样品吸光值,能够证明其内含有-O-糖肽键。图5给出了WEG、SEG-1、SEG-2 碱处理前、后的紫外扫描图像。碱处理前(虚线) 在240 nm 波长处的吸光度值分别为1.047,1.6175,1.8452。经β-消除反应后(实线),其波长240nm 处的吸光度分别提高到2.4858,2.8775,2.4682,表明WEG、SEG-1、SEG-2 均含有-O-糖肽键。
2.2.6 WEG、SEG-1 和SEG-2 糖苷键构型核磁分析结果 发芽糙米纯化糖蛋白WEG、SEG-1、SEG-2 组分的1H-NMR 谱如图6所示。

图6 3 种GBRG 组分1H-NMR 谱图Fig.6 1H-NMR spectra of glycoprotein components in three kinds of GBRG
从图6中可以看出,用1H-NMR 分析了GBRG 的化学结构。发芽糙米中糖蛋白的化学位移范围小于5 ppm1H-NMR,其中4.0~5.5 ppm 是糖苷键的主要质子信号区。然而,由于质子信号之间的重叠和干扰,1H-NMR 谱的分析并不是很清楚和容易。因此,第一碳的特征信号应在4.8~5.5 ppm 范围内进行分析和判断[22]。4.70 ppm 附近的谱峰为溶剂D2O 中氘质子信号1H-NMR 的化学位移为2.0 ppm,表明-O-糖肽键的存在。在3.65 ppm的信号是β-L-阿拉伯糖。在3.89 ppm 是C(O)NH信号。质子信号对应于不同的糖残基。δ 5.03 和δ 4.94 分别对应于α-(1.4)半乳糖醛酸和β-(1.4)葡萄糖[23]。
2.2.7 WEG、SEG-1 和SEG-2 圆二色谱分析结果发芽糙米纯化糖蛋白WEG、SEG-1、SEG-2 圆二色谱分析如图7所示。

图7 3 种糖蛋白圆二色谱图Fig.7 Three kinds of glycoprotein circular dichroism
利用圆二色光谱仪对活性分子的光谱图进行分析,是分析大分子物质结构的一个最精简、有效的方法。特别是在分析蛋白质的二级结构及外在条件对其构象造成干扰等方面是很普遍的,波长范围不一样的CD 谱能够说明其结构信息的差异性,波长在190~260 nm 附近能够得到肽链的结构特征:α-螺旋结构的3 个特征吸收峰,在190,208,222 nm 附近分别是正峰、负峰、负峰,β-折叠结构也包括3 个特征吸收峰,在217~218 nm 范围、195 nm 附近分别是负峰、正峰。在198 nm 处无规则卷曲有负峰,在220 nm 处有正峰。3 种糖蛋白通过圆二色谱仪进行测定,其图谱如图7所示,利用CD Tool、CD SSTR 软件进行分析,确定其结构特征,WEG-1 结构中α-螺旋占34.1%、β-折叠占12.3%、β-转角占24.2%、无规卷曲占33%。SEG-1为α-螺旋占43%、β-折叠占29%、β-转角占6%、无规卷曲占22%。SEG-2 为α-螺旋占44%、β-折叠占28%、β-转角占7%、无规卷曲占21%。
2.3 GBRG 的抗氧化作用研究
2.3.1 不同GBRG DPPH 自由基的清除能力分析结果 WEG、SEG-1 和SEG-2 对DPPH 自由基的清除能力结果如图8所示。
DPPH 是一种稳定的以氮为中心的自由基,一贯被用作抗氧化活性的研究试剂[24],当溶液中有具备清除自由基能力的物质存在时,DPPH 会与该物质提供的质子结合,使溶液的颜色由紫变黄。从图8可以看出,3 种4.00 mg/mL 的GBRG 均对DPPH有一定的清除能力,清除率分别为22.75%,15.67%,10.22%,其中WEG 对DPPH 的清除率最高。分析原因是糖蛋白的抗氧化活性与糖蛋白分子质量分布有关,较小的分子质量其抗氧化活性相对较高。虽然WEG、SEG-1 和SEG-2 对DPPH均有较好的清除效果,但总体低于抗坏血酸。

图8 3 种糖蛋白对DPPH 清除作用Fig.8 The scavenging effect of three glycoproteins on DPPH
2.3.2 不同GBRG 羟自由基的清除能力分析结果WEG、SEG-1 和SEG-2 对羟自由基的清除能力结果如图9所示。
Fe2+与H2O2反应生成Fe3+,加入糖蛋白溶液后,有色化合物消失。由图9可知发芽糙米糖蛋白体外抗氧化活性结果,当质量浓度是4.00 mg/mL时,WEG、SEG-1、SEG-2 对羟自由基均有较强的清除能力。清除率分别为94.4%,95.2%,98.7%。与抗坏血酸的清除率相差不大,对羟自由基抗氧化能力有积极作用,可以用做羟自由基清除剂。
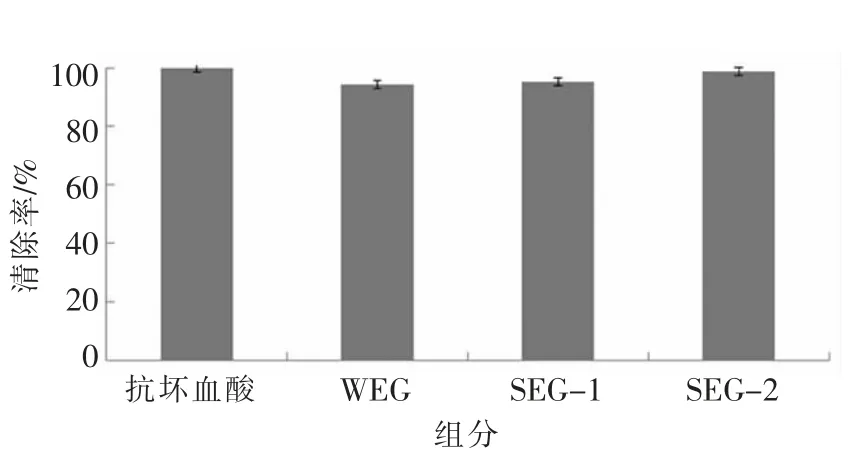
图9 3 种糖蛋白对羟基自由基的清除作用Fig.9 The scavenging effect of three glycoproteins on hydroxyl radical
2.3.3 不同GBRG 超氧阴离子自由基的清除能力分析结果 WEG、SEG-1 和SEG-2 对超氧阴离子自由基的清除能力结果如图10所示。
超氧阴离子在碱性环境中被邻苯三酚氧化,生成有色产物[25]。加入糖蛋白溶液后,自由基被清除,同时有色物质的生成被中断。由图10可知,WEG、SEG-1 和SEG-2 对超氧阴离子均有一定的清除效果,清除率各为24.63%,35.66%,12.04%,SEG-1 对超氧阴离子清除能力虽最强,但弱于抗坏血酸。

图10 3 种糖蛋白对超氧阴离子的清除能力Fig.10 The scavenging ability of three glycoproteins to superoxide anion
2.3.4 不同GBRG 总还原能力分析结果 WEG、SEG-1 和SEG-2 总还原能力结果如图11所示。

图11 3 种糖蛋白的总还原能力Fig.11 Total reduction ability of three glycoproteins
GBRG 作为氧化剂为铁氰酸钾提供电子,把Fe3+还原成Fe2+,吸光度值可以判断还原能力。物质的还原能力能侧面体现出其潜在的抗氧化能力,一般作为电子供体的物质通常具有一定的还原能力,可以将脂质过氧化过程中的中间氧化产物还原,具有初级或次级抗氧化性能[26]。由图11可知,WEG、SEG-1 和SEG-2 均具有一定的还原能力,清除率分别为0.208%,0.342%,0.501%,且SEG-2 还原能力与抗坏血酸相差不大,说明3 种GBRG 均具有较强的抗氧化性能。
机体在正常代谢过程中会产生一定的自由基,会对身体器官造成十分不利的影响。因此,探寻高效无害的天然抗氧化剂是目前开发研究的重要课题。许多研究表明糖蛋白拥有较强的抗氧化性能。徐永健等[27]从大海马体内提取纯化得到糖蛋白,并测定其抗氧化性能,结果显示:5.0 mg/mL的糖蛋白对DPPH 自由基的清除率高达95.2%;4.0 mg/mL 的糖蛋白对羟自由基的清除率为28.6%;2 mg/mL 糖蛋白对超氧阴离子的清除率为19.14%;质量浓度在1 mg/mL 以上还原力基本一致。董渭雪等[28]在大鲵黏液冻干粉内提取得到糖蛋白,并测定其抗氧化能力,结果表明:该糖蛋白对DPPH 自由基清除率为36.20%,羟自由基清除率为24.80%,超氧阴离子自由基清除率为20.40%。本试验提取的3 种发芽糙米糖蛋白WEG、SEG-1和SEG-2 均具有抗氧化作用,证明发芽糙米可作为“药食同源”的保健功能性食品,有极大的发展前景和开发潜力。
3 结论
糙米发芽后,营养物质和活性物质含量显著增加,糙米的保健价值显著提高。具有巨大的市场潜力和商业价值。在本研究中,获得了具有抗氧化作用的GBRG。首先,从发芽糙米中分离纯化出3种分子质量的糖蛋白:WEG、SEG-1 和SEG-2。分析了3 种GBRG 的单糖组成、氨基酸组成、糖苷键结构和二级糖链结构。在此基础上,对3 种GBRG进行抗氧化性能试验:对DPPH 自由基、羟自由基、超氧阴离子自由基的清除能力及总还原能力进行测定及研究。结果表明:3 种GBRG 均具有较强的抗氧化作用,为进一步探索和评价天然抗氧化保健食品提供了数据基础。拓宽了水稻食品潜在的应用领域,增加了其附加值,对促进我国水稻产业和农业生产的可持续发展具有重要意义。
