海参肠道内容物中海藻多糖降解菌的筛选及鉴定
2021-08-11白新峰贾爱荣刘雪张绵松崔婷婷刘德亭刘昌衡
白新峰 贾爱荣 刘雪 张绵松 崔婷婷 刘德亭 刘昌衡
(1.齐鲁工业大学生物研究所,济南 250103;2.山东海城生态科技集团有限公司,滨州 251909)
海参作为一种优质的天然营养保健食品,近年来需求不断增加,国内海参总产量超过1.7×105t,产值超过600亿元[1]。海参主要以微生物、大型藻类碎片、有机碎屑等为食[2]。在集约化人工养殖过程中通常会添加人工饵料以促进海参生长。大型藻类可作为水产养殖动物饵料的主要成分,其中,鼠尾藻是最优质的海参饵料,但其产量和价格限制其广泛应用。褐藻门的海带、马尾藻和羊栖菜,以及红藻门的石花菜、麒麟菜等同样是常见的大型藻类,这些藻类中含有丰富的褐藻胶和卡拉胶等藻类多糖成分。藻类多糖是藻类的重要组分,它们是由各类寡糖组成的高分子聚合物[3-4],藻类多糖具有调节机体免疫、促进动物生长发育、抗菌抗炎等多种生物学活性[5-7]。在水产养殖领域,藻类多糖作为饲料添加剂使用。研究表明添加浒苔多糖可以显著提高对虾的生长性能、提高免疫、改善肠道微生态结构[8]。饲喂海藻酸钠,可以提高鲍鱼的免疫活性、增强对病原菌的抗性[9]。但是藻类多糖结构稳定,不容易被海参等动物消化吸收,限制了藻类的高效利用。同时,藻类多糖具有较高的黏性,大量藻类多糖残留于养殖水体会导致水体环境污染。因此,通过微生物降解藻类多糖成分,促进海参等动物对藻类成分的消化吸收,提高藻类的应用范围和效率,具有重要的应用价值。
微生物是藻类多糖的主要分解者,研究人员已经从藻类体表、藻类生存环境以及动物消化道等生境中分离到大量的可以降解藻类多糖的微生物和酶类。这些藻类多糖降解菌主要来自噬琼胶菌属、单胞菌属、棒状杆菌属、假交替单胞菌属、芽孢杆菌属、单胞菌属、假单胞菌属和弧菌属等[10-12]。从养殖生境特别是动物肠道体内筛选的本土微生物,更容易适应养殖环境,可在肠道中形成长期定殖,同时对养殖环境和动物更加安全,因而是养殖领域有益微生物筛选的首选[13]。
本研究通过采用养殖过程中藻粉诱导的方式在海参体内富集海藻多糖降解微生物,分别以褐藻胶和卡拉胶为唯一碳源,经过富集和纯化,从海参肠道内容物中筛选具有褐藻胶和卡拉胶降解活性的微生物,并对其进行鉴定,为促进藻类在海参养殖领域的应用提供借鉴。
1 材料与方法
1.1 材料
1.1.1 样品来源 仿刺参(Apostichopus japonicus)采集于山东滨州地区养殖场。
1.1.2 培养基 (1)褐藻胶降解菌富集培养基:褐藻胶3 g-7 g,NaCl 15 g,MgSO4·7H2O 1 g,K2HPO42 g,FeSO4·7H2O 0.05 g,(NH4)2SO42 g,蒸馏水1 000 mL,pH 7.2。(2)卡拉胶富集培养基:卡拉胶3-7 g,NaCl 15 g,MgSO4·7H2O 1 g,K2HPO42 g,FeSO4·7H2O 0.05 g,(NH4)2SO42 g,蒸馏水1 000 mL,pH 7.2。(3)褐藻胶降解菌初筛培养基:褐藻胶5 g,其他成分同褐藻胶降解菌富集培养基。(4)卡拉胶降解菌初筛培养基:卡拉胶5 g,其他成分同卡拉胶降解菌富集培养基。(5)发酵培养基:蛋白胨10 g,酵母粉5 g,NaCl 15 g,褐藻胶或卡拉胶5 g,蒸馏水1 000 mL,pH 7.2。(6)蛋白酶、淀粉酶、纤维素酶活性验证培养基及LB培养基配方参照李凤辉的方法[14]。
1.1.3 试剂 本研究所用到的所有生化试剂均为国产分析纯试剂。总DNA提取试剂盒(OMEGA 土壤DNA提取试剂盒)。血琼脂平板(青岛日水生物技术有限公司)。
1.2 方法
1.2.1 菌种筛选
1.2.1.1 海参体内海藻多糖降解菌的富集 向商业化海参饲料中分别添加质量分数均为4%的海带粉和石花菜粉制成多糖降解菌诱导饲料。用该饲料喂养海参10 d,每日下午喂食一次,喂食量为海参体重的 1.5%,次日中午清理剩余残渣,并换水 1/2,通过饲喂诱导饲料达到富集海参体内海藻多糖降解菌的目的。
1.2.1.2 海参肠道内容物中海藻多糖降解菌的富集 饲喂结束后,无菌条件下解剖海参,获得海参肠道内容物。分别取0.5 g海参肠道内容物加入到50 mL褐藻胶降解菌富集培养基和卡拉胶降解菌富集培养基中,28℃条件下200 r/min震荡培养3 d。取上清液转接到新的相应富集培养基中,连续富集培养3次,逐渐提高培养基中褐藻胶和卡拉胶的浓度。
1.2.1.3 海藻多糖降解菌初筛 将最终富集液梯度稀释至10-3-10-5倍,取100 μL稀释液分别涂布于相应初筛培养基中,28℃条件下静置培养5 d,挑取具有明显降解圈的菌株,采用LB固体培养基进行划线分离纯化,最终得到纯菌种。
1.2.1.4 海藻多糖降解菌的复筛 活化菌种,按照5%(V/V)接种量接种到相应发酵培养基中,28℃震荡培养24 h,5 000×g离心10 min收集上清液,采用DNS法测定上清液对应海藻多糖降解能力。反应体系:1 mL上清液,1 mL 0.5%的海藻酸钠或卡拉胶,2 mL 0.1 mol/L的Tris-HCl缓冲液,40℃条件下反应30 min。反应完成后加入2 mL DNS 溶液终止反应,煮沸10 min,冰水冷却后5 000×g离心10 min,取上清液测定540 nm处吸光度值。酶活力(U/mL)定义:1 mL发酵液每分钟催化产生1 μg还原糖所需的酶量,定义为1个酶活力单位。
1.2.1.5 菌株生长及酶活力特性测定 菌株生长特性检测 采用LB液体培养基活化菌种,接种3%(V/V)的菌液200 mL相应发酵培养基中,在28℃条件下200 r/min 震荡培养。从0 h开始每隔3 h取样,测定600 nm吸光度值,绘制生长菌株曲线。在菌体生长特性检测过程中,同时取样检测发酵液的褐藻胶和卡拉胶降解酶活力,绘制发酵液酶活力变化曲线。
1.2.1.6 菌株降解饵料主要有机物能力 采用LB液体培养基活化菌种,接种4 μL菌液到相应固体平板,28℃静置培养3 d。蛋白酶直接观察透明圈,淀粉酶培养基采用卢戈氏碘液染色,CMC培养基采用刚果红染色。
1.2.2 菌株鉴定
1.2.2.1 菌株形态观察 在LB固体平板划线观察菌落形态,采用LB液体培养基培养菌体,通过光学显微镜观察菌体形态。
1.2.2.2 菌株的部分生理生化特征检测 参照《伯杰氏细菌系统分类学手册》。
1.2.2.3 菌株16S rDNA序列鉴定 使用土壤细菌DNA提取试剂盒提取集体发酵液总DNA,采用细菌测序通用引物进行PCR扩增(27F:AGAGTTTGATCMTGGCTCAG和1 492 R:TACGGYTACCTTG- TTACGACTT)。反应体系:H2O 25 μL,Mix Buffer 22 μL,上下游引物各2 μL,DNA模板1 μL,总体积50 μL;反应条件:95℃预变性5 min,33循环(95℃变性30 s,53℃退火30 s,72℃延伸1 min),循环结束后72℃延伸10 min。反应产物采用琼脂糖凝胶电泳检测纯度。将获得的特异性DNA产物送往上海生工生物工程技术服务公司采用ABI 3730XL全自动DNA测序仪进行DNA序列测定。测序结果在Ezbiocloud网站(https://www.ezbiocloud.net/)与模式菌株进行16S rDNA基因序列比对,以确定菌株种属。采用MEGA 7软件中的Neighbor-Joining法构建进化树。
1.2.3 菌株安全性检测
1.2.3.1 溶血活性检测 采用血琼脂平板法检测菌株溶血活性。取4 μL菌液点种到血琼脂平板上,28℃静置培养3 d,观察菌落周围是否出现透明圈,若出现透明圈,则具有溶血活性。
1.2.3.2 菌株应激海参实验 液体培养并离心收集菌体,使用无菌海水制成菌悬液,最终菌体浓度为1×108CFU。取个体重量为100 g左右健康海参30头,随机平均分为3组,实验组每头海参体内采用注射器注射0.5 mL菌液,对照组采用无菌海水替代菌液。3组海参分别放入0.8 m2海参培养槽,相同条件下养殖10 d,记录海参的健康状况及死亡率。
2 结果
2.1 菌株筛选
本研究通过添加海带和石花菜粉喂养海参,对海参体内褐藻胶和卡拉胶降解菌进行富集,采用海藻酸钠和卡拉胶作为唯一碳源,进行以上两种多糖降解菌的筛选,最终分别筛选到9株褐藻胶降解菌和7株卡拉胶降解菌。分别以两种多糖降解活性为指标进行复筛,选取活性最高的褐藻胶降解菌HZ-1和卡拉胶降解菌KL-6进行后续研究(图1-A,1-B)。
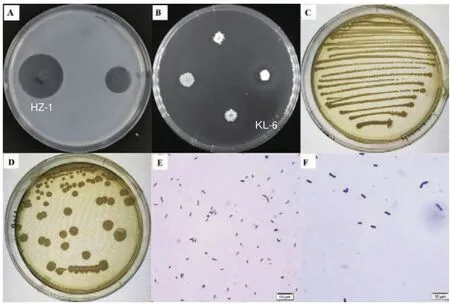
图1 菌株部分生物学表型Fig.1 Some biological phenotypes of the strains
2.2 菌株鉴定
2.2.1 菌株形态及生理生化特征 褐藻胶降解菌HZ-1和卡拉胶降解菌KL-6在LB固体平板表面形成圆形菌落,菌落呈淡黄色或黄褐色,菌落不透明,易挑起(图1-C,1-D)。液体培养条件下菌体形态均为杆状,其中HZ-1为较小的短杆菌,KL-6体型较大(图1-E,1-F),革兰氏染色结果均为阳性,通过芽孢染色均可检测到芽孢存在。两菌株适宜生长的pH范围均为5-8左右。在耐盐性方面,两菌株可在NaCl浓度为7%(W/V)条件下生长,菌株HZ-1具有更强的耐盐性,可以在NaCl浓度为10%(W/V)的条件下生长,但生长活性较弱,菌株KL-6无法在10%(W/V)的NaCl中生长。菌株HZ-1和KL-6均可以葡萄糖、果糖、木糖、甘露糖为唯一碳源进行生长,KL-6还可以利用阿拉伯糖进行生长。其他生理生化指标见表1。

表1 菌株HZ-1和KL-6的部分生理生化特征Table1 Some physiological and biochemical characteristics of strains HZ-1 and KL-6
2.2.2 16S rDNA测序分析 结果表明HZ-1与 Bacillus altitudinis相似性最高达99.3%,KL-6与Bacillus megaterium相似性最高达99.93%。结合两菌株的形态特征和生理生化结果,两菌株鉴定为芽孢杆菌,分别命名为Bacillus sp. HZ-1和Bacillus sp. KL-6,系统发育树如图 2所示。

图2 菌株HZ-1和KL-6的系统发育树Fig. 2 Phylogenetic tree of strains HZ-1 and KL-6
2.3 菌株生长及产酶特性
菌株HZ-1和KL-6均可在发酵培养基中快速生长(图3)。菌株HZ-1在18 h生物量接近最高值,OD值达到1.95,发酵液酶活力在24 h达到最高值,为43.2 U/mL。菌株KL-6在21 h生物量接近最高值,OD值达到2.75,发酵液酶活力在24 h达到最高值,为1.45 U/mL。进入稳定期后发酵液酶活力逐渐降低,推测可能由于菌体老化和营养物质浓度降低有关,菌株KL-6酶活力降低速率要低于HZ-1。

图3 菌株HZ-1(A)和KL-6(B)的生长和产酶特征曲线Fig. 3 Growth and enzyme production characteristic curves of strains HZ-1(A)and KL-6(B)
2.4 菌体降解其他有机物活性
微生物对饵料成分的降解可以促进动物对饵料的吸收利用,除褐藻胶和卡拉胶外,本研究检测了两菌株对海参饵料中其他主要有机物的降解能力。结果表明HZ-1具有降解淀粉、纤维素和蛋白质成分的能力,其透明圈直径和菌落直径的比值R/r分别为1.59、2.08和1.60。KL-6具有降解淀粉和蛋白质的能力,其R/r值分别为2.31和2.29(图4-A、4-B和 4-C)。
2.5 菌株安全性评估
菌株HZ-1具有溶血活性,KL-6无溶血活性(图4-D)。两菌株均为芽孢杆菌,菌株具有溶血活性可能并不会对动物具有致病性。为进一步研究菌株是否影响海参的健康,采用菌体应激的方法检测菌体对海参健康的影响。结果发现对照组和实验组海参均健康存活,没有出现死亡现象,表明两菌株对海参健康无显著影响。

图4 菌株部分生物学活性检测Fig. 4 Detection of some biological activities of the strain
3 讨论
褐藻、红藻等大型藻类是重要的海洋生物质资源,也是海洋动物的重要食物来源。多糖是藻类的重要活性成分,但是海藻多糖结构的稳定性导致其不易被动物消化吸收。海藻寡糖作为海藻多糖的降解产物同样具有良好的生物学活性[15-16]。研究表明,低分子量的海藻酸钠寡糖对罗非鱼的生长性能、免疫力和抗病性都有促进作用[17]。同时,小分子寡糖易被消化吸收,利用效率高,因此具有更广泛的应用前景。
筛选具有发酵海藻、降解藻类多糖能力的微生物和酶类,从而提高藻类的应用范围和效率是近年来的研究热点[18]。研究人员已从藻类体表、水体、海泥多处环境筛选到大量的具有褐藻胶和卡拉胶降解功能的菌株和降解酶[19-21]。本研究筛选出的褐藻胶降解菌HZ-1和卡拉胶降解菌KL-6,均为芽孢杆菌。芽孢杆菌作为一种重要的益生菌,具有安全性好、生长迅速、产酶种类多样、酶活力高的特点。研究表明,通过Bacillus amyloliquefaciens WB1发酵含有海带成分的海参饲料,降解褐藻胶成分,可以显著提高海参生长性能、非特异性免疫活性和对弧菌感染的抵抗能力[22]。菌株HZ-1和KL-6具有较高的海藻多糖降解活力,同时具有淀粉酶、蛋白酶活力,KL-6还具有纤维素酶活力,因而两株菌具有发酵海藻饲料的应用潜力。
芽孢杆菌是水生动物肠道菌群的重要组成部分[23]。肠道菌群作为动物降解食物的重要参与者,在水生动物降解藻类多糖过程中起到关键作用。李昌明等[24]对海参肠道菌群进行纯化培养,并对菌株进行褐藻胶降解能力检验,高活性菌株主要为弧菌属和芽孢杆菌属。本研究筛选的两株菌体来源自海参肠道内容物,因而其对海参和养殖环境安全性更高,研究结果也表明菌株HZ-1虽有一定溶血活性,但对海参健康无影响。同时,作为内源性菌株,两株菌体更容易在肠道定殖。因此,两菌株可以直接作为菌剂投放于养殖水体,使其在海参肠道定殖,改善肠道菌群结构,提高海参肠道菌群酶系活力,增加海参对藻类及其他食物的利用率。
4 结论
通过藻粉诱导富集,从海参肠道内容物中筛选到高活性的褐藻胶降解菌HZ-1和卡拉胶降解菌KL-6,经生理生化检测和16S rDNA 测序鉴定两菌株均为芽孢杆菌。
两菌株生长迅速,其生物量在20 h左右即可达到最高值。在24 h时HZ-1酶活力达到43.2 U/mL,KL-6卡拉胶酶活力为1.45 U/mL。
两菌株生长的pH范围均为5-8左右。两菌株可在NaCl浓度为7%(W/V)条件下生长,菌株HZ-1具有更强的耐盐性,它可以在NaCl浓度为10%(W/V)的条件下生长。两菌株可以利用葡萄糖、果糖、木糖、甘露糖作为唯一碳源,KL-6还可以利用阿拉伯糖进行生长。
两菌株均具有较高的蛋白酶和淀粉酶活性,HZ-1还具有纤维素酶活力。HZ-1具有一定溶血活性,但是两菌株对海参健康无明显影响。
