野生牛大力子叶诱导愈伤组织方法初探
2021-08-11周如鹍方利娟庞月兰
周如鹍,方利娟,庞月兰
(1 广西壮族自治区茶叶科学研究所,广西桂林 541004 2 百色学院,广西百色 533000)
牛大力,又叫牛古大力、山莲藕、猪脚笠,因其主要以块茎为药为食,所以又叫大力薯。牛大力属于豆科(Leguminosae)崖豆藤属(Millettia Wight et Arn.),美丽崖豆藤(Millettia specisoa Champ),其性味甘、平,具有润肺、补虚、强筋活络的功用,临床医学研究表明:牛大力对腰肌劳损、慢性支气管炎、肺结核、风湿性关节炎等疾病有不错的疗效[1]。研究表明:牛大力含有大量的三萜类、木质素类、黄酮类、多糖类物质[2],其中异甘草素、芒柄花素、高丽槐素[3]等黄酮类成分含量较高,在此之前高丽槐素已经被证实具有抗菌、抗寄生虫、抗癌等功效[4]。膳食方面:块茎富含淀粉、蛋白质及生物碱,牛大力块茎中还富含微量元素,如锌、铁、钙、锰、镁、铜等,这些元素对人体新陈代谢有重要作用,可参与机体内酶、血红蛋白的合成,增强人体造血能力[5]。
野生牛大力具有很高的药用、膳食保健价值,市场对野牛大力需求日益增大,野生牛大力供不应求,随之而来的是人们对野生牛大力的过度采挖,造成野生牛大力数量急剧减少,严重影响野生牛大力资源可持续利用。为满足人们对牛大力的需求,引导群众通过人工栽培提高牛大力产量,增加山区人民的经济收入,避免野生牛大力受人为过度破坏,保障牛大力野生资源的可持续利用,利用野生牛大力资源进行人工繁殖已刻不容缓。目前,牛大力主要靠种子繁殖方法,其繁殖系数低、生长慢,品种退化,病毒传染严重,进行牛大力组织培养技术的研究有助于解决这些问题。
国内外研究者对牛大力进行了大量的组培研究。消毒方面:张桂琴和黄雪娟[6]以牛大力嫩枝为外植体,用70%酒精和0.1%升汞滴加吐温进行消毒,消毒结果污染率最低为20%,最高为90%,褐化率最低为40%,最高为95%;时群等[7]以嫩茎为外植体进行表面消毒,采用0.1%的HgCl2溶液,同时添加1 滴吐温-80 进行5 min 灭菌后,添加50 mg/L 的头孢唑林钠溶液进行浸泡,时间为10 s,无菌水冲洗后接种到添加10 mg/L 头孢唑林钠的MS 培养基中培养,牛大力外植体污染率20%。愈伤组织诱导方面:黄碧兰等[8]研究者以牛大力嫩茎为外植体,以MS+1.0 mg/L6-BA+0.1 mg/LIBA 作为启动培养基,诱导率高达100%,生根率达到80%;潘颖南等[9]研究者以牛大力嫩茎为外植体,再以MS 为基础培养基,添加浓度为2.0、2.5 mg/L 的6-BA 和0~2.5 mg/L 进行诱导培养,诱导率达58.3%。国内外研究者多以嫩茎和嫩叶片为外植体进行消毒和愈伤组织诱导研究,由于嫩茎和嫩叶片表面被有大量短绒毛,与外界直接接触附着大量的病菌,消毒困难,污染率较高[7]。牛大力果实有一层厚豆荚壳包裹,避免种子与外界接触,种子子叶有种皮包裹,极大保障子叶不受外界感染,本试验在总结前人对外植体、消毒方法、诱导激素[10-11]的选用经验基础上,尝试利用野生牛大力子叶片诱导愈伤组织,探索可靠的外植体消毒及愈伤组织诱导方案,建立野生牛大力快速繁殖技术体系,以期为野生牛大力资源可持续利用提供技术参考。
1 材料与方法
1.1 试验材料
本试验所用野生牛大力种子取自广西钦州市十万大山,摘取成熟饱满的野生牛大力豆荚晒干备用。
1.2 试验方法
1.2.1 外植体消毒试验。本试验参考前人对子叶类外植体的消毒研究,采用无菌水浸泡4 h,将种子子叶泡剥开种皮得到子叶片,采用75%酒精和HgCl2搭配使用进行消毒,先统一用75%酒精对子叶消毒15 s,结合不同浓度梯度(0.1%、0.2%、0.3%)HgCl2浸泡不同时间梯度(5 min、8 min、10 min)组合得到9 个消毒处理(A1~A9),每个消毒环节均用无菌水浸洗3 次,然后将子叶片切成0.5cm×0.5cm 的块状外植体接种到无菌MS 培养基中,每个消毒处理6 瓶,每瓶接种4 块外植体,置于无菌环境下培养观察,统计外植体污染及成活数量。
1.2.2 愈伤组织诱导试验。本试验尝试以MS 为基本培养基,分别添加不同浓度6-BA、2,4-D、NAA 设置2 个愈伤组织诱导方案,方案1:MS+6-BA(0.5mg/L、1.0mg/L、1.5mg/L、2.0mg/L)+NAA(1.0mg/L、2.0mg/L、3.0mg/L);方案2:MS+6-BA(0.5mg/L、1.0mg/L、1.5mg/L、2.0mg/L)+2,4-D(1.0mg/L、2.0mg/L、3.0mg/L),每个方案分12 个配方,每个配方6 瓶。配方如下表:

表1 愈伤组织诱导方案1(MS+6-BA+NAA)

表2 愈伤组织诱导方案2(MS+6-BA+2,4-D)
分析1.2.1 试验结果,获得可靠消毒方案对外植体进行消毒,并接种到方案1 和方案2 诱导愈伤组织培养基中,每个培养瓶接种外植体4 个,每个诱导配方共接种24 个外植体,放置无菌环境下培养,保持光照16 h/d,温度22~25 ℃。培养过程中观察外植体是否受到细菌性污染,观察每个配方外植体诱导愈伤组织始愈时间、愈伤组织数量、愈伤组织色泽、质地疏密度以及愈伤化程度并作记录。
2 结果与分析
2.1 不同处理对外植体表面消毒效果的影响
本次消毒试验9 个方案在75%酒精消毒时间及HgCl2消毒时间相同情况下,HgCl2浓度越高,污染率越低,成活率呈下降趋势,其中A1、A4、A7方案相比较污染率由12.5%下降至4.2%趋平,A1、A4成活率为87.5%,处于良好水平,A7下降至79.2%;A2、A5、A8方案相比较,A2、A5污染率为4.2%,A8下降至0;A2成活率最高,达95.8%,A5降至83.3%,A8降至66.7%;A3、A6、A9方案相比较,A3污染率为4.2%,A6及A8均降至0,污染率大大降低;A3成活率91.6%,A6、A9降至较低水平75.0%、54.2%。
9 个处理总体表现为消毒时间越长,污染率越低,成活率越低,HgCl2浓度越高,污染率越低,成活率越低,综合分析得出,A2为最优消毒方案,即外植体经75%酒精消毒15 s、0.1%HgCl2消毒8 min 后接种污染率控制在4.2%的较低水平,成活可达95.8%。
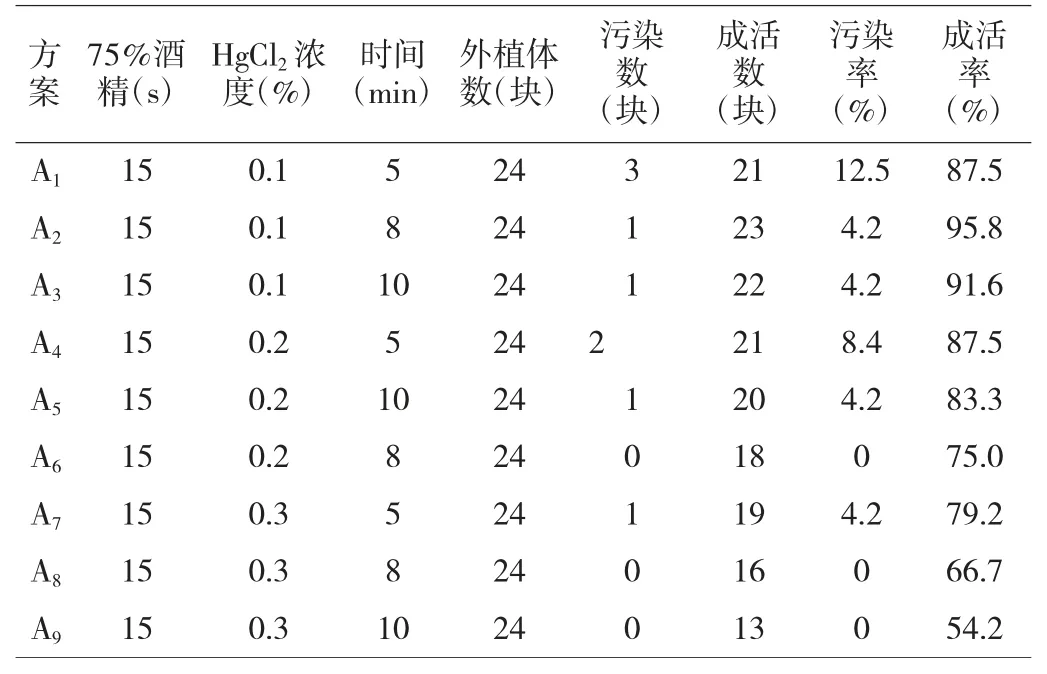
表3 不同处理对外植体表面消毒效果的影响
2.2 方案1(MS+6-BA+NAA)愈伤组织诱导效果分析
2.2.1 愈伤组织生长态势分析。由表4 可见,外植体培养7d 后配方B1和配方B3各出现褐色乳状染菌1 瓶,配方B2和配方B9各出现黑色丝状染菌1 瓶,配方B5、B7、B12各出现白色丝状染菌1 瓶,继续培养观察其他外植体不再出现新的污染。外植体培养至7d 时各配方均长出愈伤组织,各配方始愈情况:B1、B5始愈时间为4d,B10、B12始愈时间为5d,B2、B4、B7、B9、B11始愈时间为6d,B3、B6、B8始愈时间7d,培养至30d 出愈数接近稳定,愈伤组织大小未定型,40d 出愈数固定,愈伤组织大小定型。

表4 不同浓度6-BA 和NAA 对愈伤组织生长的影响
由颜色可见,配方B1、B3、B5、B10、B12色泽最好,配方B2、B8、B9色泽次之,配方B4、B6、B7、B8、B11色泽最差;由疏密度可见,配方B1、B5、B6、B8、B10、B12疏松度最好,有利细胞增殖,如配方B10中的愈伤组织(图6)色泽为浅绿色,质地疏松,生长态势较好,配方B2、B3、B9疏密度次之,配方B4过于紧密,细胞增殖空间小,效果较差,配方B7、B11过于松散细胞团容易散落,不利于愈伤组织生长,效果较差,如配方B6中牛大力愈伤组织(图7)色泽偏黄,质地松散,生命力弱。综合分析得出,愈伤组织生长效果:配方B1、B5、B10、B12效果较好,配方B2、B3、B8、B9次之,配方B4、B6、B7、B11较差。

图6 配方B10 愈伤组织
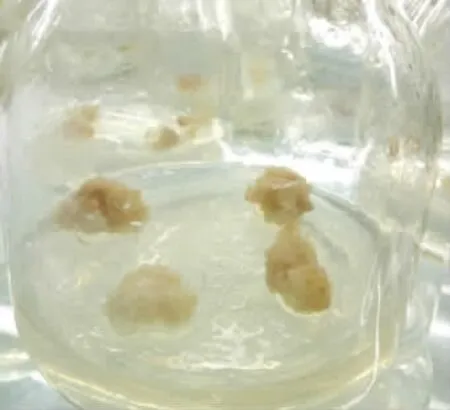
图7 配方B6 愈伤组织
2.2.2 愈伤组织成活率、诱导率及出愈率分析。由表5可见,经过40d 培养诱导出稳定的愈伤组织,12 个配方的成活率平均值为67.0%,最高值为配方B3(MS+1.5 mg/L6-BA+1.0 mg/LNAA),达到95.8%,最低值为配方B7和配方B11,仅为37.5%;诱导率平均值为50.0%,最高值为配方B3(MS+1.5 mg/L6-BA+1.0 mg/LNAA)和配方B10(MS+1.0 mg/L6-BA+3.0 mg/LNAA),均 达 到79.2%,最低值为配方B7,仅为20.8%;出愈率的平均值为72.1%,最高值为配方B1(MS+0.5 mg/L6-BA+1.0 mg/LNAA),达到89.5%,最低值为配方B7(MS+1.5 mg/L6-BA+2.0 mg/LNAA),仅为45.5%。优良的配方诱导效果应是出愈率、成活率、诱导率均较高,出愈时间早,愈伤组织生长态势应是色泽绿,愈伤化程度高,质地有一定的疏松度且生长旺盛。比较分析得出愈伤组织生长效果:配方B1、B5、B10、B12效果较好,配方B2、B3、B8、B9次之,综合分析方案1 得出:野生牛大力子叶诱导愈伤组织最优配方为B10:MS+1.0mg/L,6-BA+3.0 mg/L NAA。

表5 不同浓度6-BA 和NAA 对愈伤组织成活率、诱导率和出愈率的影响
2.3 方案2(MS+6-BA+NAA)愈伤组织诱导效果分析
2.3.1 愈伤组织生长态势分析。由表6 可见,外植体培养7d 后配方C1出现白色乳状染菌1 瓶,配方C3出现淡黄色及白色乳状染菌两瓶,配方C6出现褐色粉状染菌1 瓶,配方C10和配方C11出现白色乳状染菌各1 瓶,配方C12出现白色丝状染菌1 瓶。外植体培养至7d 时,各配方均已长出愈伤组织,30d 时出愈数接近稳定,愈伤组织大小未定型,40d 时出愈数固定,愈伤组织大小定型。间隙小不利于增殖效果差。

表6 不同浓度6-BA 和2,4-D 对愈伤组织生长的影响
由始愈时间可见各配方出愈时间较相近,均在3~6d,最快的是配方C4,培养4d 开始长出愈伤组织,最慢的是配方C9、C10,需要6d,其他均为4d 或5d 出愈时间较为相近;由颜色可见配方C1、C2、C4、C5、C8、C10诱导出来的愈伤组织色泽显浅绿色,色泽最好,配方C3、C7、C11培养出来的愈伤组织颜色显黄绿色,色泽次之,配方C3、C6、C9、C12的愈伤组织色泽偏差,显黄色;由疏密度可见配方C1、C2、C3、C5、C8、C10疏松度最好,细胞间隙充足不松散,利于细胞持续增殖,配方C4、C7、C11疏密度次之,有一定的增殖空间,但紧密度较高,影响增殖效果,配方C6则过于紧密,细胞间隙小,没有足够空间给内部细胞增殖,效果较差,配方C7、C11过于松散,愈伤组织容易散落,不利于细胞增殖,效果较差;由愈伤化程度可见配方C1、C2、C4、C5、C8、C10、C11分化效果最好,总体分化程度大于3/4,配方C3、C6、C7、C9、C12风化效果较差,没有超过1/2。比较分析可得:配方C1、C4、C8、C11愈伤组织生长效果最好,如配方C4中的愈伤组织生长色泽浅绿,质地疏松,愈伤完全,生命力旺盛,是优质的愈伤组织;配方C2、C5、C10次之,配方C3、C6、C7、C9、C12愈伤组织生长状况较差,如配方C9,其愈伤组织色泽偏黄偏暗,质地偏散,愈伤化程度低,生长态势较差。
2.3.2 愈伤组织成活率、诱导率及出愈率分析。由表7可见,方案2 诱导试验中配方C4、C8成活率最高,达到100%,其次是配方C5,成活率为95.8%,最低为配方C3,其成活率为66.7%,总体平均值为84.4%;由诱导率可见配方C4、C10诱导率较高,超过90%,诱导率最低的是配方C3,其诱导率过低是受到污染率过高的影响,出现出愈率高但是诱导率偏低的现象,总体诱导率平均值为73.3%,诱导率处于中上水平;由出愈率可见配方C1、C4、C8、C10、C11出愈率较高,均超过90%,出愈率最低为78.9%,总体出愈平均值为86.4%,出愈效果较优。比较分析得出:配方C1、C4、C8、C11愈伤组织生长效果最好,配方C2、C5、C10次之,配方C3、C6、C7、C9、C12愈伤组织生长状况较差;配方C1、C4、C8、C11愈伤组织诱导效果较好,其中配方C4诱导愈伤组织出愈时间最早,仅为3d,色泽浅绿,愈伤组织疏松度较好,愈伤化接近100%,其外植体率,诱导率,出愈率高于95%,诱导效果最好,综合分析方案2 得出野生牛大力子叶诱导愈伤组织最优配方为C4:MS+0.5 mg/L 6-BA+2.0 mg/L 2,4-D。

表7 不同浓度6-BA 和2,4-D 对愈伤组织成活率、诱导率和出愈率的影响
3 讨论与结语
本试验在以野生牛大力子叶作外植体进行愈伤组织诱导试验中,消毒试验污染率低于10%,平均成活率为84.4%,污染率比用嫩茎消毒20%左右的污染率降低10%[7],成活率较以嫩茎为外植体高,表明子叶是诱导愈伤组织较可靠的外植体。
在外植体消毒方案优选中,综合污染率和成活率分析得出A2为最优消毒方案,即通过75%酒精消毒15 s,再用0.1%HgCl2消毒8 min,获得的外植体成活率达95.8%,属于较高水平,污染率4.2%,属于较低水平,可用作野生牛大力子叶诱导愈伤组织试验消毒方案,但本试验仅以HgCl2作为主要消毒药品,并未采用其他消毒药品进行比较试验,为牛大力子叶外植体消毒提供更多选择,这是本次消毒试验的不足之处。
愈伤组织的特点是色泽绿,疏密度适中,生长快,生命力旺盛,愈伤化程度越高,诱导效果越好,愈伤组织疏密程度对下一步进行试验探究非常重要,愈伤组织质地较密时有利于进行芽和根的诱导,愈伤组织松散时有利于进行悬浮培养,而质地适度疏松有利于进行愈伤组织的扩大繁殖,在选择最优诱导调节剂配方时,需要综合考虑愈伤组织的色泽、疏密度、愈伤化程度、污染率、成活率、出愈率,其中出愈数和成活数的比值,最能判断愈伤组织的诱导效果好差,诱导率则受到外植体污染和死亡的影响,因为诱导率将外植体污染死亡数算作有效因素,而污染因素很多,外植体本身携带,培养基灭菌不彻底,人为操作不当等。本试验2 个愈伤组织诱导方案均分别得出最优配方,即B10:MS+1.0 mg/L 6-BA+3.0mg/LNAA,C4:MS+0.5mg/L6-BA+2.0mg/L2,4-D,综合比较2 个配方的各个参数,方案1 配方B10始愈时间、色泽、疏松度、愈伤化程度、成活率、诱导率、出愈率等数据总体低于方案2 配方C4,在以牛大力子叶做外植体诱导愈伤组织生产中可优先参考使用配方C4:MS+0.5 mg/L 6-BA+2.0 mg/L 2,4-D。
