苹果腐败菌的分离与鉴定
2021-08-11季春艳段梦晴曾雅倩独梦蕊刘生杰刘艳红
季春艳,段梦晴,曾雅倩,独梦蕊,刘生杰,2, 刘艳红
(1.阜阳师范大学 信息工程学院,安徽 阜阳 236037;2.阜阳师范大学 生物与食品工程学院,安徽 阜阳 236037)
苹果中含有丰富的营养物质,因其营养价值高为人们所喜爱,但富含营养也为腐败微生物滋生提供了良好条件,为苹果的贮藏保鲜带来难度[1]。影响苹果腐败变质的因素有很多,有物理因素、化学因素、生物因素等,其中微生物感染是导致苹果腐败变质的重要原因。只要环境适宜,病原菌侵染苹果后生长繁殖,分解吸收利用果实中的营养物质,来满足自身生长代谢的需要,苹果的营养成分被破坏,果实腐败并产生不良气味,失去了原有的感官品质和营养价值[2-3]。苹果的常见微生物侵染型病害有霉心病、轮纹病、青霉病等[4]。引起这些病害的主要微生物为青霉(Penicillium sp.)、链格孢菌(Alternaria sp.)、曲霉(Aspergillus sp.)等,都是从碰、压、磕、刺伤或病虫害的部位侵入果实,引起苹果发病。苹果腐败变质严重阻碍了我国苹果产业的发展。
以市售常见红富士腐烂苹果为原料,对烂苹果上的微生物进行了分离,通过侵染试验验证分离菌株的致腐能力,并对该微生物进行鉴定,以期为深入研究致腐微生物对苹果的致病机理和保鲜提供参考。
1 材料与方法
1.1 材料
市售自然腐烂红富士苹果。
1.2 仪器设备
BPC-250F 型生化培养箱,上海智城分析仪器制造有限公司产品;T100P 型PCR 仪,上海兴曼生物科技有限公司产品;BM1000 型光学显微镜,德国Eppendof 公司产品。
1.3 试验方法
1.3.1 分离可能的致病菌
挑选腐败的红富士苹果,切除苹果表面腐败组织作为样品,将25 g 果肉样品加入225 mL 灭菌水中,均质,按照10 倍系列稀释[5]。选择适当的稀释液,取1 mL 的稀释液涂抹在PDA 培养基上。培养1~2 d,再用平板划线方法分离纯化,连续纯化5~6 次,直至长出单个菌,将纯化的菌种置于4 ℃下保存[6-8]。
1.3.2 致腐能力测定
(1)孢子悬浮液制备。将已分离菌接种到PDA培养基上,在28 ℃下培养约5 d,挑取菌落孢子于无菌水中,用血球板计数,孢子悬浮液的质量浓度配制为1×105CFU/mL。
(2)接种。苹果→清洗→消毒(200 mg/L 次氯酸钠浸泡10 min)→70 %酒精喷涂苹果表面→晾干→在苹果果实的赤道部位用灭菌不锈钢铁钉(约4 mm)形成统一大小的创伤口。每个苹果随机选择3 个创口接种20 μL 孢子悬浮液,另一个创口接种等量的无菌水作为对照试验。
(3)菌斑直径的测量。接种后的苹果放置在28 ℃环境下培养,并每天观察和测量病斑直径,若苹果病斑直径大于2 mm 为腐败菌,反之不是腐败菌。
1.3.3 菌株的鉴定
(1)形态观察。挑取纯培养菌落,于光学显微镜下观察菌株形态特征,进行初步鉴定。
(2)微生物基因组DNA 提取与电泳检测。采用CTAB 方法提取基因组DNA,主要参照易庆平,冯广达等人[9-10]的方法,配制质量分数为0.7%的凝胶,电泳检测基因组DNA。根据电泳检测结果判断该菌基因组序列大小[3,11]。
(3)真菌ITS 序列测定与分析。将提取出来的DNA 产物送往北京睿博兴科生物技术有限公司测序,采用ITS 序列扩增通用引物ITS4,ITS5 进行PCR 扩增,从而鉴定分离纯化的菌的ITS 序列,将测得的序列通过BLAST 软件进行比对,并构建系统发育树。
2 结果与分析
2.1 分离可能的致病菌
注射孢子悬浮液5 d 后的苹果腐败情况见图1。
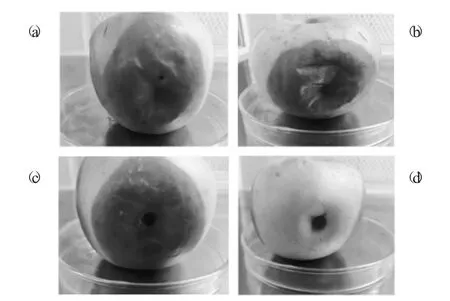
图1 注射孢子悬浮液5 d 后的苹果腐败情况
2.2 致腐能力测定
注射孢子悬浮液后的病斑直径见图2。
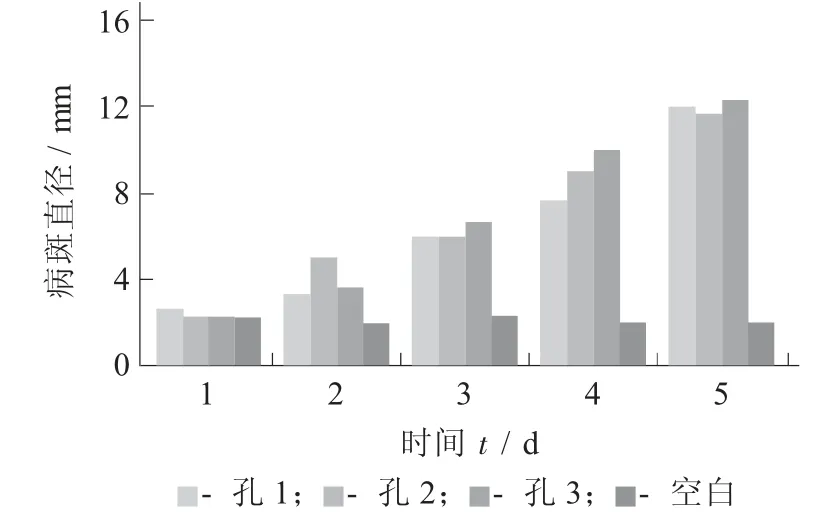
图2 注射孢子悬浮液后的病斑直径
图1 是在同一个苹果上用灭菌不锈钢铁钉(约4 mm)形成统一大小的创伤口,4 个创伤口,如图1(a)(b)(c)(d),分别命名为孔1,2,3,4,其中孔1~3(a~c)是试验组,3 个孔分别接种质量浓度为1×105CFU/mL 的该菌孢子悬浮液20 μL 于28 ℃培养5 d,图1(d)为对照组,即接种等量的无菌水。图2 为接种后1~5 d 菌斑直径的测定结果。从图1 和图2 可以看出,该菌可以使健康苹果腐败,且病斑直径随着接种时间延长不断生长,根据科赫法则原理,可以确定分离出的菌株能够使苹果腐败。
2.3 菌株的鉴定
2.3.1 形态观察
对纯化后的菌进行形态学观察见图3。
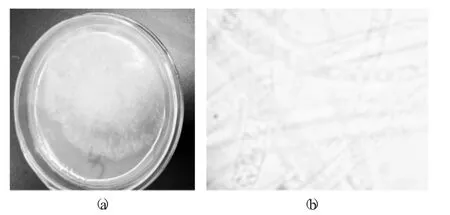
图3 对纯化后的菌进行形态学观察
从苹果表面提取病料,接种至PDA 培养基,经分离纯化发现培养基上长出单个菌落,菌落较大、疏松、干燥,呈绒毛状,灰白色,可沿培养基表面蔓延生长(图3(a))。挑取单菌落边缘部分于载玻片上的无菌水中,在光学显微镜下(油镜下,10×100 倍)观察,可以看出有纤细管状的疑似菌丝的结构(图3(b)),从形态观察推测该菌株是真菌。
2.3.2 ITS 序列扩增及电泳
基因组DNA 电泳的检测结果见图4。
从纯化后的菌株中提取了7 管基因组DNA,编号为1~7,分别以7 管中的DNA 为模板,以真菌ITS 通用引物进行PCR 扩增,用琼脂糖凝胶电泳进行检测,从图4 中可以看出,1,2,4,5 这4 个管中序列DNA 条带明显,且DNA 序列大小在500 bp左右,这与真菌的ITS 序列片段长度一般在500~750 bp 相吻合,所以可以初步判断该菌株为真菌。
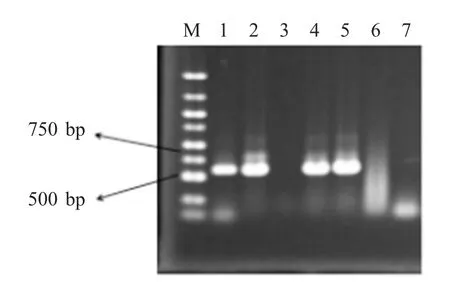
图4 基因组DNA 电泳的检测结果
2.3.3 真菌ITS 序列测定与分析
将提取出来的DNA 产物进行基因序列的测定,得到真菌的基因ITS 序列。
真菌ITS 测定序列见图5。

图5 真菌ITS 测定序列
将测得的序列通过BLAST 软件进行比对[12-17],比对结果显示,菌株(命名为XXGC-1)与色二孢属基因序列的同源性高达99.34%,将测得的序列通过BLAST 软件与已知微生物比对构建系统发育树,在系统发育树中XXGC-1 与色二孢属Diplodia seriata CBS 112555(NR 111151.1)等菌能聚在一起(图6),表明菌株是色二孢属中一种。
基于ITS 序列构建的系统发育树见图6。
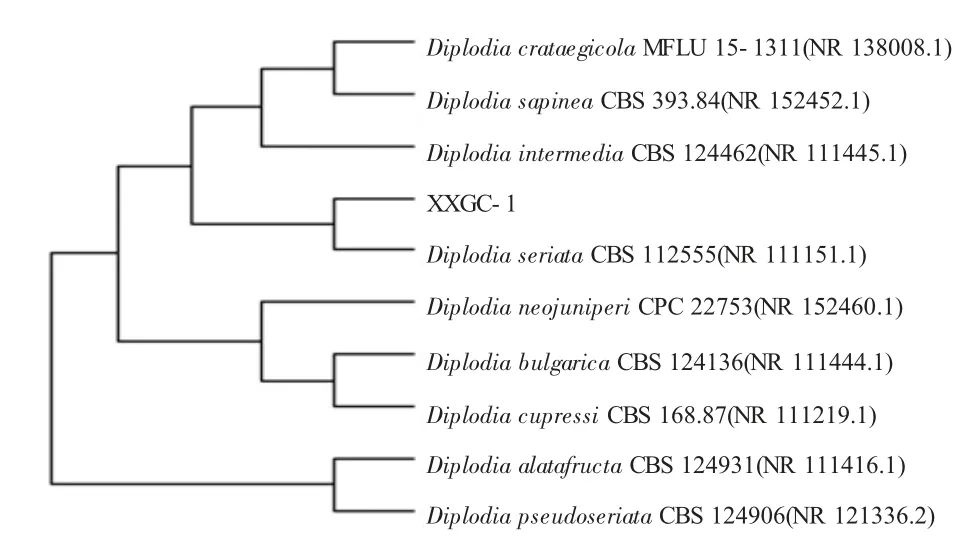
图6 基于ITS 序列构建的系统发育树
3 结论
对腐烂苹果上腐败菌分离、鉴定。通过平板分离纯化、苹果菌落特征观察、光学显微镜观察、ITS序列测定,及系统发育树构建,结果表明该菌种与色二孢属(Diplodia seriata)有99.34%的相似率,且与色二孢属Diplodia seriata CBS 112555(NR 111151.1)亲缘关系最近。通过侵染试验表明,该菌种具有致腐能力。致腐试验结果与原腐败现象基本一致、症状表现基本相同。
目前,从腐败苹果中分离并鉴定出的微生物主要有细菌和真菌,细菌有欧文氏菌(Erwinia)、假单胞菌属(Pseudomonas)、黄单胞菌属(Xanthomonas)、棒杆菌属(Corynebacteriurn)、芽孢杆菌属、梭状芽孢杆菌属等,真菌有青霉菌属(Penicillium)、曲霉属(Aspergillus)、枝孢属(Cladosporium)等,色二孢属在果蔬种植过程中较常见,如它能够引起葡萄藤顶端枯萎、藤蔓变白、芽体坏死及嫁接失败等症状。而对于色二孢属对苹果果实的致腐问题鲜有研究。
一般腐败霉菌侵入果蔬组织先附着在果蔬表面,孢子萌发产生芽管能够识别合适的渗透位置,然后形成附着胞和侵染垫等侵染结构,在侵染结构形成期间,逐渐代谢产生纤维素酶和果胶酶等细胞壁降解酶,腐败霉菌的主要致病因子是细胞壁降解酶和毒素,有的腐败菌也会增加苹果中促使果蔬发生褐变的关键酶的活性,如PPO 和POD 等,从而加速果实的褐变反应;有的腐败菌能够改变果蔬的风味物质,加快风味物质的代谢和挥发,改变与软化相关的关键酶的活性,如PG、PME、CX 酶等[3]。所以,推测试验分离的腐败菌可能有以上致病机理。试验存在一些不足之处,只对苹果上的腐败菌进行分离鉴定,且只分离鉴定出一种菌,未能分离出多种菌株,也无法解释该菌的致病机理,在此试验的基础上可以从以下几个方面进行深入研究:
(1)该菌种导致苹果腐败机理尚不清楚,还需要进一步检测相关指标,如坏果率、抗坏血酸含量、丙二醛含量、过氧化氢酶活性等,同时也可进一步检测相关抗性基因表达情况,从而进一步探寻该菌对苹果果实的致腐机理及苹果果实的应答机制。
(2)寻找能够抑制苹果中的色二孢属(Diplodia seriata)的方法,并通过感官评价和相关指标的测定证明该方法安全有效。
(3)在腐烂的苹果上再分离纯化多个菌种,并探寻它们的致病制腐机理,也可从其他腐烂水果上分离鉴定菌种,并探寻其致病或致腐机理。
(4)探寻苹果保鲜方法,找到抑制有害微生物生长繁殖的安全可行的方法。但是,由于其中的微生物种类多,影响因素繁多,环境条件也变化多端,存在许多不定的因素,且不同微生物之间也会相互影响。因此,探寻最佳苹果保鲜效果是需要大量的试验数据和实践经验的,还需进一步深入研究。
