激素受体阳性/HER2阴性乳腺癌新辅助内分泌治疗与新辅助化疗的疗效比较
2021-08-10郑涛,王耕
郑 涛, 王 耕
激素受体阳性/HER2阴性(hormone receptor positive/HER2-negative,HR+/HER2-)乳腺癌是乳腺癌中的常见类型。在当前的诊疗手段中,内分泌治疗是HR+患者乳腺癌综合治疗中的基石。在辅助治疗中,化疗联合内分泌治疗优于单纯内分泌治疗,但HR+高表达患者辅助化疗临床获益并不明显,且耐受性低于内分泌治疗,亟需探寻新的治疗方式以提高肿瘤缓解率。St Gallen专家共识认为相比新辅助化疗,绝经后HR+/HER2-低复发风险患者更适宜行新辅助内分泌治疗[1]。但对于新辅助内分泌治疗仍存在诸多争议,其预后及敏感性预测有待更多的循证医学证据支持。本文主要探讨HR+/HER2-乳腺癌新辅助内分泌治疗和新辅助化疗的疗效,为临床决策提供依据。
1 资料与方法
1.1一般资料 选取2018年7月至2020年7月我院收治的40例接受新辅助治疗并行手术的HR+/HER2-乳腺癌患者。纳入标准:(1)女性患者,经病理确诊为HR+/HER2-原发性乳腺癌;(2)行规范乳腺癌外科手术;(3)临床分期为Ⅱ或Ⅲ期;(4)无其他系统恶性肿瘤病史;(5)无其他自身免疫性系统疾病;(6)无乳腺及胸部放射史;(7)愿意接受新辅助治疗(内分泌治疗或化疗);(8)资料收集完整者。排除标准:(1)存在肿瘤远处转移;(2)有其他系统恶性肿瘤病史。按照治疗方式分为观察组(新辅助内分泌治疗)和对照组(新辅助化疗)各20例。两组年龄、绝经状态、病理类型以及临床分期等一般资料比较差异均无统计学意义(P>0.05),具有可比性。见表1。
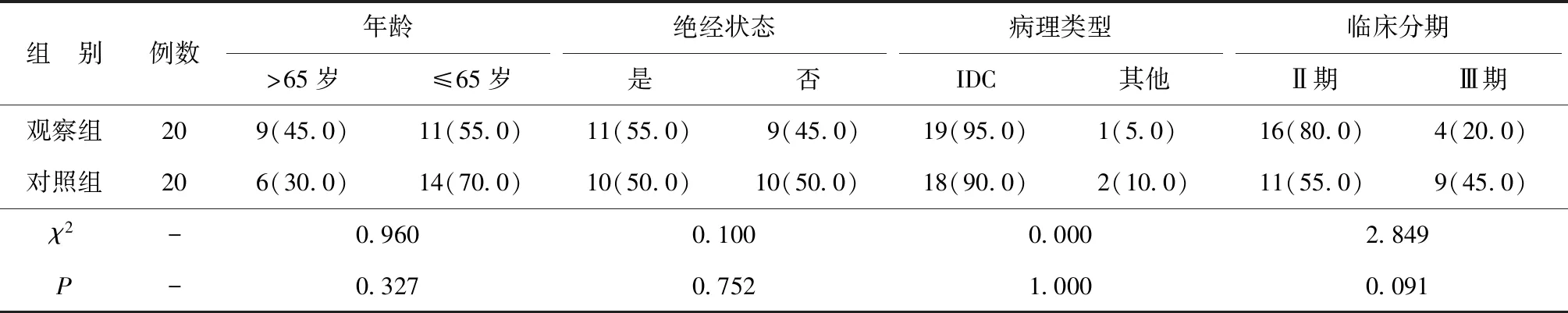
表1 两组一般资料比较[n(%)]
1.2治疗方法
1.2.1 观察组给予来曲唑(芙瑞,恒瑞医药,批号H19991001,2.5 mg,1次/d),或他莫昔芬(护佑,扬子江药业,批号H32021472,10 mg,2次/d)。绝经前患者推荐戈舍瑞林(诺雷得,阿斯利康制药,批号J20160052,10.8 mg,皮下注射,1次/28 d)卵巢药物去势。患者治疗28 d为1周期,共治疗4~6个周期。每4周行彩超检查评估疗效,无进展者持续服药至24周,限期行手术治疗。
1.2.2 对照组给予蒽环联合紫衫类药物化疗。表阿霉素+环磷酰胺序贯多西他赛(epirubicin+cyclophosphamide sequential docetaxel,EC-T)均按照标准剂量进行。化疗每2周期评估疗效,有效继续治疗,无效改为手术或其他治疗措施,8周期后进行手术。
1.3观察指标评价 (1)临床疗效评价:每2周期均以乳腺及腋窝淋巴结彩超为依据,参考WHO实体瘤疗效标准进行评价。客观缓解率(objective remission rate,ORR)=完全缓解(complete remission,CR)+部分缓解(partial remission,PR)/n×100%。(2)病理学指标评价:新辅助治疗前经乳腺病灶巴德粗针穿刺活检后行免疫组化检测,手术后乳腺标本行免疫组化检测。术后雌激素受体(estrogen receptor,ER)评分参考Allred评分(参考1998)。术后ER+定义为Allred评分≥3。术前内分泌预后指数(preoperative endocrine prognostic index,PEPI)评分中0分为低风险,1~3分为中等风险,≥4分为高风险。定义术前免疫组化Ki-67≥30%为高表达,<30%为低表达。治疗后降低幅度≥50%定义为明显下降,<50%为轻度下降。(3)肿瘤标志物评价:在患者新辅助治疗前后检测血清糖类抗原153(carbohydrate antigen 153,CA153),清晨空腹采取静脉血3 ml,4 ℃,3 000 r/min离心5 min,取血清通过免疫发光法检测。(4)毒副反应评价:采用美国国家癌症研究所不良事件通用术语标准(National Cancer Institute Common Terminology Criteria for Adverse Events,NCI-CTCAE)评价。
2 结果
2.1两组临床疗效比较 两组ORR比较差异无统计学意义(P>0.05)。见表2。

表2 两组临床疗效比较[n(%)]
2.2两组治疗前后Ki-67表达情况比较 两组治疗前后Ki-67表达情况差异无统计学意义(P>0.05)。两组Ki-67变化幅度差异有统计学意义(P<0.05)。见表3。

表3 两组治疗前后Ki-67表达情况比较[n(%)]
2.3两组治疗前后血清CA153含量变化比较 新辅助治疗后两组患者血清CA153含量均较治疗前明显下降(P<0.05),且观察组较对照组下降更为明显(P<0.05)。见表4。

表4 两组治疗前后血清CA153含量变化比较
2.4两组治疗后PEPI评分比较 观察组治疗后PEPI评分高风险率低于对照组,差异有统计学意义(P<0.05)。见表5。
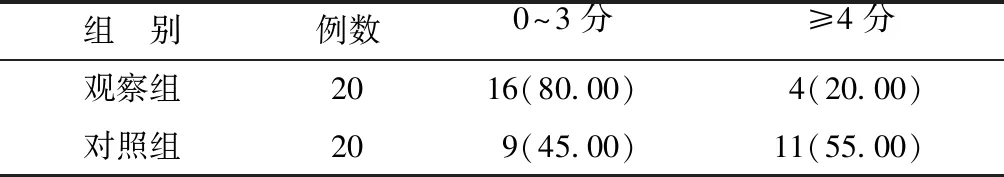
表5 两组治疗后PEPI评分比较[n(%)]
2.5两组毒副反应发生率比较 观察组毒副反应发生率低于对照组,差异有统计学意义(P<0.05)。见表6。

表6 两组毒副反应发生率比较[n(%)]
3 讨论
3.1本研究显示,新辅助内分泌治疗与新辅助化疗疗效相似。2007年一项Ⅱ期随机临床试验入组了239例HR阳性的绝经患者,118例行4周期多柔比星+紫杉醇方案新辅助化疗,其余接受依西美坦或阿那曲唑新辅助内分泌治疗3个月。结果显示,两组的临床疗效、超声检查、MRI及病理CR均无明显差异,而新辅助内分泌治疗组保乳手术的比例高于新辅助化疗组,但差异无统计学意义[2]。2016年的一项荟萃分析[3]也得出类似的结论。2017年一项回顾性研究也显示新辅助化疗和新辅助内分泌治疗ER+/HER2-乳腺癌患者有相似的PR和生存率[4]。最近一项HR+/HER2-及淋巴结阳性的前瞻性随机对照研究显示,在肿瘤退缩方面新辅助化疗优于新辅助内分泌治疗[5],与本研究结果相似。Ki-67影响细胞周期和DNA的合成,反映肿瘤细胞增殖情况,也与乳腺癌的发展及预后相关[6-7]。研究表明新辅助化疗后Ki-67水平可作为评价疗效的标志物[8]。GEICAM/2006-03研究中将95例HR+/HER2-乳腺癌患者随机分为新辅助化疗组和新辅助内分泌治疗组,亚组分析显示,Ki-67>10%患者可从新辅助化疗中获益[9]。对于Luminal B型乳腺癌Ki-67的变化值可作为无病生存率的独立预测因子,而新辅助治疗前后的Ki-67表达水平并不能单独作为乳腺癌的预后指标[10]。本研究也显示,两组在治疗前后Ki-67表达情况均无明显差异(P>0.05),观察组Ki-67明显下降率高于对照组(P<0.05)。最新一项随机对照研究[5]显示,新辅助化疗和内分泌治疗的Ki-67下降幅度差异无统计学意义(P>0.05),且疗效与Ki-67表达高低无关(P>0.05),但此研究是以Ki-67为20%作为临界值,本研究中以30%作为Ki-67表达高低界限,治疗后以下降50%作为明显下降分界值。不同的文献报道中,Ki-67的临界值从10%~50%不等,这有待进一步深入研究,形成统一标准。肿瘤不同发展阶段血清肿瘤标志物会发生不同变化。因此,监测肿瘤患者血清肿瘤标志物水平可用于判断肿瘤状态,是临床诊断、疗效评估与预后预测的重要参考指标[11-12]。血清CA153常在乳腺癌中过度表达,是乳腺癌的重要标志物。杨翼鹏等[13]研究显示,CA153在新辅助内分泌治疗前后变化明显,尤其在获得临床缓解的亚组里,提示肿瘤标志物变化幅度和趋势与临床疗效相关,这与之前多数研究结论一致[14-15]。本研究也显示,两组治疗前后血清CA153含量变化均有显著差异(P<0.05),可以预测新辅助治疗疗效和疾病进展。但不足之处在于本研究仅纳入了一种血清肿瘤标志物,敏感性稍低。一项Meta分析研究表明,与单独检测CA153比较,联合检测CA153、CA125和癌胚抗原对乳腺癌诊断效能更高[16]。
3.2本研究发现,新辅助内分泌治疗较新辅助化疗肿瘤预后无明显差异,安全性更好。P024试验[17]的多因素分析结果显示,复发及死亡的独立预后因素包括肿瘤大小、淋巴结状态、HR水平和Ki-67表达程度,研究者由此建立了PEPI。通过对其加权依据最终评分分为低、中、高风险组。PEPI评分在P024、IMPACT、POL等新辅助治疗临床研究中[17-19]得到了验证,在Z1031研究[20]中,PEPI 0分和非0分的生存分析显示,差异有统计学意义(P<0.05)。淋巴结阴性、PEPI评分为0分的患者(Ki-67低表达和HR高表达水平)无复发风险,无需进一步治疗。PEPI评分为4分或更高提示预后不良,表明治疗的反应较差,需要进一步化疗[17]。本研究发现两组治疗后PEPI评分≥4分高风险率差异有统计学意义(P<0.05)。一项Ⅱ期随机试验[2]显示新辅助内分泌治疗和新辅助化疗临床ORR相似,但新辅助化疗组不良反应较多,耐受性差。新辅助内分泌治疗的疗程建议为4~6个月[21],耐受性较好。本研究也显示,在新辅助治疗的安全性方面,观察组有6例(30.00%)发生明显毒副反应,而对照组95.00%的患者均有不同程度的化疗毒副反应。观察组中Ⅰ度毒性所占比例为20.00%,Ⅱ度毒性比例为10.00%,主要表现为潮热、关节肌肉痛等,没有Ⅲ度以上的毒副反应,临床均不需要进行特殊处理。对照组主要表现为血液骨髓抑制、胃肠道反应、脱发等,且出现Ⅲ~Ⅳ度毒副反应,需要对症处理。
3.3由于新辅助内分泌治疗后的病理CR率一般较低,一些临床试验也在不断探索新的疗效及预后评估方法。乳腺癌基因检测已被运用于新辅助治疗。TAILORx研究[22]告诉我们,HR+、HER2-、腋窝淋巴结无转移、21基因复发评分11~25分的患者中,单纯内分泌治疗非劣于化疗联合内分泌治疗。另外,残余癌症负担(residual cancer burden,RCB)指数、循环肿瘤细胞(circulating tumor cell,CTC)以及循环肿瘤DNA(circulating tumor DNA,ctDNA)等越来越多地应用于新辅助内分泌治疗的疗效评估和预测[23-26]。当然,我们期待出现更多的循证医学证据,为HR+/HER2-乳腺癌患者精准个体化治疗提供依据。
综上所述,本研究通过不同评估手段观察HR+/HER2-乳腺癌患者新辅助内分泌治疗与新辅助化疗的疗效,结果显示多种评估方法结论趋于一致,即新辅助内分泌治疗疗效不劣于新辅助化疗,安全性明显优于新辅助化疗,值得临床推广。
