CLCA1在结直肠癌中的表达及其基因集富集分析
2021-08-10罗世波吴江妮丘新泽梁志海刘诗权
罗世波, 吴江妮, 丘新泽, 梁志海, 刘诗权
结直肠癌(colorectal cancer,CRC)是常见的恶性肿瘤之一,CRC所致死亡约占肿瘤相关死亡的10%[1]。目前,我国的CRC发病率呈逐年增长的趋势[2]。尽管在诊断和治疗方面取得了进步,但在过去的20年中,CRC患者的存活率并未得到显著的改善,50%以上的患者在确诊时已发生区域性或远处转移[3]。钙激活的氯离子通道辅助蛋白1(calcium-activated chloride channel regulator 1,CLCA1)是钙激活的氯离子通道调节蛋白家族成员,其基因组序列由31 902个碱基对组成,具有15个外显子和14个内含子,位于1号染色体的短臂上(p22-31)[4],参与调节上皮细胞氯化物电流,并与黏液分泌过多相关呼吸道和胃肠道疾病的发生发展具有关联性[5]。CLCA1参与上皮细胞膜的氯离子传导,可影响上皮黏液产生、细胞信号转导、细胞黏附、细胞周期控制、凋亡以及肿瘤的发生和转移等[6]。有研究显示,人CLCA1主要在小肠和结肠黏膜中表达[4]。而针对CRC标本的研究表明,CLCA1表达水平与肿瘤分期呈负相关[7],但也有研究发现CLCA1高表达与CRC患者的不良预后有关[8]。由此可见,CLCA1在CRC中的作用机制尚未完全阐明。鉴此,本研究旨在探讨CLCA1在CRC中的表达情况及其与临床特征的关系,为CRC患者的诊断和预后预测提供理论依据。
1 材料与方法
1.1数据来源 通过肿瘤基因组图谱(the Cancer Genome Atlas,TCGA)数据库(https://tcga-data.nci.nih.gov/tcga)下载CRC样本CLCA1基因的表达数据及其匹配的临床信息。临床信息包括TNM分期、血管侵袭情况、肿瘤状态、生存资料等。排除临床信息不全的样本,最终共纳入370例CRC原发样本和51例癌旁组织样本进行分析。
1.2标本来源 选择2013年3月至2014年3月在广西医科大学第一附属医院接受手术治疗的CRC患者50例,均经影像及病理检查确诊。收集其肿瘤组织和癌旁组织(距离肿瘤边缘>10 cm)各50例。排除在手术前接受过化学疗法或放射疗法的患者,排除合并其他肿瘤或慢性疾病者,排除有吸毒史患者。
1.3方法
1.3.1 生物信息学分析方法[9]应用GSEA软件对获取自TCGA数据库的数据进行分析,将CLCA1基因表达水平的中位数作为截断值,分为高表达组和低表达组。通过基因集数据库(MsigDB数据库)的致癌基因集进行基因集富集分析,设置置换检验的次数为1 000次。有意义的基因集的筛选条件:错误发现率(false discovery rate,FDR)<25%,且P<0.05。
1.3.2 免疫组织化学染色方法 将收集到的临床标本进行石蜡包埋组织切片,厚度4~5 μm,提前4 ℃预冷,60 ℃烘箱烤片30 min,烘干后用二甲苯进行脱蜡,梯度洗脱脱水。滴加3% H2O2溶液至标本上,湿盒中室温静置15 min以消除内源性过氧化物酶活性。滴加山羊血清封闭液(北京中杉金桥生物公司),湿盒中室温静置15 min。滴加CLCA1一抗(工作浓度为1∶4 000;Abcam公司,英国),湿盒中4 ℃孵育过夜。复温,使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗3次,滴加生物素标记二抗(北京中杉金桥生物公司),湿盒中37 ℃孵育15 min。滴加辣根过氧化物酶标记的链霉素卵白素(北京中杉金桥生物公司),湿盒37 ℃孵育15 min;PBS浸洗3次,5 min/次。应用3,3-二氨基苯联胺(diaminobenzidine,DAB)显色剂和苏木素进行复染,最后滴加适量中性树胶封片,于显微镜下进行观察。
1.3.3 免疫组织化学染色结果判定[10]免疫组织化学染色结果由3名专业人员采用半定量法进行独立评判。以胞质中出现明显黄色或棕黄色颗粒判定为阳性。综合染色强度及阳性细胞数量进行半定量分析,根据阳性细胞染色强度(A):无明显着色为0分;细胞浆内出现淡黄色颗粒,明显高于背景为1分;出现较多棕黄色颗粒为2分;出现大量棕褐色颗粒为3分。每个组织随机观察5个高倍镜视野,计数500个细胞中染色阳性细胞所占比率(B):阳性细胞数<5%为0分;5%~25%为1分;26%~50%为2分;>50%为3分。A与B相加为最终得分,以0~2分判定为阴性(-),≥3分判定为阳性(+)。

2 结果
2.1免疫组织化学染色评分比较 CRC组织中CLCA1表达较癌旁组织明显降低,见图1。CRC组织的免疫组织化学染色评分为(2.46±1.09)分,低于癌旁组织的(5.65±0.49)分,差异有统计学意义(t=6.458,P=0.000)。

图1 免疫组织化学染色结果图(×200)
2.2CLCA1 mRNA表达水平与临床分期的关联性分析结果 癌旁组织的CLCA1 mRNA表达水平显著高于临床Ⅰ~Ⅱ期CRC组织和临床Ⅲ~Ⅳ期CRC组织(P<0.05),临床Ⅰ~Ⅱ期CRC组织的CLCA1 mRNA表达水平显著高于临床Ⅲ~Ⅳ期CRC组织(P<0.05)。见表1。

表1 CLCA1 mRNA表达水平与临床分期的关联性分析结果[M(P25,P75)]
2.3CLCA1高表达组与低表达组临床病理特征比较 CLCA1高表达组临床分期为Ⅰ~Ⅱ期、N分期为N0期以及M分期为M0期的人数比例显著大于CLCA1低表达组(P<0.05)。两组T分期比较差异无统计学意义(P>0.05)。见表2。

表2 CLCA1高表达组与低表达组临床病理特征比较(n)
2.4CLCA1表达水平与预后关联性分析结果 CLCA1高表达组的生存预后显著优于CLCA1低表达组,两组生存时间比较差异有统计学意义(log-rank检验:χ2=8.200,P=0.004)。见图2。

图2 CLCA1高表达组与CLCA1低表达组生存曲线图
2.5CLCA1基因表型富集分析结果 共纳入188个致癌基因的基因集进入分析,结果显示,有180个基因集在CLCA1高表达表型中富集,其中19个基因集在FDR<25%的条件下显著富集,21个基因集在P<0.05的条件下显著富集。FDR<25%且P<0.05条件下富集的基因集共有19个。见表3。有8个基因集在CLCA1低表达表型中富集,但是没有基因集显著富集在该表型中。

表3 19个CLCA1高表达表型中显著富集的基因集
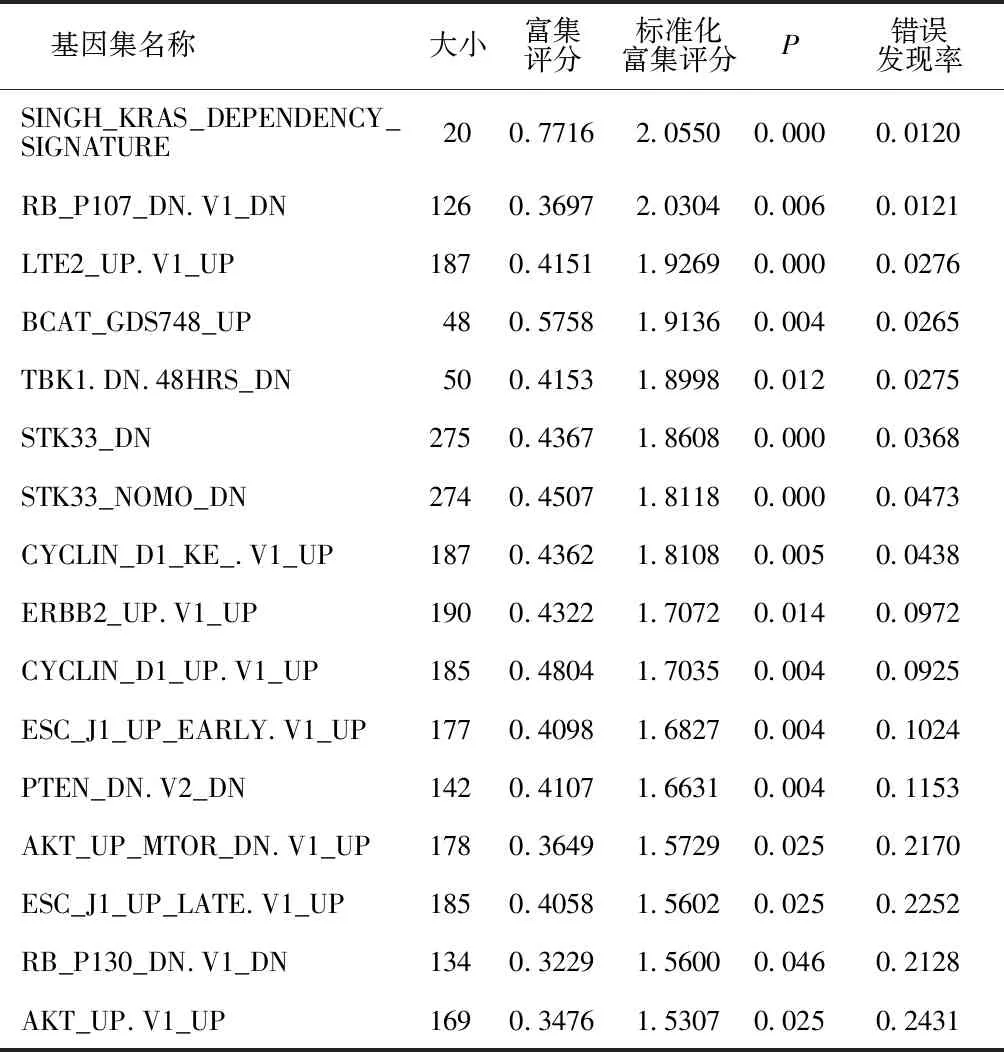
续表3
3 讨论
3.1尽管CRC的全人群发病率有所改善,但其在<50岁患者中的发病率却在不断上升。预估至2030年,年龄为20~34岁者的结肠癌和直肠癌发病率将分别增加90.0%和124.2%[11]。目前存在以手术治疗为主的各种治疗手段,但是CRC患者的5年生存率仍较低[12]。因此,探索新的生物标志物对于CRC的诊断、治疗、预后预测具有重要意义。CLCA1参与调节Ca2+激活的氯离子在上皮细胞上的转运、杯状细胞的黏蛋白表达、单核细胞和巨噬细胞的细胞因子和趋化因子表达、肿瘤细胞迁移和转移等过程[5]。氯通道,尤其是Ca2+激活的氯通道参与了细胞增殖、迁移和转移等活动,可作为治疗癌症新兴药物的作用靶点[13-15]。有研究显示,CLCA1与癌症进展密切相关[16]。离子通道与卵巢癌的发生、发展和耐药性均具有关联[17]。蛋白质组学研究结果显示,CLCA1在卵巢癌细胞系和肿瘤聚集形成细胞模型中表达增加,且敲降CLCA1表达可降低癌细胞形成多细胞聚集体的能力[18]。在肺癌研究中发现,β4整合素连接CLCA1激活下游粘着斑激酶(focal adhesion kinase,FAK)/细胞外信号调节激酶(extracellular-signal-regulated kinase,ERK)信号通路并与之形成复合物,促进肺癌细胞早期的血管内生长和转移性生长[19]。有研究提示,低水平的CLCA1与胰腺癌的不良预后显著相关,是胰腺癌无病生存期较差的独立因素[20-21]。因此,CLCA1在不同类型的癌症中的作用机制可能不同。本研究结果显示,CLCA1在CRC组织中表达下调,且与不良预后具有关联,这与相关研究结果相似[22-23]。
3.2本研究结果显示,与癌旁组织比较,CRC组织中CLCA1 mRNA表达水平显著降低,提示CLCA1可能是CRC的潜在标志物。另外,结果显示CLCA1水平与临床分期、N分期、M分期存在关联,但与T分期关联性不显著,提示CLCA1下调可能会促进CRC转移,但与肿瘤的浸润相关性不显著。以上结果提示,CLCA1可能是CRC的肿瘤抑制因子,但这与Chen等[8]的研究结论相反,这可能是由于样本量、患者特征差异所导致。研究认为,CLCA1通过抑制Wnt/β-catenin信号转导途径及上皮间质转化(epithelial-to-mesenchymal transition,EMT)过程抑制CRC侵袭[24],且CLCA1的转录与原癌基因c-myc的持续转录相关[20],而c-myc基因的产物参与调控细胞的增殖与凋亡[25]。本研究结果显示,CLCA1高表达表型中显著富集的基因集有19个,且不局限于Wnt/β-catenin信号通路。因此,CLCA1可能与其他原癌基因相互作用来调控肿瘤细胞的增殖与凋亡。
3.3本研究基因集富集分析结果显示,人类丝氨酸/苏氨酸激酶33(serine/threonine kinase 33,STK33)在CLCA1高表达表型中下调。STK33属于钙/钙调蛋白依赖性激酶家族,位于11p15.3号染色体上,此位点为与多种疾病(包括癌症)相关的基因富集区域[26]。STK33通过ERK2信号通路促进CRC的发生[26]。研究发现,STK33通过激活磷脂酰肌醇3激酶(phosphatidylinositol-3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路促进人胰腺神经内分泌肿瘤的生长和进展[27]。本研究结果显示,CLCA1高表达可下调CRC组织的STK33表达水平,说明CLCA1可能是通过抑制STK33介导的信号通路来抑制肿瘤的发生发展。值得注意的是,基因集富集分析结果显示,在CLCA1高表达情况下AKT表达呈上升状态。而在多种肿瘤中,PI3K/AKT/mTOR通路与癌症的发病机制相关,是肿瘤发生的促进因素[28]。分析认为CLCA1与AKT可能存在某种特殊的结合方式,从而改变了AKT的功能[5]。
综上所述,CLCA1与CRC的发生、发展具有显著关联,其有望成为CRC诊断、治疗和预后预测的标志物。但CLCA1与其他基因共同影响CRC的恶性生物行为的具体分子机制还有待于进一步验证,还需要深入研究它们之间的结合位点及亚型。
