附睾结构及其功能研究进展
2021-08-10朱文倩张学明
朱文倩,张学明
(吉林大学 动物医学学院 动物胚胎工程吉林省重点实验室,吉林 长春 130062)
精原细胞在睾丸中通过有丝分裂、减数分裂和变态发育成为分化完全的精子后并未完全成熟,需经直精小管、睾丸网、输出小管进入附睾管,循附睾头、体、尾移行,与附睾管腔的微环境相互作用,进一步发生形态结构的变化,获得运动能力、透明带固着能力、精卵识别和结合能力,完成成熟过程并静息储存于附睾尾[1]。
1 附睾的结构
1.1 输出小管和附睾管附睾起源于胚胎中肾管(沃尔夫管)的形成,直至分化为迂曲的管腔[2],主要由输出小管、附睾管和管间结缔组织构成,附着于睾丸的上端和后缘,可分为头、体和尾3个区段[3],在小鼠、大鼠等种属,附睾头部近端还有起始段。其中,头部和体部分别调控早期和晚期的精子成熟,而尾部主要是成熟精子的储存部位[4-5]。附睾管黏膜上皮为假复层纤毛柱状上皮,一般包含主细胞、基细胞、亮细胞、顶细胞(狭窄细胞)等亚型细胞[6]。主细胞是附睾上皮中主要的细胞类型,占上皮细胞数量比例的80%左右,存在于附睾的各个区段,胞质中含有丰富的细胞器和分泌囊泡[7],有活跃的内吞作用,参与管腔大部分蛋白的合成与分泌[4]。基细胞呈圆锥形,位于上皮的基底膜,大鼠基细胞通过形态改变可调节管腔的体积和管壁压力,表明其对附睾管腔结构具有保护作用[7]。亮细胞体积较大,分布于附睾各个区段,在人、大鼠等种属中均有发现,能吞噬精子碎屑,清洁管腔环境[7]。顶细胞数量很少;其顶部宽、体部窄,胞核位于顶部;细胞顶端腔面呈圆顶状,有短而少的微绒毛;胞质中含有许多大而不规则的线粒体,其他细胞器不发达。顶细胞和亮细胞的顶质区表达液泡质子泵ATP酶(V-ATPase)[6],可依赖分解ATP产生的能量作为动力,泵出质子H+参与维持管腔内的酸化环境[8]。此外,附睾上皮基膜外侧还包绕有平滑肌层,参与精子运输[9]。
1.2 血-附睾屏障血-附睾屏障(blood-epididymis barrier,BEB)是存在于附睾管内与管壁外结缔组织中毛细血管间可调节物质进出、提供精子成熟微环境、阻止管内自体免疫反应发生的结构(图1)[10]。其结构和功能包括形态结构(物理性)、生理功能(渗透性)和免疫屏障3个方面。
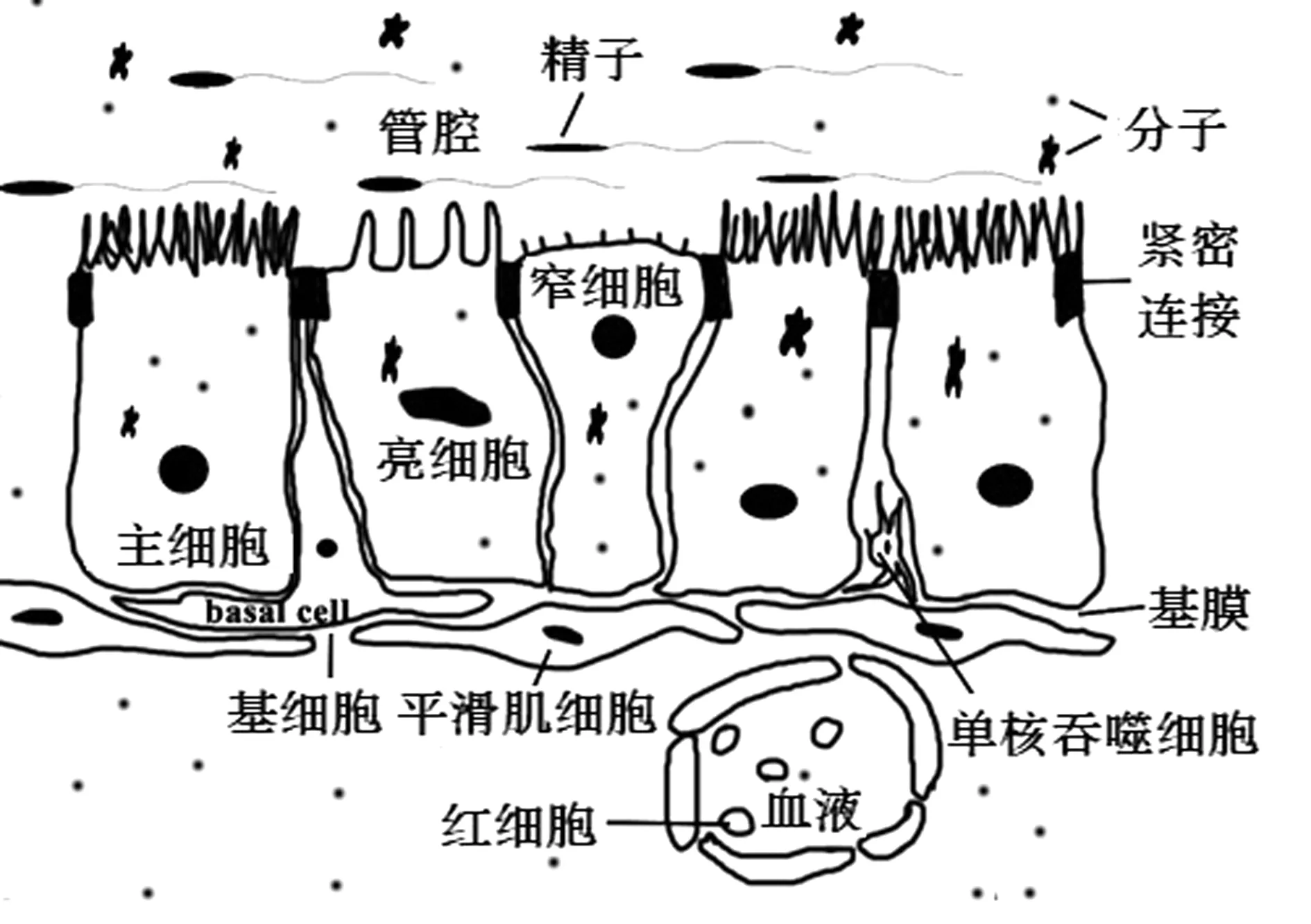
图1 附睾上皮结构模式图
BEB的组织学构成主要是附睾上皮及其细胞连接(特别是紧密连接tight junction,TJ)、基膜、平滑肌、毛细血管内皮及其基膜。电镜研究显示,附睾上皮间存在的网状TJ可有效阻止辣根过氧化物酶、镧等分子进入管腔;小鼠管外平滑肌半透膜则可阻止碳颗粒、镧等分子进入85%~90%的管腔内。附睾上皮游离面和基底面的转运蛋白调节分子进出管内,形成特定微环境。BEB渗透屏障的结构在精子成熟过程中呈动态变化,但上皮细胞间连接的完整性基本不变。BEB的免疫屏障功能主要是隔绝精子抗体、限制免疫球蛋白和免疫细胞进入管腔,从而保护精子免受自身免疫系统的攻击。正常条件下,单核吞噬细胞(mononuclear phagocytes,MPs)、CD4+T细胞、CD8+T细胞在附睾管外结缔组织中广泛存在,但管内未见存在;同样,管内也未检测到大部分的免疫球蛋白。即使管外发生炎症,管内微环境仍能保持一定稳定性。
2 附睾的功能
2.1 转运作用输出小管上皮由单层立方细胞和柱状纤毛细胞交替排列,纤毛细胞游离面有长纤毛伸入管腔,非纤毛细胞腔面凸向管腔,有微绒毛。这些特化结构的摆动参与精子的转运[11]。延时成像监测发现附睾头部和体部管壁呈规律性和阶段性收缩模式,调控精子在附睾管中转运的时间,确保精子结构和功能的完善[12]。大鼠附睾头部还存在5-羟色胺能系统,可作为神经递质介导附睾平滑肌的收缩活动,参与调节精子转运[13]。附睾精子的转运同样受旁分泌或内分泌因子的调控,催产素、去甲肾上腺素等可增强附睾平滑肌收缩[12],而cGMP信号则对附睾管平滑肌具有松弛作用[9];在附睾尾部,平滑肌层受节后交感神经纤维支配,促进附睾精子向输精管方向的转运[14]。上述研究表明,附睾内精子的转运受到特化纤毛和微绒毛摆动及平滑肌收缩的协同调控,形成从睾丸向附睾的液体流,推动精子的迁移[15]。
2.2 重吸收作用研究表明,约95%睾丸网内液体的重吸收主要是通过附睾头部输出小管的上皮细胞完成的[15]。蛋白质量浓度在附睾初始段约为4 g/L,而在附睾尾部可增至50~60 g/L[16],表明附睾存在可观的重吸收能力。水通道蛋白(aquaporins,AQPs)是一类同源性的内在膜蛋白,在细胞膜上形成特异性水转运孔道,驱动水和中性溶质分子的跨膜转运[17],维持机体水和电解质平衡。AQP1/9是输出小管和附睾管中最丰富的水通道蛋白,在附睾的分泌和重吸收过程中发挥重要作用[18]。AQP1在绝大部分哺乳动物包括人的输出小管、附睾起始段上皮细胞的顶质膜和附睾头部非纤毛细胞的微绒毛中均有分布[18-19],参与精子成熟过程中睾丸网液体的大量重吸收。AQP9在附睾各区段主细胞的顶部均有表达[19-20],但在附睾头部和尾部的表达较高。这表明附睾各区段重吸收能力存在差异,头部是附睾的主要重吸收部位,而尾部是成熟精子及液体浓缩、储存的部位[17]。因此AQP1/9的表达和调节与附睾的重吸收作用密切相关。
2.3 免疫作用附睾上皮的MPs包括树突状细胞和巨噬细胞等专职抗原呈递细胞[21],在起始段,CD11c+CX3CR1+上皮细胞的长突起可直接获得管腔中的抗原,参与附睾的免疫监视[22-23]。成年小鼠附睾单侧输出小管结扎后,引起附睾起始段上皮细胞迅速凋亡,原位检测发现附睾上皮中CD11c+CX3CR1+的MPs通过表型和形态的改变及时吞噬凋亡细胞和炎性碎屑,维持BEB的TJs结构的完整性[21]。应用家系全外显子组测序技术在梗阻性无精子症患者的附睾TJs编码基因CLDN2中发现了一种新的功能获得性错义变体,该突变位点与家系中显示的X连锁遗传模式相一致,皆因附睾上皮细胞间TJs被破坏,干扰了BEB的正常功能,引发附睾上皮炎症性碎屑脱落,造成机械性梗阻[24]。上述研究表明,附睾上皮细胞形态和功能的正常维持对BEB的免疫防御作用至关重要[22],附睾上皮结构改变或附睾管腔阻塞都有可能导致雄性不育。
2.4 修饰作用精子在睾丸中完成形态分化后进入附睾,穿行过程中被连续修饰,包括精子胞浆小滴(cytoplasmic droplet,CD)的移行、精子胞浆和顶体形态变化、精子核染色质的浓缩、精子质膜表面蛋白构象的改变等[25-26]。
2.4.1精子形态变化 CD是精子进入附睾前经支持细胞吞噬胞质后的残余体[27],与精子渗透调节和运动有关。由于精子中缺少渗透调节的细胞器,位于中段的CD参与调控水和渗透物质的运输,介导调节性容积减小或增大的过程[28],成为精子渗透调节的主要场所[29]。研究发现,来源于附睾头部的精子,CD位于精子头-颈连接中段的近端;而在附睾尾部或输精管获得的精子,CD位于精子鞭毛中段的末端,表明精子在附睾内移行的过程中,CD逐渐从精子颈部向尾部转运;且精子CD的缺失或异位可引起精子活力降低或形态改变,导致雄性不育[30]。因此,该结构在精子运动、超激活运动和顶体反应等过程中发挥重要作用,可能成为研究雄性避孕的理想药物靶标。
2.4.2精子表面蛋白变化 附睾小体是附睾上皮细胞以顶浆分泌方式产生的纳米膜状囊泡[5],通过转运精子成熟和受精所需的蛋白促进精子成熟。附睾小体能包裹多种附睾上皮区域性的分泌蛋白并将其转移至精子[25]。在分子水平上,附睾中精子生理功能的改变与磷酸化级联反应的激活相关,通过激活cAMP/PKA通路介导酪氨酸磷酸化的增加,与精子获能密切相关[31]。其中,cSrc是参与该过程的酪氨酸激酶,由附睾小体释放并递送至精子。另外,小泛素相关修饰蛋白(small ubiquitin-related modifier,SUMO)可与雄激素受体AR结合,参与细胞周期、分化和凋亡的调控[32]。消除AR的SUMO化引起附睾内117个基因差异表达,其中受雄激素调控的同源结构域转录因子Pem/Rhox5和丝氨酸肽酶抑制因子Spink2/5/11表达降低,导致附睾精子成熟障碍、精子活力降低和精卵结合能力受损[33]。这表明AR的SUMO化能特异性调节转录因子,维持正常附睾功能和精子成熟。
2.4.3附睾分泌蛋白与精子成熟 P34H是由附睾上皮细胞分泌并通过糖基磷脂酰肌醇锚定于精子顶体部位的膜蛋白,与仓鼠附睾蛋白P26H具有较高的同源性。P34H/P26H与附睾小体的筏膜结构域密切相关,介导精子与透明带的结合,是附睾精子成熟的标志之一,低水平的P34H与雄性不育有关。研究发现,仓鼠附睾头部精子中未检测到P26H,而附睾尾部精子则显著表达该分子,表明P34H/P26H是在附睾精子转运过程中转移至精子表面的[25]。
富含半胱氨酸分泌蛋白(cysteine rich secretory proteins,CRISP)中CRISP1/4是由附睾上皮合成分泌的雄激素依赖蛋白,参与附睾中精子成熟的转运过程和调控精子超活化运动等[34]。研究发现,CRISP1/4单敲小鼠可育,但双敲小鼠则表现为附睾多个区段的上皮细胞损伤,且管内pH显著升高,表明CRISP1/4的同源蛋白间存在补偿机制,参与调控附睾上皮细胞的分化,维持精子成熟和储存所需的管内pH酸化水平[34];CRISP1也参与调控Ca2+信号通路,在精子获得前向运动、精子超活化运动和精卵结合能力的过程中发挥重要作用[35]。
2.5 保护作用活性氧(reactive oxygen species,ROS)是细胞氧化还原代谢的副产物,适量ROS通过调节附睾中cAMP水平在精子成熟、获能和顶体反应等过程中起核心作用,过量ROS会引起精子质膜不饱和脂肪酸链过度氧化交联,损害精子功能,影响雄性生育力。牛磺酸是附睾液中主要的游离氨基酸,是重要的渗透调节器和抗氧化剂,对精子具有渗透调节、保持Ca2+动态平衡、防止脂质过氧化的作用[36]。半胱氨酸双加氧酶(cysteine dioxygenase,CDO)是合成牛磺酸的关键酶,CDO-/-小鼠的附睾液和精子中牛磺酸水平严重降低,精子因渗透调节能力的降低引起鞭毛形态改变,导致受精率降低[36]。此外,牛磺酸还通过提高过氧化酶的活性防止线粒体产生自由基引起精子的氧化应激。谷胱甘肽过氧化物酶5(glutathione peroxidase-5,GPX5)是在附睾中特异性表达的抗氧化酶,参与调节附睾微环境中的ROS浓度[37]。精子在附睾转运过程中,GPX5与精子膜结合保护精子免受脂质过氧化损伤,以维持精子DNA的完整性和稳定性,抑制附睾尾部精子顶体反应过早发生的同时,协调精核谷胱甘肽过氧化物酶-4(snGPx4)发挥稳定核染色质和维持其致密化的作用[38],并通过附睾小体泛素转移来帮助消除功能缺陷的精子[31],保证精子正常的发育、成熟[37]。
2.6 储存作用附睾的精子储存作用虽已习为人知,但有关人、灵长类和试验动物方面尚缺乏最新文献资料。与哺乳动物相比,爬行动物精子在附睾储存的时间更长,由于爬行动物特殊的生殖习性,使精子发生与排卵时间相互错位。这对于比较研究哺乳类包括男性附睾的精子储存作用可能有借鉴意义。研究发现,中华鳖附睾中的精子含有较多的胞质[39],且雌性输卵管中也观察到未成熟的精子,表明其附睾精子的成熟度较低,所以附睾在爬行动物中主要起储存精子作用。中华鳖的生精活动随季节变化,精子发生的各个阶段早在冬季来临之前完成[40],之后储存于附睾中直至次年繁殖季节[39-41]。中华鳖附睾外泌体由上皮纤毛细胞、腺体细胞通过顶浆分泌方式和多泡体释放至管腔,介导细胞间的通讯。其特异性标记物CD63在精子储存期间的表达显著高于繁殖期,表明附睾外泌体可能参与精子的储存过程[42]。此外,免疫调节也是影响精子在附睾储存的重要因素。Toll样受体(Toll-like receptors,TLRs)是一类重要的介导免疫反应的分子。研究发现,TLR2/4在中华鳖附睾各区段和精子中均有表达[43],TLR2/4在储存期和繁殖期精子中的分布位置差异不大,但TLR4在储存期和繁殖期附睾尾部的表达显著高于头部和体部,表明TLR2/4可能在维持附睾微环境和保护精子免受外源微生物感染方面发挥作用。
3 总结与展望
附睾及附睾精子成熟具有重要的研究价值,了解附睾的结构和功能,阐明精子成熟过程中的复杂机制,将为揭示附睾源性雄性不育疾病的遗传及发生机理奠定良好的理论基础,对实现雄性生育力的调节和精子受精率的提升具有指导意义。
