猪链球菌脑膜炎小鼠模型的构建及特征性炎性细胞因子的检测
2021-08-10孙莹莹刘洪涛雷连成
吴 桐,孙莹莹,刘洪涛,雷连成
(吉林大学 动物医学学院,吉林 长春130062)
猪链球菌(Streptococcussuis,SS)是猪体内主要的共生菌之一,属革兰阳性菌,健康猪可携带该病原。王娟等[1]对广州周边地区健康猪群猪链球菌的携带情况调查发现,SS的阳性率达到33.81%。但在特定情况下,SS可转为侵入病原,感染导致仔猪的脑膜炎、败血症、心内膜炎、关节炎和肺炎等[2-3]。猪链球菌病给世界养猪业带来了巨大的经济损失,据估计每年在美国可造成3亿美元的损失[4]。虽然猪是SS的主要宿主,但研究证实SS还能够感染其他的哺乳动物如牛等反刍动物,以及鸟类[5-6]。刘朋等[7]曾成功从表现化脓性肺炎及败血症病变的驴组织中,分离到SS血清2型株。此外,SS还是一种新兴的人兽共患病原菌,主要感染与受感染的猪或猪肉制品密切接触的特定职业人员[8],在养猪户、屠夫和屠宰场工人中经常引起脑膜炎并伴随听力降低的后遗症,或出现败血症及其他疾病[2,9]。1998年和2005年我国2次暴发人感染猪链球菌事件,共有230人感染,52人死亡。2007年猪链球菌病曾在东南亚国家肆虐,目前,已成为越南、泰国致成人脑膜炎的第一大和第二大病原体[10]。至今,SS已经在世界范围内造成了超过1 600例人感染病例[11]。SS是由多种不同分型构成的复杂群体,具有很强的异质性[12],根据其荚膜抗原的不同,分为35个血清型(1~34和1/2型),包含了700多种基因序列类型[4,13-14]。根据毒力的不同,这些不同血清型菌株被分为高致病性、低致病性(弱毒)及非致病性(无毒)株,一般认为,血清型2型SS(SS2)毒力最强,并且其临床分离率最高[4]。李石等[15]对3种辽宁省流行的SS主要血清型(1,2和7型) 菌株进行小鼠腹腔和脑内接种的致病性试验结果表明,SS2引起小鼠全部死亡,表现急性败血症以及严重脑膜炎,在三者中致病力最强。王治方等[16]通过对河南省不同规模猪场疑似SS病例进行分离,其中2型SS分离株占70%以上。
SS2引发脑膜炎的免疫学致病机制一直是防制该病的重要基础问题。长期以来,为了复制SS2感染的典型症状,常使用仔猪作为对象建立感染模型,在仔猪模型上研究发现,脑膜炎型感染与非脑膜炎型感染在临床症状、组织病变及细胞因子产生趋势等方面有所差异,脑膜炎型感染引起脑、肺组织病变严重,而非脑膜炎型感染病变则主要在肾脏、脾脏和肺脏[17]。但因仔猪体型较大,养殖成本高,且单独感染SS2不易成功[18,19],常需与其他病毒共感染以改善感染效果;另外,还存在病理特征差异大、免疫细胞标志抗体种类少、试验条件要求高等缺点,严重限制了对其机制的深入研究。近年来,以小鼠、豚鼠、兔等实验室常用实验动物为对象建立SS2感染模型的研究日益增多。小鼠感染SS2后,所有脑部区域以及脑膜均会发生病变[20],针对SS2抗原进行免疫组化分析显示,在病变部位均有阳性反应。此外,在体外试验中使用SS2刺激小鼠小胶质细胞,可引起炎性细胞因子表达的增强,进一步证实了上述现象[20-21]。这些研究说明,以小鼠为研究对象构建SS2感染模型,复制SS2感染的典型症状是具有可行性的。但是尚无比较脑膜炎型与非脑膜炎型SS2感染小鼠的感染特征并综合评价小鼠模型的报道。
本试验使用脑膜炎型和非脑膜炎型SS2感染ICR小鼠,从临床症状、免疫学指标、组织病理学变化、细菌定植部位等方面全面评价感染小鼠的感染特征,确证脑膜炎型和非脑膜炎型SS2小鼠感染模型的可行性,为体内免疫学机制的深入研究奠定基础。
1 材料与方法
1.1 动物ICR 小鼠,6~8 周龄,体质量20~22 g,雌性,购自辽宁长生生物科技有限公司。
1.2 菌株脑膜炎型SS2株CVCC606、非脑膜炎型SS2株CVCC607,购自中国兽医药品监察所;编号为 JMS、WC/1、202、203 及 1B5 的菌株由哈尔滨兽医研究所惠赠;编号为 90、92 及 95的菌株由南京农业大学惠赠。
1.3 主要试剂及试剂的配制琼脂糖、琼脂粉等购自北京鼎国生物试剂公司;胰酪胨大豆肉汤培养基(TSB)购自BD公司;小鼠IL-6、IL-8、TNF-α、IL-17和MPO ELISA试剂盒购自上海劲马科技有限公司。TSB 培养基:3% TSB粉末溶于ddH2O中,115℃,30 min高压灭菌,使用时加入5%胎牛血清。TSA培养基:4% TSA粉末溶于ddH2O中,115℃,30 min高压灭菌,使用时加入5%胎牛血清。无菌PBS缓冲液:NaCl 8.00 g, KCl 0.20 g, KH2PO40.27 g, Na2HPO4·12H2O 3.58 g,最后以ddH2O 1 000 mL溶解,使用5 mol/L NaOH溶液调节其pH值至7.2左右,121℃高压灭菌30 min,高压灭菌后4℃保存。10%多聚甲醛:称取多聚甲醛粉末40 g 溶于 ddH2O 400 mL,60~70℃条件下加热溶解,逐滴加入1 mol/L NaOH至溶液呈透明,冷却备用。2.5%戊二醛-多聚甲醛混合固定液:取10%多聚甲醛400 mL加入0.2 mol/L NaH2PO4-0.2 mol/L Na2HPO4混合液1 000 mL,再加入50%戊二醛溶液100 mL,最后定容至2 500 mL,保存备用。
1.4 SS2的培养与细菌计数按照本实验室常用SS2培养计数方式进行[17]。
1.5 SS2感染小鼠试验
1.5.1小鼠分组及感染 将 150只清洁级ICR小鼠均分为6组,每组25只。每组小鼠分别腹腔注射7×107CFU的不同SS2菌液,观察并记录临床症状,具体分组方法如表1。
表1 小鼠分组及处理(n=25)
1.5.2细菌分离与PCR鉴定 将新鲜采集的小鼠血液进行合理稀释并将稀释液涂布TSA平板,在37℃条件下培养过夜(16~18 h),待出现明显单菌落后,挑取单菌落涂布于载玻片,加热固定后利用革兰染色快速试剂盒进行染色,并观察细菌形态。挑取平板上的单菌落,接种于新鲜的TSB中,在37℃条件下,培养过夜(16~18 h),吸取1 mL新鲜菌液,12 000 r/min离心5 min收集细菌,后续使用无菌PBS缓冲液重悬菌体,提取分离菌的全基因组,进行SS2 16S rDNA PCR 鉴定。引物序列如表2,PCR扩增体系见表3。PCR扩增程序:95℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 60 s,共33个循环;72℃ 10 min。将PCR产物加入10×Loading Buffer混匀后,2.0%琼脂糖凝胶电泳鉴定16S rDNA扩增结果。

表2 SS2 16S rDNA PCR引物序列及产物长度

表3 SS2 16S rDNA PCR扩增体系
1.5.3血液指标的检测 表1中第1组与第2组小鼠分别于感染后0,1,3,7,14 d 进行眼球采血,每组每次采血5只,900 μL外周血混合100 μL质量浓度为18 g/L的EDTA-2Ka溶液抗凝处理后取100 μL 进行PBS稀释及细菌菌落计数;取500 μL剩余抗凝外周血进行血常规检测,利用 MEK-7 222K 全细胞分析仪(Nihon Kohden,Japan)对收集的血液进行血常规检测分析。第3组与第4组小鼠分别于感染后0,3,6,12,24 h进行眼球采血,每组每次采血5只,采得的外周血首先置于37℃培养箱 1 h,再斜面放置于4℃过夜,5 000 r/min离心3 min,取澄清上清即为血清,保存于-80℃条件下待用。将该血清样品利用小鼠IL-6、IL-8、TNF-α和 IL-17 ELISA试剂盒检测其中IL-6、IL-8、TNF-α和IL-17的含量,步骤依照劲马公司ELISA试剂盒使用说明书进行。第5组与第6组小鼠分别于感染后0,1,3,7,14 d 采集小鼠外周血,每次每组采血5只,如上处理后收集血清,利用小鼠IL-6 ELISA试剂盒检测血清中IL-6的含量,步骤同样按照劲马公司ELISA试剂盒使用说明书进行。
1.5.4脑、肾脏及肺脏组织相关指标的检测 表1中第1组与第2组小鼠分别于感染后1,3,7,14 d无菌剖取脑、肾脏及肺脏组织,每次每组采集5只。脑、肾脏组织加入无菌PBS研磨成匀浆,稀释后进行细菌菌落计数;其中,取感染后3 d小鼠的部分脑、肾脏及肺脏组织制作组织切片,进行HE染色,方法依照常规病理切片制作方法进行[17]。第5组与第6组小鼠分别于感染后0,1,3,7,14 d处死,并解剖取出脑、脾脏、肾脏组织,每次每组采集5只。分别称取100 mg的脑、肾组织,加入300 μL PBS研磨至匀浆样,离心取上清后待测。利用小鼠MPO ELISA试剂盒检测脑组织匀浆上清中的MPO含量,利用小鼠IL-6 ELISA试剂盒检测脑、肾脏组织上清中IL-6的含量,ELISA试验步骤严格按劲马公司ELISA试剂盒说明书进行。取小鼠左半脑及全脾脏,测其质量后,脑组织在高温烘箱中(≥80℃,≤100℃)烘干水分,约2 d后,水分去除完全再次测其质量,脑水含量=烘干前质量-烘干后质量。
1.6 统计学分析数据统计采用SPSS 19.0进行试验数据分析,单因素方差分析用于各处理组间的差异性分析(*P<0.05,差异显著; **P<0.01,差异极显著)。
2 结果
2.1 临床症状比较小鼠感染SS2后出现临床症状的时间较早。在感染早期(约6 h),各组小鼠即出现明显的感染表现。非脑膜炎感染组小鼠表现出精神沉郁,进食减少,被毛立起能见颈背部皮肤,相互聚集不活动等;于腹腔注射后20 h,小鼠眼睑被覆明显脓性分泌物,导致小鼠双眼睁开困难,此外无其他特征性症状。脑膜炎感染组小鼠除表现出以上精神沉郁,食欲不振等常见的感染症状外,于感染后24 h,在脑膜炎感染组中,观察到部分小鼠出现典型神经症状,如脖颈向上弯曲,头部频频颤动及间歇性转圈等症状,此时对有神经症状的小鼠进行解剖观察可见脑部有明显的充血,说明小鼠已患有脑膜炎,模型构建成功。整体临床症状上,两组小鼠感染后均出现明显感染症状,但脑膜炎感染组更加严重。
感染小鼠血液中均分离出SS2,通过PCR扩增16S rDNA对分离菌进行鉴定,结果显示均能扩增出预期的片段(图1),同时,将分离菌送至上海生工生物工程公司进行测序,结果表明其16S rDNA与SS2 16S rDNA相吻合。结合上述临床感染症状,说明SS2感染小鼠模型构建成功。
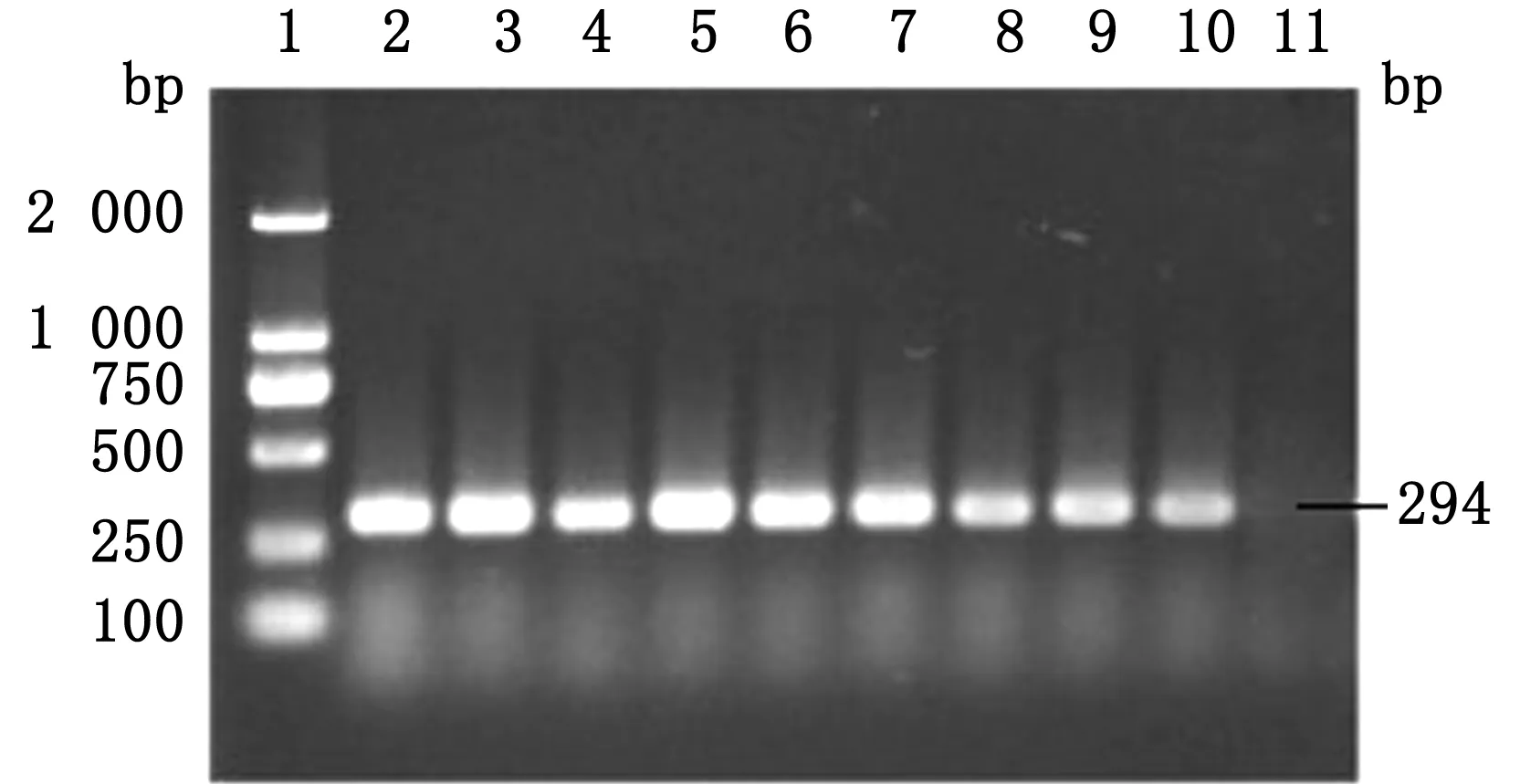
1.DL2000 DNA Marker;2~10.SS2 16S rDNA PCR产物;11.阴性对照
2.2 外周血血常规检测血常规检测小鼠感染SS2后血液中免疫细胞分布,结果发现,脑膜炎SS2(CVCC606)感染组小鼠的白细胞和中性粒细胞数量在感染后1 d均显著高于非脑膜炎型SS2(CVCC607)感染组,而在感染后7 d,这种差异发生了倒转(图2),推测在脑膜炎SS2感染组中,白细胞和中性粒细胞数在7 d下降的可能原因是由于细菌侵入脑组织,中性粒细胞随之向脑部迁移,大量聚集的中性粒细胞进而促进了脑膜炎的发生。

注:*P<0.05;**P<0.01。下同
2.3 脑组织MPO含量检测中性粒细胞在病原的刺激下发生聚集并释放MPO,因此MPO的活性反映了组织中中性粒细胞浸润的水平。本试验对小鼠在SS2感染后1,3,7,14 d的脑组织中MPO活性进行测定,结果显示,在感染后3 d,MPO活性在脑膜炎型SS2感染组中要显著高于非脑膜炎型SS2感染组(图3),这表明脑膜炎型SS2感染小鼠,引起了中性粒细胞大量募集到小鼠脑组织中,促进了脑组织炎症。

图3 SS2感染对小鼠脑部MPO活性的影响
2.4 细菌定植分析在感染后的不同时间点,分别采取各组小鼠外周血,同时无菌解剖小鼠取出脑组织及肾脏,将血液及脑、肾组织匀浆合理稀释后涂板统计单菌落数,计算血液及组织中定植的细菌数目(图4)。从结果可见,血液中的最高定植量出现在感染后3 d,之后逐渐下降。且脑膜炎型SS2感染组与非脑膜炎型SS2感染组在外周血中的载菌量无明显差异(P>0.05)(图4A)。在脑组织中,相较于非脑膜炎型SS2感染,脑膜炎型SS2感染的定植量更高且差异显著(图4B),而在肾脏组织中,得到了相反的趋势,非脑膜炎型SS2感染组定植量显著大于脑膜炎型SS2感染组(图4C)。以上结果表明,SS2定植部位取决于感染菌株类型的不同,脑膜炎型SS2主要定植于脑部,而非脑膜炎型SS2则主要在肾脏。

图4 SS2在血液(A)、脑(B)、肾脏(C)中的定植量
2.5 组织病理学观察根据眼观病理变化,脑膜炎型SS2感染组肾脏、肺脏组织发生炎症变化,有明显的充血表现,而非脑膜炎型SS2感染组的组织病理变化显著严重于脑膜炎型SS2感染组(图5)。且在感染后3 d,感染CVCC607小鼠脾脏增重极显著高于感染CVCC606小鼠(图6A),而感染CVCC606小鼠脑水含量显著高于感染CVCC607小鼠(图6B)。对病理切片进行HE染色并进行病理组织学观察发现,SS2感染的病理变化主要出现在脑、肺脏和肾脏组织,脑膜炎型SS2感染引起脑部出现胶质细胞结节(图7B)、肺脏组织炎性细胞浸润及淤血(图7E)和肾脏组织淤血(图7H)。而非脑膜炎型SS2感染的肺部、肾部的病理变化程度更加严重,然而在脑部未观察到明显的病理性病变。以上结果表明脑膜炎型与非脑膜炎型SS2感染导致的病变部位有所不同,脑膜炎型感染主要表现在小鼠脑部,而非脑膜炎型感染主要表现在小鼠的脾脏、肾脏及肺脏中。
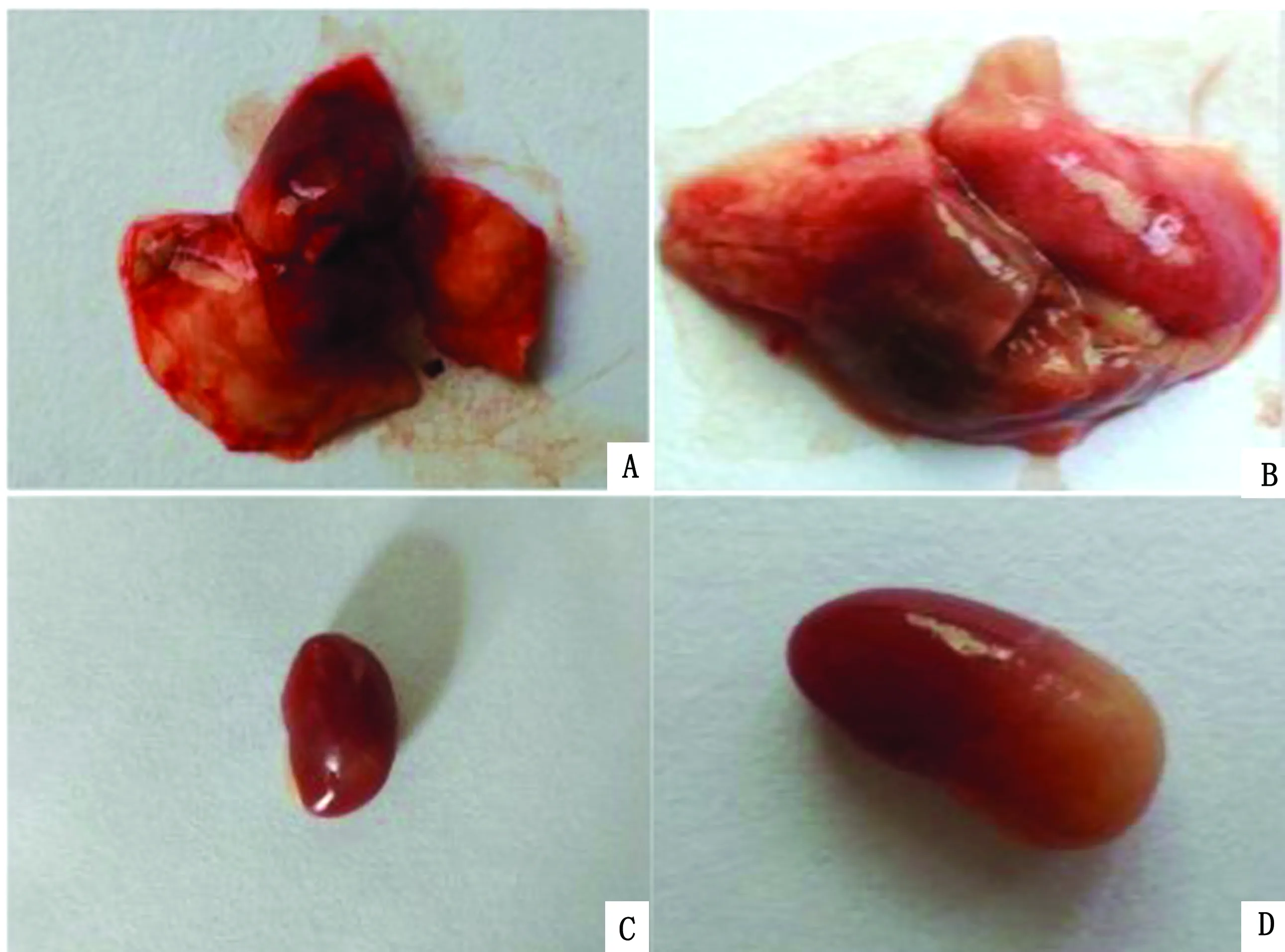
A.CVCC606 感染组的肺脏;B.CVCC607 感染组的肺脏;C.CVCC606 感染组的肾脏;D.CVCC607 感染组的肾脏

图6 小鼠脾脏增重(A)和脑水含量(B)检测结果

图7 小鼠脑、肺脏和肾脏组织病理学变化(HE染色,红色箭头指示病变部位)
2.6 外周血细胞因子的检测外周血中炎性细胞因子的水平是指示炎症水平的重要指标,在仔猪SS2感染模型中,炎性细胞因子在感染早期显著升高,且脑膜炎型SS2感染引起更高水平炎性细胞因子的产生。在预试验中,在小鼠SS2感染模型上也观察到了类似的趋势,除TNF-α外,其余3种细胞因子(IL-6、IL-8和IL-17)在脑膜炎型感染小鼠外周血中的含量显著高于非脑膜炎型,TNF-α在2种SS2菌株感染组中差异不显著(P>0.05)(图8)。

图8 血清中 TNF-α ELISA 检测结果
为了确保模型的普遍性,本研究进一步选取5株SS2脑膜炎分离菌株(分别为JMS、WC/1、202、203及CVCC606)和5株非脑膜炎分离菌株(分别为90、92、95、1B5及CVCC607)分别感染小鼠,对感染后不同时间点外周血中细胞因子水平进行ELISA检测,结果发现,两类SS2菌株感染后血液中IL-6、IL-8和IL-17的水平在感染后均明显升高,且两组之间存在明显差异(图9)。IL-6在脑膜炎分离菌株感染组外周血中,显著高于非脑膜炎分离菌株感染,且在感染后3,6,24 h差异极显著,12 h 时差异显著(图9A);IL-8在脑膜炎分离菌株感染组外周血中水平显著高于非脑膜炎分离菌株感染组,在感染后12,24 h差异极显著,其他时间点差异不显著(图9B)。IL-17与之类似(图9C)。这些结果提示,炎性细胞因子的水平可作为区分脑膜炎型与非脑膜炎型SS2感染的早期诊断标志。

图9 血清中IL-6(A)、IL-8(B)、IL-17(C) ELISA 检测结果
2.7 IL-6在外周血、脑及肾脏组织中的分布在血清、脑及肾脏组织中,与PBS对照组相比,IL-6水平在SS2感染后极显著升高。脑膜炎型SS2感染组在感染后1 d血清中IL-6分泌水平显著高于非脑膜炎型SS2感染组,而在感染后7 d趋势相反(图10A);肾脏组织IL-6分泌水平与之类似(图10B);而脑组织在感染后3 d开始,IL-6的分泌水平均为脑膜炎型SS2感染组极显著高于非脑膜炎型SS2感染组(图10C)。综上推测,可能是由于中性粒细胞向脑中募集并提高了脑组织中IL-6的水平,或者细菌入脑的直接刺激引起了脑组织内上皮、内皮细胞等分泌的IL-6增加。

图10 血清(A)、肾脏(B)、脑(C)组织中细胞因子IL-6含量的检测结果
3 讨论
SS2的感染可以干扰宿主对免疫反应的正常管制,一旦SS2在宿主体内定居并有效传播,就会触发促炎症反应来对抗和杀死病原体,这种炎症反应必须精确调节,以防止对宿主造成伤害。多种SS2的组分可以促进宿主炎症的发生,引起以过度炎症反应为特征的感染性休克,导致宿主在感染后数小时内死亡[22]。SS2的细胞壁成分能够诱导脑微血管内皮细胞分泌IL-1、CXCL8和MCP-1[23],进而增大血脑屏障渗透性,并通过引发脑膜炎帮助SS2向大脑移动。体外试验证实,SS2可以引起血脑屏障(BBB)模型IFN-γ的显著高表达,诱导猪脑微血管内皮细胞自噬,破坏BBB的完整性,增强屏障的通透性,从而促进细菌的穿越[24]。由SS2感染引起的人严重疾病的发病机制可以分为两个阶段,在第一个阶段,血液中的SS2细胞壁成分经由模式识别受体,如TLR-2或/和CD14,与宿主的免疫系统互作;在第二个阶段,这些宿主-病原体的相互作用触发促炎细胞因子的暴发,导致中毒性休克的发生[25]。
在SS2感染的过程中,炎性因子IL-6、IL-8以及IL-17等,都发挥了重要的作用。在多种炎症相关疾病中观察到了IL-6的过量产生。IL-6能够通过激活基质金属蛋白酶9,介导对BBB与血脑脊液屏障(BCSFB)的破坏,这种作用导致屏障通透性升高,利于细菌和炎性细胞的侵入,促进了脑膜炎的发展。IL-8是重要的趋化因子,在多种细菌感染性疾病中表达量显著升高,它主要将中性粒细胞募集到感染和损伤部位,同时还可以募集淋巴细胞,已经证实IL-8在增加血管通透性方面发挥重要作用,这种作用可能会导致蛛网膜下腔炎症的发生。IL-17是连接T细胞激活与中性粒细胞动员、激活的关键细胞因子,IL-17可以介导病原体诱导的先天性免疫,促进炎症性疾病的发生,如银屑病和类风湿关节炎等。作为一种促炎细胞因子,IL-17可诱导间叶细胞和髓细胞释放某些趋化因子、细胞因子、基质金属蛋白酶和抗菌肽,这导致了先天免疫系统中中性粒细胞的扩增和积累,并在体内将先天免疫和适应性免疫联系起来。越来越多的证据也表明,IL-17以及产生IL-17的细胞参与了各种疾病的发病机制,如过敏、自身免疫性疾病等[26-27]。研究发现,在多发性硬化病变中检测到IL-17受体在BBB的内皮细胞上高表达,表明IL-17在体内和体外均参与了对BBB紧密连接的破坏[28]。IL-17与IL-6协同作用诱导星形胶质细胞表达IL-6,IL-6与IL-17之间又存在正反馈关系,反过来促进了IL-17的产生,导致炎症反应加剧[29]。在本研究中,我们通过检测小鼠血液中促炎细胞因子在SS2感染后的产生情况,发现脑膜炎型SS2感染后,这3种促炎因子的表达水平在24 h内显著升高,且显著高于非脑膜炎型SS2感染小鼠,提示炎症细胞因子的水平可作为区别脑膜炎型SS2感染和非脑膜炎型SS2感染的早期诊断标志。在脑膜炎型SS2感染的仔猪模型上,12~24 h其IL-6、IL-8和IL-17的分泌均显著高于非脑膜炎型SS2感染组,这种趋势持续到感染后3 d左右,而在感染后5 d,脑膜炎型感染仔猪血液中细胞因子的含量会显著降低,显著低于非脑膜炎型感染组。小鼠在SS2感染后的细胞因子变化趋势与仔猪基本符合,后续对小鼠体内IL-6水平的检测也证实了这一点。
在细菌性脑膜炎病程中,过高水平的促炎细胞因子和趋化因子与脑膜炎的发生相关, 已经证实IL-6、IL-8水平在脑膜炎患者脑脊液中显著升高[30-31]。在本试验中,我们通过对比不同类型SS2感染小鼠后的病理变化及细胞因子变化趋势,证实IL-6的表达与脑膜炎的进程相关,表明脑组织是脑膜炎型SS2感染的主要靶器官,而非脑膜炎型SS2感染则主要定植于脾、肾脏及肺脏组织,引起组织病变,这与在仔猪模型上观察到的基本相同。感染后24 h,部分脑膜炎型CVCC606株感染组小鼠出现抽搐、头颈向上弯曲及间歇性转圈运动的神经症状。脑膜炎在猪模型上的表现为抽搐、划水样神经症状;在豚鼠表现为抽搐及角弓反张[32-33];小鼠表现出与仔猪类似的神经症状,说明脑膜炎模型构建成功。而在非脑膜炎型CVCC607株感染组,未观察到明显的神经症状。小鼠体内SS2的定植时间也与仔猪模型具有十分相似的趋势,说明二者特异性免疫的效应时间可能类似。免疫细胞的分布也能够反映炎症的进程,通过对血液中免疫细胞数量进行分析发现,SS2感染造成了免疫细胞数快速升高,提示炎症反应的快速发展,且脑膜炎型SS2感染组免疫细胞数在7 d内均显著高于非脑膜炎型SS2感染组,这种趋势在感染后7 d发生倒转,提示脑膜炎型SS2感染导致脑膜炎的进程中,中性粒细胞向脑部发生聚集。这种细胞水平的变化在小鼠模型上要明显快于仔猪模型,仔猪模型往往在感染后2~3 d才开始体现出这种显著性差异水平。对IL-6及MPO的检测表明,相比于非脑膜炎型SS2感染,脑膜炎型SS2感染组脑组织中中性粒细胞发生大量浸润,同时,脑组织中IL-6与感染早期血液中的IL-6水平,也均显著高于非脑膜炎型SS2感染组,结合我们对小鼠体内SS2定植量的检测,发现二者存在着正相关性,这种相关性提示IL-6在一定程度上可反映脑膜炎型SS2感染的进程。
通过以上试验,提示ICR小鼠可以作为很好的仔猪替代模型动物,无论在组织病变类型、部位或者细胞因子的产生及变化趋势,以及白细胞、中性粒细胞动力学变化等方面都具有很高的相似性。甚至在某些方面,如感染后出现症状的时间,细胞因子变化的时间等方面,小鼠更加迅速且明显,优于仔猪模型,便于在试验过程中短期得出结果。但在其他一些方面,如对脑脊液的获得,临床症状如脑膜炎的典型程度等,仔猪仍然是较好的选择。已有研究中证实,经ICR小鼠消化道或皮肤创面感染SS2的效果优于腹腔注射,得到了更高的病死率[34],如果针对存活率进行检测,需要考虑到感染方式不同所带来的差异,因此本次试验中,采用了腹腔注射的感染方式。不同品系小鼠对SS2的敏感性也有所不同,本试验中采用ICR小鼠进行试验,表现出了与仔猪类似的病理变化,重复性较好,但有研究采用BALB/c小鼠构建感染模型发现SS2的致病力对小鼠和猪存在差异[35]。虽然有研究者认为小鼠不适合作为SS2感染的脑膜炎动物模型[36],但我们的结果表明,选取特定小鼠品系进行试验,可以在一定程度上代替猪作为模型进行研究。除小鼠外,豚鼠、斑马鱼等也已经证实可以作为SS2感染模型进行试验[32,37],这些实验动物作为猪的替代动物,各有优劣,需要根据实验动物的不同,采取相应的感染方式,并根据感染后的临床表现,制定适合的研究内容。
总之,在本研究中,我们通过一系列小鼠感染试验,首次证实了SS2感染引起的小鼠炎性细胞因子的表达受菌株类型影响,脑膜炎型SS2感染引起的炎性细胞因子水平显著高于非脑膜炎型SS2感染,包括IL-6、IL-8及IL-17;同时还发现,SS2感染后IL-6的水平升高与脑膜炎的发展呈正相关,通过检测IL-6的水平可以在一定程度上反映脑膜炎感染的进程,这为进一步研究猪链球菌性脑膜炎的诊断、致病性和免疫致病机理奠定基础。我们的结果还说明,ICR小鼠可以用于SS2引起的脑膜炎相关研究,是仔猪良好的替代模型动物,IL-6在小鼠外周血和脑组织中的表达具有一致性,可作为小鼠成功感染的评价指标。
