猪繁殖与呼吸障碍综合征病毒感染状态与抗体水平关联性分析
2021-08-10张子荣杨力伟王世银刘晓娜王忠山
张 伟,张子荣,杨力伟,王世银,刘晓娜,张 力,王忠山
(1.新疆农业职业技术学院,新疆 昌吉 831100;2.新疆生产建设兵团第六师五家渠市畜牧兽医工作站,新疆 五家渠 831300;3.新疆生产建设兵团畜牧兽医工作总站,新疆 乌鲁木齐 830063)
猪繁殖与呼吸障碍综合征(porcine reproductive and respiratory syndrome,PRRS)在我国俗称“蓝耳病”,临床上以母猪繁殖障碍与生长猪呼吸道疾病、生长迟缓以及死亡率增加为主要特征[1]。PRRSV包括基因1型(欧洲型)和基因2型(美洲型)2个基因型,我国目前检测到的流行毒株主要为基因2型[2-3]。猪繁殖与呼吸障碍综合征病毒(PRRSV)是一种突变能力很强的RNA病毒,这给该病的防控带来了巨大的挑战[4]。
我国于20世纪90年代中期暴发PRRS疫情。2007年我国将PRRS列入强制免疫计划。近年来,通过PRRSV疫苗的持续免疫以及猪场防疫意识、生物安全水平的不断提高,PRRS在我国的大规模流行得到了有效的控制。但由于PRRSV流行毒株复杂,而目前使用的PRRSV灭活苗和减毒活疫苗(MLV)产生的抗体对不同毒株的交叉保护效果不佳,免疫猪场PRRSV不定期活跃并表现临床症状的情况仍普遍存在[5-6],加之人们对PRRSV MLV毒株回复突变和毒力返强,以及疫苗毒株与猪群中流行的野毒重组产生新毒株的担忧[7],实际生产中对是否免疫PRRSV疫苗仍存在争论。另外,免疫猪群和自然感染猪群体内PRRSV抗体水平与猪群中PRRSV的感染状态具有怎样的关系,以及如何通过猪群PRRSV抗体水平的监测提前预判PRRSV的活跃状态,进而采取针对性的防控措施,生产中亦有不同的说法,这对我国PRRS的整体或者区域防控非常不利。
鉴于此,本研究在新疆北疆地区选择了PRRSV感染情况和防控策略不同的3个规模化猪场,对猪群中PRRSV感染和抗体消长情况进行了为期2年的监测,并结合猪群整体生产性能及病毒血症的发生比例分析了两者之间的关联性,旨在为实际生产中PRRSV的科学防控提供依据。
1 材料与方法
1.1 主要试剂PRRSV抗体ELISA检测试剂盒为IDEXX公司(美国)生产的PRRS X3抗体检测试剂盒;柱式RNA核酸提取试剂盒为AXYGEN公司产品;Taq DNA聚合酶,dNTP Mix,AMV反转录酶,RNase抑制剂,pMD18-T质粒均购自TaKaRa公司;琼脂糖凝胶回收试剂盒为OMEGA公司产品;感受态DH5α购自天根生化科技(北京)有限公司。
1.2 主要仪器酶标仪、洗板机及普通PCR仪均购自BIO-RAD公司;实时荧光定量PCR仪购自Roche公司;冷冻高速离心机购自Thermofisher公司。
1.3 猪场选择在新疆北疆地区选择3个规模化猪场,均采用单点式养殖模式,具有较为完备的生物安全体系。3个猪场PRRSV感染情况和防控策略如下:
A场免疫PRRSV MLV(TJM-F92株),各阶段猪群生产性能稳定,未表现PRRS临床症状。免疫程序:种猪每年普免3次,商品猪14日龄首免,1个月后加强免疫1次。
B场2018年前未免疫PRRSV疫苗,3.0%~5.0%的母猪流产或产死胎、木乃伊胎,保育阶段成活率80.0%~85.0%,主要表现为厌食、呼吸困难、精神沉郁、毛发粗乱等症状,最终逐渐消瘦死亡。自2018年4月起开始免疫PRRSV MLV(TJM-F92株),至2018年10月各阶段猪群生产性能逐渐稳定至较高水平,仅有个别猪表现PRRS临床症状。免疫程序:2018年种猪每年普免4次,商品猪7日龄首免,3周后加强免疫1次;2019年后调整为种猪每年普免3次,商品猪14日龄首免,1个月后加强免疫1次。
C场2018年前为PRRSV阴性场,2018年3月保育阶段首先暴发PRRS并很快波及母猪群,20.0%~30.0%的母猪流产,保育阶段猪表现典型的PRRS症状,成活率仅为65.0%~70.0%。猪场通过拌料结合肌注抗菌类药物控制细菌继发感染,同时加强饲养管理,落实严格的生物安全措施,使猪群完成自然感染,至2018年11月猪群生产性能基本恢复稳定,仅保育及育肥阶段偶有轻微的PRRS临床症状。
1.4 样品采集从2018年1月至2019年12月,上述3个猪场每隔3个月采集血样进行PRRSV抗体和抗原检测。血样通过前腔静脉采集,分离血清进行PRRSV抗体监测,采样方案为公猪全部采集,后备母猪、妊娠中期母猪和哺乳母猪按照群体数量的10.0%随机采样,哺乳仔猪(约10日龄)、保育猪(约40和60日龄)和生长育肥猪(约80日龄)每个单元每次随机采集50头份血样(表1)。抗体阳性血样混样(5个血样混合为1个样品)使用qRT-PCR检测PRRSV,以评估检测猪群表现病毒血症的情况。另外,每批抗体阳性血样按照S/P值为0.4~2.5,2.6~3.0以及>3.1共3个等级分别选择20份血样使用qRT-PCR检测PRRSV抗原以评估不同S/P值个体发生病毒血症的比例。
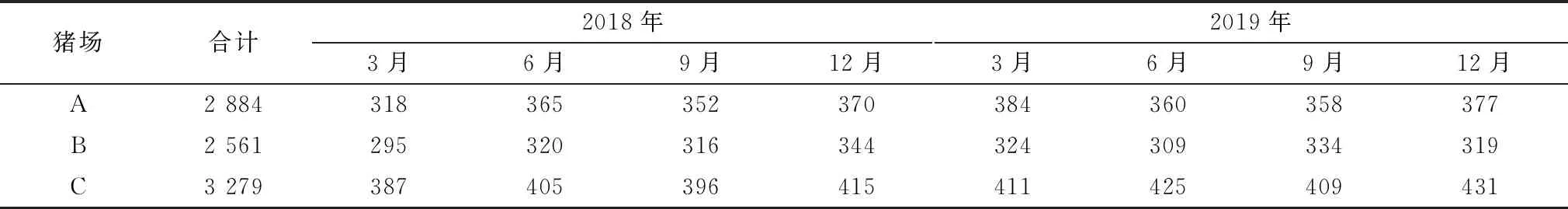
表1 调查猪场血样采集数量 份
1.5 PRRSV抗体及抗原检测参照IDEXX PRRSV X3 ELISA抗体检测试剂盒操作说明测定血清中PRRSV抗体并计算S/P值,结果判定标准:抗体S/P<0.4为阴性,S/P≥0.4为阳性。
血清中PRRSV抗原检测采用本实验室建立的PRRSV qRT-PCR检测体系完成。引物以PRRSV ORF5基因序列(NC_001961)为参考序列,使用Oligo 6.0软件设计,并由生工生物工程(上海)有限公司合成,qRT-PCR引物信息见表2。参照试剂盒说明提取血清中的病毒RNA,然后反转录为cDNA。qRT-PCR检测采用20.0 μL扩增体系:10×Buffer 2.0 μL,2.5 mmol/L dNTP Mix 2.0 μL,Taq DNA聚合酶0.2 μL,引物PRRSV-qP(10 μmol/L)各0.5 μL,探针(10 μmol/L)0.5 μL,cDNA 1.0 μL,ddH2O补足至20.0 μL。扩增程序:95℃预变性30 s;95℃ 10 s,60℃ 20 s,72℃ 20 s,40个循环。qRT-PCR反应在Roche LC96上完成。
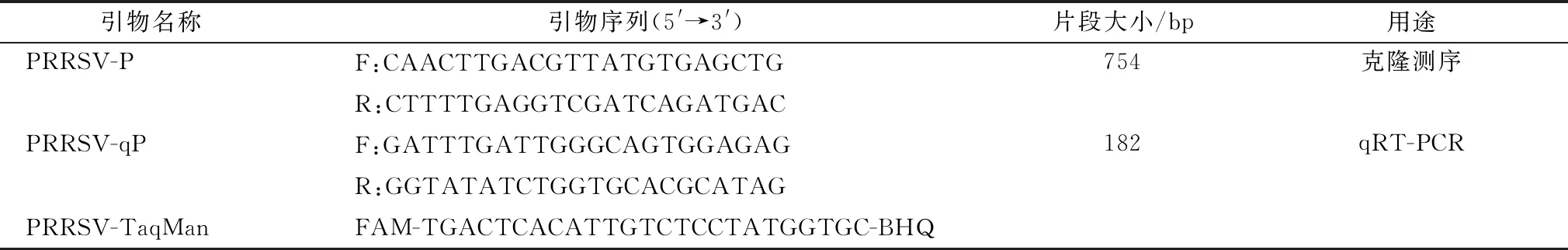
表2 PRRSV ORF5测序引物及qRT-PCR引物
1.6 PRRSV ORF5基因克隆及测序分别从B和C场随机选择2018年3月和2019年3月PRRSV抗原阳性血清中各10份进行PRRSV ORF5基因克隆测序,以确定其感染毒株。以病毒cDNA为模板,使用克隆引物PRRSV-P(表2)扩增PRRSV ORF5基因。采用50.0 μL扩增体系:10×Buffer 5 μL,2.5 mmol/L dNTP Mix 4.0 μL,Taq DNA聚合酶0.5 μL,引物PRRSV-P(10 μmol/L)各1.0 μL,cDNA 2.0 μL,ddH2O补足至50.0 μL。扩增程序:95℃预变性30 s;95℃ 10 s,58℃ 30 s,72℃ 1 min,共计40个循环;72℃延伸5 min。PCR产物切胶回收,连接T载体后转化感受态大肠杆菌DH5α,PCR鉴定阳性菌落送英潍捷基(上海)贸易有限公司进行双向测序。
1.7 PRRSV ORF5基因序列比对及遗传进化分析检索GenBank数据库,以国内PRRSV主要流行毒株ORF5基因序列作为参考序列(表3),使用DNAStar软件的Clustal W算法比对本研究获得ORF5基因序列和参考序列的同源性,以确定猪场感染的毒株,并使用Mega 6.0绘制进化树。
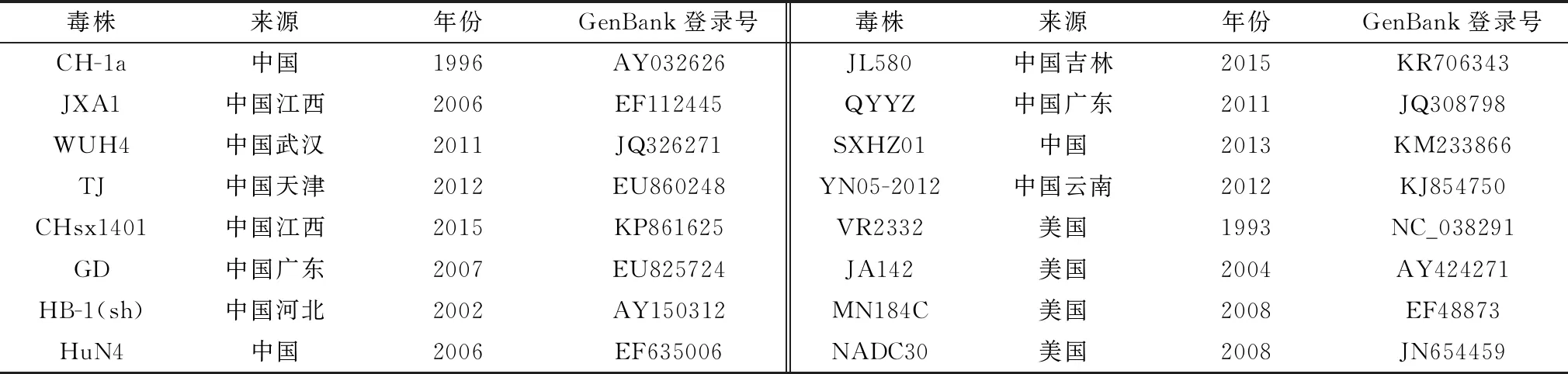
表3 序列比对参考毒株信息
2 结果
2.1 调查猪场PRRSV抗体检测结果从表4数据可以看出,A场通过持续免疫PRRSV MLV,猪群各个阶段PRRSV抗体检测数据均表现良好,在2年的监测期间,种公猪抗体阳性率100.0%,后备母猪、妊娠母猪和哺乳母猪抗体阳性率亦保持在95.0% 以上,且后备母猪2018年3月抗体离散度为42.0%以外,其他阶段均低于40.0%,种公猪群抗体离散度甚至可控制在20.0%左右,且全期未检测到抗体S/P≥2.5的样本,种猪群PRRSV抗体S/P值稳定在1.8~2.3。商品猪群在2次蓝耳疫苗免疫后抗体阳性率亦可达到85.0%以上,抗体离散度达到50.0%以下,抗体S/P值稳定在1.8~2.1。上述检测结果与该场猪群良好的健康状况及生产性能相一致。
从表5数据可以看出,B场在2018年4月份免疫PRRSV MLV前猪群PRRSV抗体各项指标均不理想,种猪群抗体阳性率为60.0%~78.0%,抗体离散度99.0%~115.0%,抗体S/P≥2.5的样本比例为10.0%~30.0%。商品猪群PRRSV抗体各项指标亦很差,80日龄仔猪阶段抗体S/P≥2.5的样本比例高达73.0%。上述检测数据与该场当时猪群生产性能低下,PRRS临床症状明显等实际情况相符。

表5 B场PRRSV抗体检测结果 %
2018年4月份免疫疫苗后至2018年6月份,猪群PRRSV抗体各项指标逐渐出现好转,至2018年12月份种猪群抗体阳性率90.0%以上,抗体离散度50.0%以下,抗体S/P≥2.5的样本比例低于5.0%,抗体S/P值平均值为0.9~1.2。商品猪群各项指标改善的相对较慢,至2019年3月基本达到较理想的水平,抗体离散度小于50%,抗体S/P≥2.5的样本比例低于5.0%,抗体S/P值平均值为0.8~1.1。在2018年10月份,猪群生产性能和PRRS临床症状已有明显改善,至2019年3月猪场各项生产指标均达到较高水平。
从表6的数据可以看出,C场自2018年3月份暴发PRRS后猪群抗体迅速转阳,阳性率高达90.0% 以上,至2018年6月种猪群抗体阳性率95.0% 以上,抗体S/P≥2.5的样本比例为8.0%~13.0%,抗体S/P值平均值为1.6~2.0,商品猪60日龄仔猪群中抗体S/P≥2.5的样本比例高达41.0%。这与该场同期母猪大量流产,仔猪死亡率高等临床表现相一致。至2018年12月份猪群基本完成了自然感染,PRRSV抗体各项指标得到根本改善,种猪群中抗体S/P≥2.5的样本比例控制在5.0% 以下,至2019年3月以后种猪群中再未检测到抗体S/P≥2.5的个体,猪群抗体S/P值稳定在1.2以下,且种猪群抗体在逐渐转阴,至2019年12月份种猪群PRRSV抗体阳性率已降至31.0%~41.0%,平均S/P值在0.4~0.8,种猪生产性能亦恢复正常。但该场保育后期PRRSV抗体又重新转阳,说明猪群又重新感染了PRRSV。

表6 C场PRRSV抗体检测结果 %
2.2 调查猪场PRRSV抗原检测结果从表7数据可以看出,A场检测期间所有血清样本中均未检出PRRSV抗原;B场种猪群2018年4次检测中分别在8.3%,5.1%,6.6%和2.1%的血清样本中检测到了PRRSV,但阳性率在逐步下降,至2019年除了6月份检测到0.5%的阳性样本以外,其余3次均未检测到PRRSV;商品猪群血清样本中PRRSV的检出率亦在持续降低,至2019年9月以后已全部转阴。C场种猪群2018年4次检测中,分别在11.5%,9.3%,4.3%和5.1%的血清样本中检测到了PRRSV,阳性率总体呈下降趋势,至2019年4次检测种猪群中再未检出阳性个体;商品猪群在2年的监测期中始终可以检测到PRRSV阳性样本,说明PRRSV仍在商品猪群中循环。
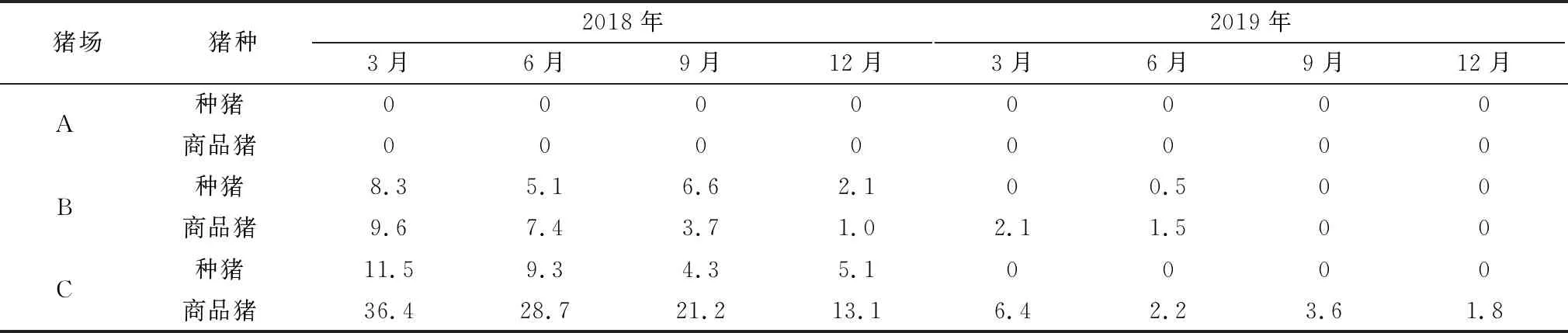
表7 调查猪场PRRSV抗原阳性率检测结果 %
2.3 调查猪场不同PRRSV 抗体S/P值阳性血清的抗原阳性率由表8数据可以看出,B和C场PRRSV抗体S/P值在0.4~2.5的血清样本,使用qRT-PCR均未检测到PRRSV抗原,提示抗体S/P值在此范围的猪未发生病毒血症;S/P值在2.6~3.0的血清样本,分别有15.0%和54.0%检测到PRRSV抗原,而S/P>3.1的血清样本,分别有78.0% 和100.0% 检测到PRRSV抗原,提示免疫猪群中S/P值异常高的个体表现病毒血症的比例亦迅速增高,而非免疫猪群中S/P>3.1的个体100.0%表现病毒血症。

表8 不同PRRSV 抗体S/P值阳性血清抗原阳性率
2.4 调查猪场PRRSV ORF5基因克隆及测序40份血清均通过PCR扩增获得大小为754 bp的条带(图1),扩增片段符合预期大小。PCR鉴定阳性菌落(图1)经测序及序列比对发现,B场20个样品PRRSV ORF5基因测序结果中分别有11和9条序列相同,分别命名为XJ-01和XJ-02;C场20个样品测序结果均相同,命名为XJ-03。以上结果说明B和C场分别有2和1个流行毒株,且在2年的检测期内猪场再未感染新的毒株。
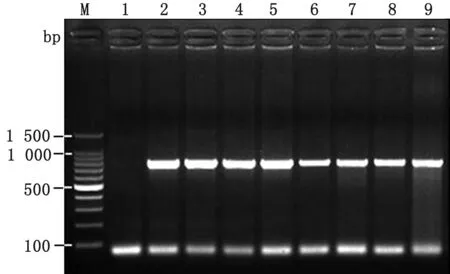
M.DL100 DNA Marker;1.阴性对照;2~5.部分血清PCR产物;6~9.部分菌落PCR产物
2.5 调查猪场PRRSV ORF5基因核苷酸序列同源性分析将XJ-01、XJ-02和XJ-03共3个毒株ORF5基因核苷酸序列与16个国内流行参考毒株进行序列比对,发现XJ-01、XJ-02和XJ-03毒株分别与JXA1、CH-1a和JXA1毒株ORF5基因序列的同源性最高,分别达到99.8%,99.7%,99.8%,XJ-01和XJ-03毒株与JXA1、TJ、WHH4、GD、HuN4和SXHZ01等毒株ORF5基因序列的同源性也高于99.0%。由于上述毒株均为HP-PRRSV毒株,说明B和C场均有HP-PRRSV毒株感染,同时B场还受PRRSV经典毒株的混合感染(图2,3)。

图2 调查猪场PRRSV流行毒株与国内主要毒株ORF5基因核苷酸序列同源性分析
3 讨论
3.1 猪群PRRSV抗体监测结果与猪群生产性能的关系目前包括IDEXX PRRS X3在内的PRRSV抗体ELISA检测试剂盒,检测到的是PRRSV N蛋白产生的抗体。但是由于N蛋白产生的抗体无中和病毒的作用[8],所以测得的PRRSV抗体水平与其保护力没有直接的对应关系,这给PRRSV抗体检测结果的分析带来了很大的困难。
鉴于以上原因,猪场需要结合本场猪群的生产性能、PRRS临床表现等,对PRRSV抗体检测结果进行针对性分析,才能对猪群PRRSV的稳定情况做出比较客观的评价。康桦华等[9]对9个种猪场的检测数据表明,具有较好生产成绩的猪场,其PRRSV抗体基准线的区间范围为抗体S/P值平均值为1.0~2.0,离散度为50.0%~70.0%,呈动态平稳变化。吴静波等[10]对粤北地区4个规模化猪场的研究结果表明,猪群生产性能良好的猪场PRRSV抗体阳性率总体应在70.0%~80.0%,抗体S/P值平均值为0.8~1.2,离散度在25.0%左右,S/P值≥2.5的猪只占猪群5.0%以下。本研究中,3个调查猪场PRRSV抗体各项指标亦与猪群生产性能有很好的对应关系。所以,对猪场PRRSV抗体检测结果进行评价时,除了重视抗体阳性率以外,抗体S/P值平均值、离散度是否处于合理的范围,以及S/P值≥2.5的样本数量的高低是需要重点关注的3个指标。

图3 调查猪场PRRSV流行毒株与国内主要毒株ORF5基因遗传进化树
另外,3个调查猪场同批次血清样本PRRSV抗原qRT-PCR的检测结果表明,血清样本PRRSV抗体S/P值与抗原阳性率高度相关,PRRSV抗体S/P值大于2.5的血清抗原阳性率将迅速升高。吴静波等[10]的检测结果亦表明,S/P值为0.4~2.5的猪群病毒血症的发生率为7.3%,其中在S/P值为0.8~1.2的猪群病毒血症的发生率为0,而73.3%的抗原阳性血清S/P值处于异常范围(<0.4或>2.5),与本研究结果基本一致。
通过C场的检测数据可以看出,采取自然感染或血清驯化的猪场,待猪群生产性能稳定后,PRRSV抗体阳性率、S/P值平均值、以及S/P值≥2.5的样本数量应逐步下降,若上述指标持续保持高水平或者某个阶段出现重新升高的情况,则说明存在PRRSV持续感染或者反复感染的情况。但是随着猪群中阴性个体数量的不断增加,猪场再次暴发PRRS的风险也会相应上升。周庆华等[11]调查的猪场PRRS暴发后通过血清驯化使猪群达到PRRSV阳性稳定,但该场在保持阳性稳定2年后又重新暴发了PRRS。
3.2 新疆PRRSV流行情况有关新疆PRRSV流行毒株的研究报道相对较少,赵洁雅等[12]从新疆某猪场分离到NADC30-like毒株,范士龙等[13]也从一个存在严重母猪繁殖障碍猪场中检测到了NADC30-like毒株,说明该毒株已在新疆逐步蔓延。本研究通过PRRSV ORF5基因测序证明B和C场存在PRRSV JXA1和CH-1a毒株的感染,未检测到NADC30-like毒株,但鉴于PRRSV是一种高度传染性病毒,各猪场仍应严格落实生物安全措施,避免PRRSV新毒株进入猪场。
