肺癌患者并发肌肉减少症的危险因素分析及其与临床预后的相关性探讨
2021-08-10李周华季爽胡先纬尤青海费广鹤
李周华,季爽,2,胡先纬,尤青海,费广鹤,2*
本研究价值:
在中国,肺癌发生率和死亡率均居所有癌症首位。肺癌患者常有包括焦虑、抑郁、肌肉减少症等严重的症状负担,严重影响患者的生命质量。因此,目前对于晚期肺癌患者,治疗目标除了提高患者的生存率,更主要的是减少患者的症状负担,维持机体功能和改善生命质量,从而改善患者的临床预后。肺癌患者常患有肌肉减少症,本研究肺癌患者中肌肉减少症的发生率为52.9%,高于一般健康人群,可以推测肌肉减少症的发生率在肺癌患者中较高,此外本研究证实了在肺癌患者中肌肉减少症的发生与不良的临床结局相关,因此在临床上应该着重关注肺癌患者的肌肉减少症发生情况,积极实施患者肌肉减少症的早期筛查和早期诊断,并实施必要的干预措施。另外本研究可以作为国内人群肌肉减少症诊断统计数据的补充,对亚洲人群肺癌并发肌肉减少症诊断标准的制定存在重要意义。
肺癌患者常并发营养代谢障碍性疾病,多数肺癌患者在疾病早期即会面临营养不良、骨骼肌减少甚至恶病质的风险[1]。相较于其他类型的肿瘤,肺癌患者骨骼肌减少的发生率较高,为46.8%~55.8%[2-3]。其中,疾病本身、治疗方式、年龄因素等均是引起骨骼肌减少的常见原因[4],骨骼肌的减少最终会导致肌肉减少症(sarcopenia)的发生。
亚洲老年肌肉减少症工作组(Asia Working Group on Sarcopenia in Older People,AWGSOP)将肌肉减少症定义为老年人骨骼肌质量、力量及功能下降的一种病症[5],且肌肉减少症与肺癌患者化疗毒副作用的增加、治疗效果下降及死亡率增加有关,据报道,肺癌并发肌肉减少症患者与普通肺癌患者相比死亡风险增加3倍,且与肿瘤分期无关,严重影响肺癌患者的临床预后[6]。另外肺癌患者常会出现生命质量下降及心理情绪变化等不适临床结局[7],且有报道指出抑郁与肌肉减少症存在关联[8],但对于肌肉减少症与生活质量及情绪变化研究较少。本研究旨在探讨肺癌患者并发肌肉减少症的危险因素及肌肉减少症的发生与肺癌患者营养风险、情绪状况和生命质量的关系,从而指导临床对相关危险因素积极干预,为整体改善患者临床预后提供方向。
1 对象与方法
1.1 研究对象 招募2019年12月—2020年7月在安徽医科大学第一附属医院呼吸与危重症医学科就诊的肺癌患者为研究对象。纳入标准:(1)年龄45~90岁;(2)于我科行内科保守治疗或首次经临床病理确诊Ⅲ~Ⅳ期肺癌的患者(病理诊断明确);(3)体力状况(performance status,PS)评分[9]<2分;(4)就诊期间完成了身体成分检测及步速、握力测试,同时完成相关的问卷调查。排除标准:(1)合并消耗性疾病或严重器官功能不全,如其他恶性肿瘤、消化道疾病等;(2)患有认知功能障碍、不能交流的患者,或有酒精/药物滥用史;(3)近期有手术、创伤史。患者检查前均签署知情同意书,表示自愿参加此项研究,并通过安徽医科大学伦理委员会(快-安医一附院伦审-P2020-12-33)批准。
1.2 收集临床资料 查阅患者病例,收集患者年龄、性别、受教育程度、吸烟情况、肿瘤病理类型、PS评分、患病时长、治疗情况、合并症情况、体质指数(body mass index,BMI)等资料。晨起采集患者空腹静脉血测量血红蛋白、乳酸脱氢酶、前白蛋白、白蛋白。长期吸烟史定义为吸烟≥10支/d,持续规律吸烟≥10年。采用Charlson合并症指数[10]评估受试者的合并症情况。BMI=体质量/身高2(kg/m2)。
1.3 肌肉减少症的诊断标准 根据AWGSOP制定的标准,以骨骼肌质量降低加上力量或活动能力降低判定为肌肉减少症[5],并据此将患者分为肌肉减少症组及无肌肉减少症组。
1.3.1 四肢肌肉量 采用韩国Biospace公司的InBody 720人体成分分析仪测定人体成分指标。患者在晨起空腹状态下脱去鞋袜,站立在分析仪平板上,双脚后跟及脚掌分别接触脚电极,上臂下垂,双手分别接触手电极进行检测,测量四肢肌肉量。骨骼肌质量指数(skeletal muscle mass index,SMI)= 四肢肌肉量 /身高2(kg/m2)。SMI:男性 <7.0 kg/m2,女性 <5.7 kg/m2定义为肌肉质量降低。
1.3.2 握力 采用握力计(CAMRY,型号EH101)检测两组握力,嘱研究对象身体直立,优势手持握力计,两脚分开,两臂下垂,以最大力紧握把柄,测试2次,取最大值。男性握力 <26 kg,女性握力 <18 kg 评定为肌力降低。
1.3.3 步速 采用秒表测量患者步速,患者以日常行走速度行走6 m,记录所用时间,步速<0.8 m/s评定为活动能力降低。
1.4 营养评估 采用营养风险筛查2002量表(Nutritional Risk Screening 2002,NRS2002)[11]评 估患者营养状况,内容包含疾病评分、年龄评分及营养情况评分3项,各项相加得总分(总分为1~5分),其中总分≥3分被认为存在营养不良风险。
1.5 临床预后相关指标 采用量表评估入组肺癌患者情绪状况、生命质量。
1.5.1 焦虑、抑郁筛查 使用医院焦虑抑郁量表(Hospital Anxiety and Depression Scale,HADS)[12]进行焦虑、抑郁情况评定。该量表分为两个子量表:焦虑量表和抑郁量表,各包含7个项目,用于评估过去1周的焦虑、抑郁症状。总得分和分量表得分越高,表明症状越严重;总得分>7分表明患者存在焦虑或抑郁。
1.5.2 生命质量评估 采用生命质量核心量表(Quality-of-Life Questionnaire-Core 30,QLQ-C30)[13]评估患者生命质量,该量表由30个项目构成,分别由躯体功能、情感功能、角色功能、社会功能、认知功能构成5个功能维度;疲倦、疼痛、恶心和呕吐构成3个症状维度;气促、失眠、食欲丧失、便秘、腹泻、经济困难构成6个单一症状条目;总健康状况构成最后1个整体生命质量维度。其中第1~28项可分为从没有、有点、较多至非常多4个等级,分别记为1~4分;最后2项分为7个等级,分别记为1~7分。各项维度原始分数经过线性转换为标准分数(0~100取值)为最终得分。功能维度和整体生命质量维度各部分得分越高,表明生命质量越高;而症状维度各部分得分越高,则表明生命质量越差。
1.6 统计学方法 采用SPSS 22.0软件进行统计学分析。计数资料以相对数表示,组间比较采用χ2检验;符合正态分布的计量资料以(±s)表示,组间比较采用独立样本t检验。采用单因素分析及二元Logistic回归分析肺癌并发肌肉减少症的独立危险因素,纳入Logistic回归分析的条件为P<0.15的因素及临床上认为与肌肉减少症相关的因素。相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 基本情况 本研究共87例肺癌患者符合纳排标准,其中男70例,女17例;年龄47~90岁,平均年龄(63.3±9.6)岁。87例入组患者中,肌肉减少症组46例(52.9%),无肌肉减少症组41例(47.1%)。肌肉减少症组患者年龄、长期吸烟比例、Charlson合并症指数、NRS2002评分、有营养不良风险比例高于无肌肉减少症组,BMI、四肢肌肉量、SMI低于无肌肉减少症组,差异均有统计学意义(P<0.05)。两组患者性别、受教育程度、肿瘤病理类型、PS评分、患病时长、有初始治疗比例、血红蛋白水平、乳酸脱氢酶水平、前白蛋白水平、白蛋白水平比较,差异均无统计学意义(P>0.05),见表1。
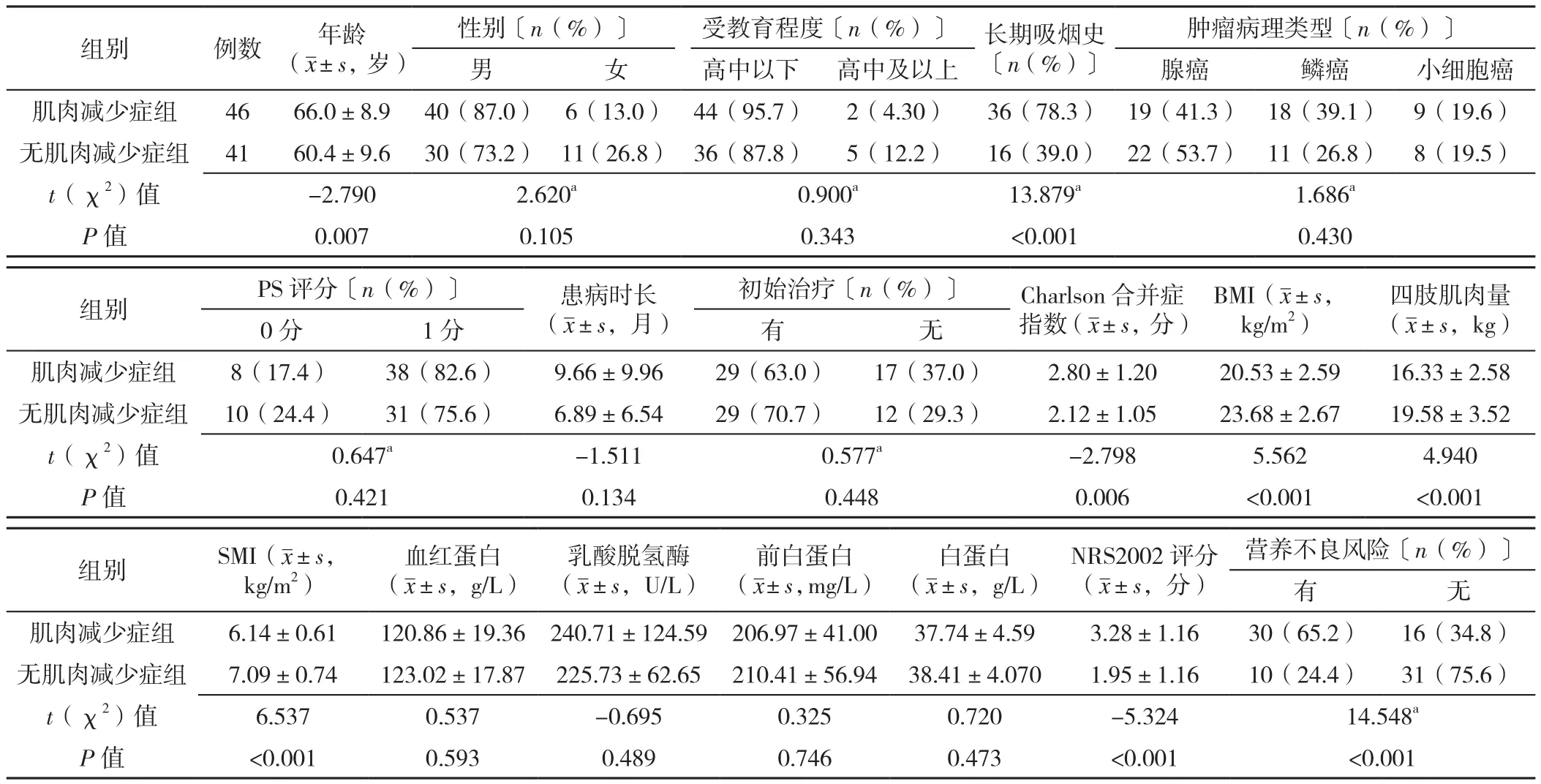
表1 两组肺癌患者的基本临床资料及营养不良风险比较Table 1 Comparison of clinical baseline data and malnutrition risk between two groups of lung cancer patients
2.2 肺癌并发肌肉减少症影响因素的二元Logistic回归分析 以有无并发肌肉减少症作为因变量(赋值:否=0,是=1),纳入与肌肉减少症相关指标年龄(赋值:实测值)、性别(赋值:男=0,女=1)、长期吸烟史(赋值:无=0,有=1)、患病时长(赋值:实测值)、初始治疗(赋值:无=0,有=1)、Charlson合并症指数(赋值:实测值)、BMI(赋值:实测值)、NRS2002评分(赋值:实测值)为自变量,进行二元Logistic回归分析,结果显示,长期吸烟史、患病时长、BMI、NRS2002评分是肺癌并发肌肉减少症的影响因素(P<0.05),见表2。
2.3 两组肺癌患者的心理状况比较 肌肉减少症患者焦虑量表得分、抑郁量表得分高于无肌肉减少症组,差异有统计学意义(P<0.05),见表3。
表3 两组肺癌患者心理状况比较(±s,分)Table 3 Comparison of the psychological status of the two groups of lung cancer patients
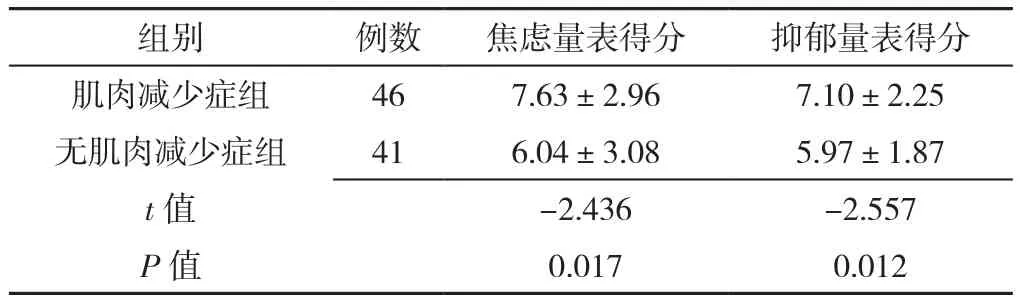
表3 两组肺癌患者心理状况比较(±s,分)Table 3 Comparison of the psychological status of the two groups of lung cancer patients
组别 例数 焦虑量表得分 抑郁量表得分肌肉减少症组 46 7.63±2.96 7.10±2.25无肌肉减少症组 41 6.04±3.08 5.97±1.87 t值 -2.436 -2.557 P值 0.017 0.012
2.4 两组肺癌患者QLQ-C30各维度得分比较 肌肉减少症组患者QLQ-C30总分,躯体功能、角色功能、情感功能、社会功能得分低于无肌肉减少症组,而疲倦、疼痛、气促及食欲丧失得分高于无肌肉减少症组,差异均有统计学意义(P<0.05)。两组患者认知功能、恶心和呕吐、失眠、腹泻、便秘及经济困难得分比较,差异均无统计学意义(P>0.05),见表4。
表4 两组肺癌患者QLQ-C30总分及各维度得分比较(±s,分)Table 4 Comparison of the total score of QLQ-C30 and scores of various dimensions between the two groups of lung cancer patients
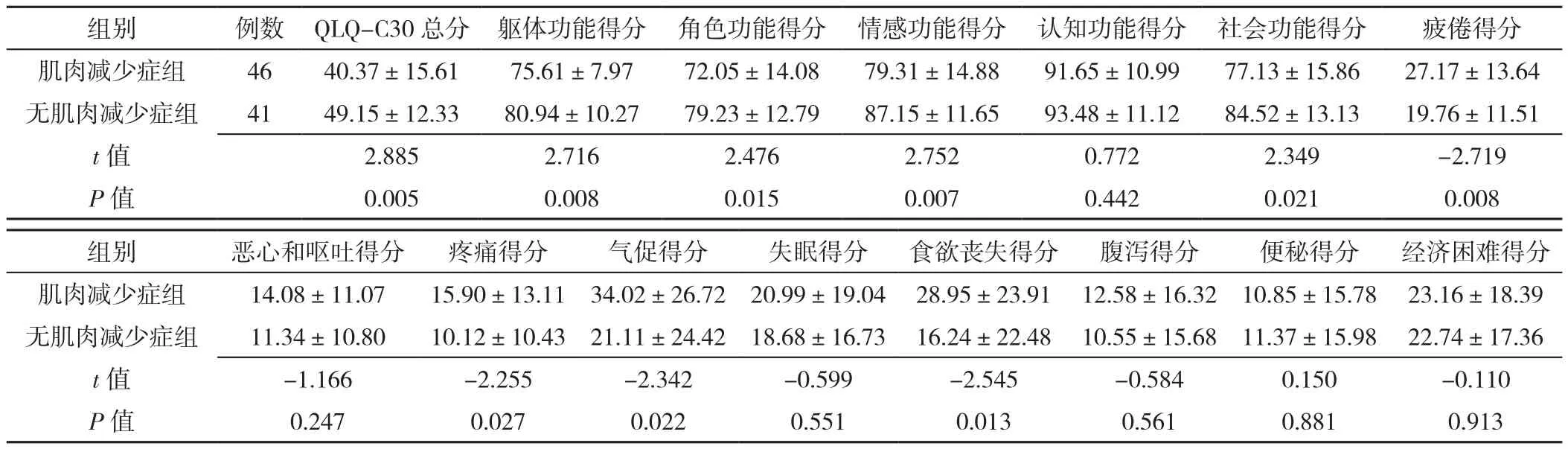
表4 两组肺癌患者QLQ-C30总分及各维度得分比较(±s,分)Table 4 Comparison of the total score of QLQ-C30 and scores of various dimensions between the two groups of lung cancer patients
组别 例数 QLQ-C30总分 躯体功能得分 角色功能得分 情感功能得分 认知功能得分 社会功能得分 疲倦得分肌肉减少症组 46 40.37±15.61 75.61±7.97 72.05±14.08 79.31±14.88 91.65±10.99 77.13±15.86 27.17±13.64无肌肉减少症组 41 49.15±12.33 80.94±10.27 79.23±12.79 87.15±11.65 93.48±11.12 84.52±13.13 19.76±11.51 t值 2.885 2.716 2.476 2.752 0.772 2.349 -2.719 P值 0.005 0.008 0.015 0.007 0.442 0.021 0.008组别 恶心和呕吐得分 疼痛得分 气促得分 失眠得分 食欲丧失得分 腹泻得分 便秘得分 经济困难得分肌肉减少症组 14.08±11.07 15.90±13.11 34.02±26.72 20.99±19.04 28.95±23.91 12.58±16.32 10.85±15.78 23.16±18.39无肌肉减少症组 11.34±10.80 10.12±10.43 21.11±24.42 18.68±16.73 16.24±22.48 10.55±15.68 11.37±15.98 22.74±17.36 t值 -1.166 -2.255 -2.342 -0.599 -2.545 -0.584 0.150 -0.110 P值 0.247 0.027 0.022 0.551 0.013 0.561 0.881 0.913
2.5 肺癌患者并发肌肉减少症与心理状况、生命质量相关性分析 肺癌患者并发肌肉减少症与焦虑量表得分、抑郁量表得分及疲倦、疼痛、气促、食欲丧失得分均呈正相关(P<0.05),与QLQ-C30总分及躯体功能、角色功能、情感功能、社会功能得分均呈负相关(P<0.05)。肺癌患者并发肌肉减少症与认知功能、恶心和呕吐、失眠、腹泻、便秘及经济困难得分无相关性(P>0.05),见表 5。

表5 肺癌患者并发肌肉减少症与心理状况、生命质量相关性分析(n=46)Table 5 Correlation analysis between sarcopenia,psychological status and quality of life
3 讨论
肌肉减少症由ROSENBERG[14]于1989年首次命名,被认为是随年龄增长出现骨骼肌含量减少及功能障碍的退行性病变。后来随着研究深入,发现除了年龄因素以外,活动、营养以及疾病(慢性疾病或恶性肿瘤)均可出现骨骼肌减少从而导致肌肉减少症的产生[15]。本研究中肺癌患者肌肉减少症的发生率为52.9%,与既往报道一致[2-3]。通过回归分析发现有长期吸烟史、病程较长、BMI小和有营养不良风险是肺癌患者并发肌肉减少症的独立危险因素。另外肌肉减少症的发生与肺癌患者较差的生命质量以及焦虑、抑郁症状等不良临床预后相关。
以往研究表明,吸烟可以导致肺癌患者发生肌肉减少症[3],也是肺癌发生、进展的主要危险因素。香烟成分可以通过氧化应激诱导骨骼肌蛋白降解,进而促进肌肉减少症的发生[16]。而在本研究中,患者的吸烟情况被进一步分成有无长期吸烟史后,研究发现长期吸烟是肺癌并发肌肉减少症的危险因素。强调早期戒烟,减少香烟摄入对于降低肺癌及肌肉减少症发生率具有重要意义。本研究发现随着肺癌患者病程的延长,肌肉减少症的发生率上升,既往相关研究也表明病程较长的患者易出现活动减少、长期久坐导致的肌肉失用性萎缩[17]。肺癌患者常会出现蛋白质-能量营养不良,潜在机制为蛋白质合成减少、降解增加、胰岛素抵抗、脂肪分解,从而导致身体成分的改变,突出表现为肌肉含量丢失、体质量下降,从而导致肌肉减少症的发生[18]。NRS2002广泛应用于癌症患者营养不良风险筛查,包含主观和客观因素。本研究肺癌患者有营养不良风险40例(45.9%),而肌肉减少症患者营养不良发生率是无肌肉减少症患者的3倍。随着NRS2002评分增加,肺癌患者并发肌肉减少症的风险也随之增加。早期发现患者营养不良,及时予以营养支持治疗,可以降低甚至逆转肌肉减少症的发生[19]。即使是无营养不良风险的肺癌患者,也有34.8%的患者并发肌肉减少症,鉴于肌肉减少症与肺癌患者不良预后和临床结局有关,对于无营养不良风险的患者也需警惕肌肉减少症的发生。低BMI是肌肉减少症发病的危险因素已经得到广泛认可[20]。但在本研究中,尚未发现传统营养评价指标白蛋白、前白蛋白在两组间存在差异,一方面这些血清蛋白水平不会随着营养摄入的变化而变化,另一方面还受到疾病急缓、炎性水平的影响,因此并不能作为反映营养状态的可靠指标[21]。此外有研究报道,治疗情况(化疗)会导致骨骼肌减少[22],但本研究未发现两组患者中初始治疗情况对肺癌患者肌肉减少症的发生率产生影响,可能是因为并非所有化疗方案均表现出骨骼肌减少依赖的毒性[23]。
在本研究中,肌肉减少症患者抑郁量表得分、焦虑量表得分均高于无肌肉减少症患者,表明肌肉减少症患者更易出现情绪障碍。国内针对社区老年人的一项研究表明,肌肉减少症与抑郁障碍存在正相关关系[24]。癌症患者抑郁症状与食欲丧失、活动能力降低之间的关系可能是肌肉减少症与抑郁之间的联系机制[25]。抑郁症可以影响患者的身体健康、心理健康、社会关系等[26-27],所以本研究中肌肉减少症患者躯体功能、角色功能、情感功能、社会功能各维度得分均低于无肌肉减少症组患者。通过两组肺癌患者QLQ-C30量表各维度得分结果分析,肌肉减少症患者QLQ-C30总分低于无肌肉减少症患者,表明肺癌并发肌肉减少症患者生命质量较差,这与多项相关报道一致[28-29]。据报道,与肌肉减少症相关的体能减退会降低患者的功能活动能力,从而对癌症患者生命质量产生不利的影响[30]。本研究中肌肉减少症患者疲倦维度得分高于无肌肉减少症患者,有研究表明疲劳与骨骼肌质量的丧失有关[31],也有文献报道在癌症引起的肌肉萎缩中,大鼠的抗疲劳能力有所下降[32]。此外,食欲丧失、疼痛、气促也是肺癌患者常见的疾病相关症状,本研究发现上述症状得分在肺癌并发肌肉减少症患者中更高,推测可能是由于疼痛、气促与患者活动能力降低有关。但本研究为横断面研究,研究样本例数有限,且采用问卷调查形式,可能会存在一定的信息偏倚。因此未来研究应增加样本量,进行前瞻性研究以明确治疗前后、治疗中肌肉减少症发病情况以及对生命质量和情绪变化的影响,纳入更多的相关因素,充分探讨肺癌并发肌肉减少症的危险因素。
综上所述,及早戒烟、适当运动,对肺癌患者定期进行营养评估,早期发现和纠正营养不良,有助于减少肺癌患者肌肉减少症的发生,此外本研究可为肺癌患者骨骼肌功能障碍发生机制的探索提供方向,为临床早期采取合理、有效的干预措施提供科学依据,为整体改善肺癌患者生命质量及心理状况等临床预后提供新思路。
作者贡献:李周华、费广鹤进行文章的构思与设计,研究的实施与可行性分析,统计学处理,结果的分析与解释;李周华、季爽、胡先纬、尤青海进行数据收集、整理;李周华撰写论文;李周华、季爽、费广鹤进行论文的修订;费广鹤负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
