基于16S rRNA高通量测序的野生和养殖多鳞白甲鱼肠道微生物群落组成研究
2021-08-10苟妮娜钟明智王开锋
苟妮娜,钟明智,王开锋
(1.陕西省动物研究所,陕西省秦岭珍稀濒危动物保育重点实验室,西安 710032;2.西北农林科技大学 动物科技学院,陕西杨凌 712100)
多鳞白甲鱼(Onychostomamacrolepis)又称多鳞铲颌鱼,是一种杂食性淡水经济鱼类,隶属鲤形目(Cypriniformes),鲤科(Cyprinidae),鲃亚科(Barbinae),白甲鱼属(Onychostoma)[1]。该鱼常见于秦巴山区、鄂西山地及鲁中南山地[2],因其味道鲜美、营养丰富而深受消费者喜爱[3]。近年来,受气候变化及水利工程影响,多鳞白甲鱼野生资源量呈下降趋势[4],被《中国脊椎动物红色名录》评估为VU(易危)等级[5]。因此,具有重要的种质资源保护价值及人工养殖开发前景。随着人工养殖技术的发展,多鳞白甲鱼养殖规模逐渐扩大,然而各种疾病也随之而来。抗生素类药物拌料投喂以及化学试剂溶液浸浴是目前普遍采用的治疗方法[6],然而药物疗法不但污染水质,而且威胁水产品健康。因此,如何提高鱼类自身免疫能力及抗病力成为近年来水产品健康养殖的研究热点。有研究表明,肠道微生物菌群参与鱼类营养[7]、免疫[8]和疾病爆发[9-10]等一系列生理过程。
动物的肠道由复杂的动态微生物生态系统组成,从营养、生理和病理学的角度来看,肠道微生物非常重要。肠道微生物菌群在宿主体内具有多种功能,通过促进营养供应、防止感染源寄居、能量稳态的维持和正常的粘膜免疫,它们对宿主的营养和健康的重要性在哺乳动物中已经得到很好证实[11-13]。鱼类的肠道微生物通常来自周围的水环境,土壤、沉积物以及饲料,这些微生物聚集在肠道中形成肠道微生物群落[14-18]。16S rRNA高通量测序技术打开了微生物研究的新思路,运用基因组学方法获得的微生物数据信息比传统的培养方法更加高效、准确。本研究通过宏基因组测序,探讨野生和养殖多鳞白甲鱼组成及其肠道微生物群落多样性,以期为多鳞白甲鱼的健康养殖提供参考。
1 材料与方法
1.1 采集样本
2019年4月,分别于黑河多鳞白甲鱼国家级水产种质资源保护区(33°58′38″N,108°08′54″E,陕西周至)和天源生态养殖公司(陕西镇坪)采集野生和人工养殖多鳞白甲鱼样品。野外采用电捕法,养殖场采用撒网法捕鱼。多鳞白甲鱼生物学信息见表1。

表1 样本生物学信息Table 1 Biological characteristics of samples
1.2 肠道内容物提取
分别将野生和养殖两组参试鱼(每组6尾,共12尾)在实验室无菌条件下进行解剖。采用 0.9%生理盐水冲洗鱼体表面后,再使用蒸馏水进行漂洗。解剖后,将鱼的肠道分离出来置于培养皿中,纵向剪开小肠,收集肠道内容物(3尾混合),采用5 mL冻存管保存并标记后,立即放入液氮中冷冻,随后置于-80 ℃ 超低温冰箱中,备用。养殖样品编号:养殖1(G-B-YANG),养殖2(G-F-YANG);野生样品编号:野生1(G-K-YE),野生2(G-I-YE)。
1.3 样品的预处理
分别称取0.25 g样品,放入2 mL的无菌离心管中,采用OMEGA公司的试剂盒(E.Z.N.ATM磁结合土壤DNA试剂盒)提取DNA。
1.4 PCR检测
利用Qubit 3.0 DNA检测试剂盒进行检测,样品DNA达到检测要求后,委托上海生工生物工程有限公司进行肠道微生物16S rRNA V3、V4区宏基因组分类测序。引物序列为:341F:5′-CCTACGGGNGGCWGCAG-3′, 805R:5′-GACTACHVGGGTATCT AATCC-3′。 PCR反应总体积为30 μL:Genomic DNA10~20 ng, Bar-PCR primer F(10 μmol/L) 1 μL,Primer R (10 μmol/L) 1 μL,2×Taqmaster Mix 15 μL,加入灭菌双蒸水至30 μL。热循环反应条件为:94 ℃ 变性3 min,94 ℃ 变性30 s,45 ℃ 退火20 s, 65 ℃ 延伸30 s, 5个循环; 94 ℃ 变性20 s, 55 ℃ 退火20 s,72 ℃ 延伸30 s,20个循环;72 ℃ 5 min。PCR结束后,PCR产物进行琼脂糖电泳纯化 回收。
1.5 统计分析
1.5.1 OUT分类分析 OTU (Operational Taxonomic Units) 指的是分类单元。先根据序列间的距离将全部样本进行聚类,再按照序列间的相似性将样本分成不同的 OUT。OTU的代表性序列为丰度最高的序列。
1.5.2 多样性指数分析 肠道微生物菌群的多样性和丰度情况可以通过几种常见的多样性指数进行评估,这些指标来源于生态学中评价环境微生物群落多样性的方法。
群落多样性指数:Shannon指数[19],微生物多样性指数之一,其数值越大,表明群落多样性越高。Simpson指数[20],与Shannon指数不同,Simpson指数数值越大,表明群落多样性越低。覆盖度,覆盖率越高,表明样本序列未被检测出的概率越低,说明测序结果能够反映样本的真实 情况。
群落丰度指数:ACE指数[21],用于估算微生物群落总OUT数,ACE 指数与微生物群落丰度呈正比。Chao1指数[22],与ACE 指数类似,同样用于估算群落微生物总OUT数。
1.5.3 物种分类学分析 对检测样本序列进行分类学分析,分别统计样本在门(Phylum)、属 (Genus)两个分类层级水平的微生物群落组成。
1.5.4 PCA分析(主成分分析) 主成分分析[23]是一种数据简化分析技术,在降低复杂数据维数的同时还保留数据中对方差贡献最大的特征。样本间距离越近,则表示这两个样本的组成越相似。
2 结果与分析
2.1 肠道微生物16S rRNA测序
测序后各样本信息统计数据见表2和表3。从表2可知,各样本质量控制后的序列平均长度在410~420 bp,表明样品满足高通量测序数据分析要求。通过Barcode对样品序列进行质量控制,去除非特异性扩增序列及嵌合体,因此,从表3能够发现,处理后各样本的序列数小于处理前的序列数。

表2 样本数据信息统计Table 2 Statistics data of samples sequencing

表3 去除嵌合体与靶区域外序列统计Table 3 Removal chimera and target out of sequence symbionts
2.2 肠道微生物OUT分布韦恩图
不同样品用不同颜色表示,图中数字代表特异或共有的OTU数。韦恩图构建所需样本数一般为2~5个。如图1所示,4个样品肠道微生物OTU总数为8 252,养殖多鳞白甲鱼肠道微生物的OUT数小于野生多鳞白甲鱼。养殖1(G-B-YANG)和养殖2(G-F-YANG)的OUT数相差较小,分别为1 443和1 331,而野生1(G-K-YE)和野生2(G-I-YE)的OUT数相差较大,分别为 3 938和1 933。
2.3 肠道微生物群落多样性指数分析
由表4可知,养殖1和养殖2的ACE和Chao1指数大于野生1和野生2,说明养殖多鳞白甲鱼肠道微生物的物种丰度大于野生多鳞白甲鱼。同时发现,野生2样品肠道微生物群落Shannon 指数最大,而Simpson指数最小,表明该样品生物多样性最高。如表4所示,全部样品的覆盖度指数范围在0.94~0.98,表明各样品序列几乎都被检测出来,没有被检测出的概率很小。说明本试验数据真实可靠,可以反映野生和养殖多鳞白甲鱼肠道微生物群落组成的多样性。
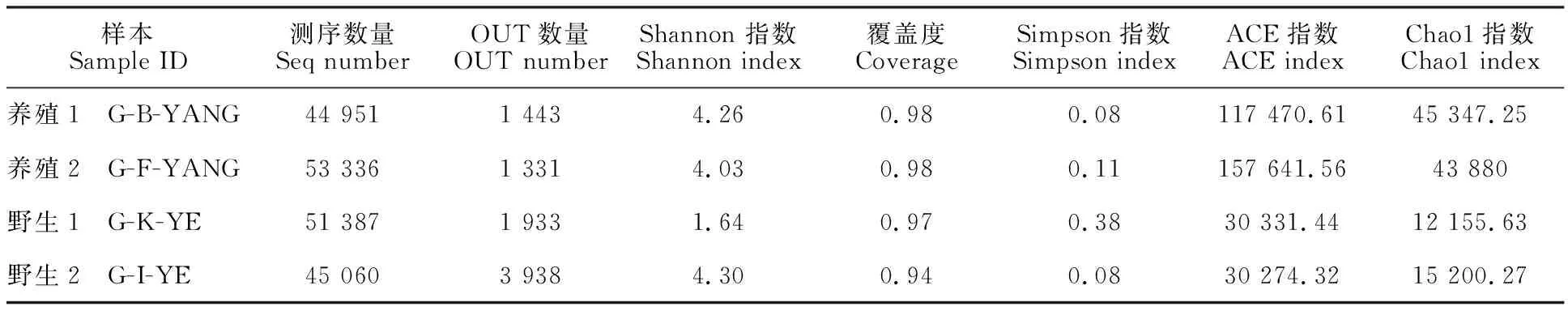
表4 样本Alpha多样性统计Table 4 Alpha indices of samples
随机抽取检测样本序列,将抽取的序列数与其代表的OUT数形成稀释曲线 (Rarefaction curve)(图2)。曲线呈上升趋势时,表明增加测序样本数还能继续产生新的OUT;而曲线趋于平坦时,则表明继续增加检测样本也不会产生更多新的OUT,说明被检测数据量较为合理。
2.4 肠道微生物群落物种分类
由表5可知,人工养殖的多鳞白甲鱼肠道菌群主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和广古菌门(Euryarchaeota)等菌门组成;野生多鳞白甲鱼肠道菌群主要由变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、软壁菌门(Tenericutes)和衣原体门(Chlamydiae)等4个门组成。而在属的分类水平上(表6),人工养殖多鳞白甲鱼肠道微生物中,优势菌群为甲基杆菌属(Methylobacterium)、埃希菌属/志贺菌属(Escherichia/Shigella)和乳杆菌属(Lactobacillus);野生多鳞白甲鱼肠道中优势菌群为鲸杆菌属(Cetobacterium)、支原体属(Mycoplasma)和嗜衣原体属(Chlamydophila)。
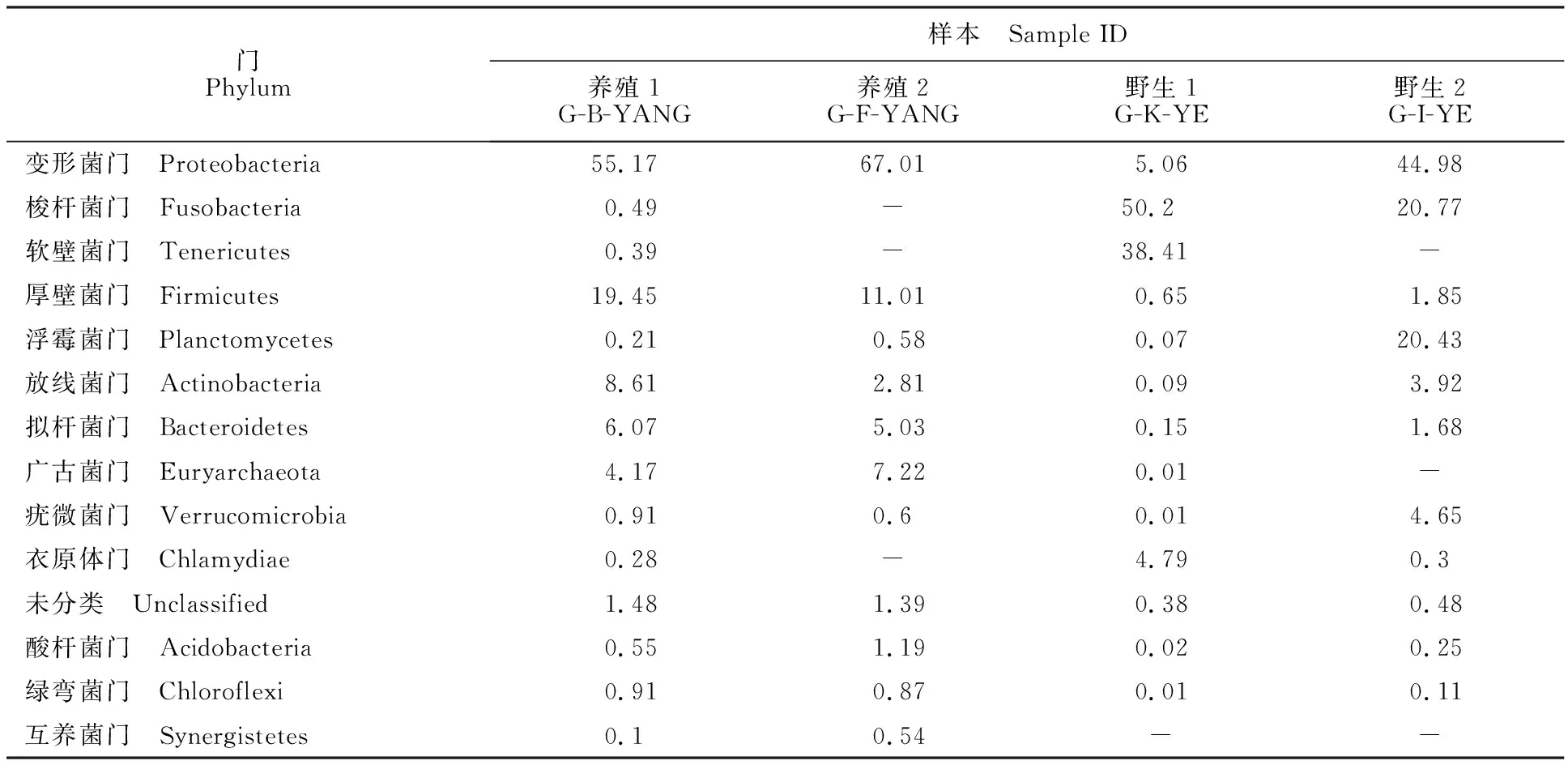
表5 基于门分类水平上各样本肠道微生物优势群落占比Table 5 Microbial dominant flora atphylum level %

表6 基于属分类水平上各样本肠道微生物优势群落占比Table 6 Microbial dominant flora at gene level %
2.5 肠道微生物群落结构主成分分析
从图3可以看出,野生1和野生2样品出现在第一象限,而养殖1和养殖2 样品是在第三象限,表明野生和养殖多鳞白甲鱼的肠道微生物组成不同,二者之间存在明显差异。
3 讨 论
3.1 鱼类肠道微生物组成及影响因素
多鳞白甲鱼肠道菌群主要有变形菌门 (Proteobacteria)、梭杆菌门(Fusobacteria)、软壁菌门(Tenericutes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),这与Gajardo等[24]、Gatesoupe[25]和Saha等[26]的研究结果相似,说明细菌是鱼类肠道微生物菌群的优势群落。鱼类的肠道微生物菌群组成受外源性和内源性因素的双重影响,如食性、肠道结构、水环境温度、养殖条件以及外界压力等[27-28]。通过16S rRNA基因组测序研究发现,野生和人工培育的多鳞白甲鱼肠道微生物菌群组成差异较大,且野生鱼之间也存在一定差异,在孔雀鱼(Trinidadianguppies)及褐点石斑鱼(Epinephelusfuscoguttatus)的研究中也发现类似的结果[29-30]。可能是因为野生鱼与人工养殖鱼的摄食环境不同,食物结构具有差异。在野外,多鳞白甲鱼常见于水流清澈、湍急,底质为砾石的山间溪流中,水体溶氧丰富,水质清洁度高。野生多鳞白甲鱼以水生昆虫、昆虫幼体和附着在石块上的藻类以及掉落水中的植物碎片等为食。人工培育主要使用土质池塘或水泥池,由于养殖成本和养殖环境条件制约,养殖密度较高,导致水体透明度降低,氨氮等代谢产物也会对水质产生一定程度的负面影响。人工养殖池塘中天然饵料匮乏,多鳞白甲鱼主要摄食人工配合饲料。同时,受野外条件限制,野生鱼类的摄食行为也不如人工饲喂的鱼类规律,说明摄食条件和习惯对鱼的肠道菌群组成有重要影响[31-33]。此外,野生鱼与人工养殖多鳞白甲鱼生活的水体环境不同,也会造成肠道微生物群落的不同。Giatsis 等[34]研究发现,罗非鱼(Tilapia)肠道微生物群落与水体微生物组成具正相关性,表明鱼类在适应环境过程中,肠道微生物具有积极作用。当各种不同的化学物质、抗生素、杀虫剂、除草剂和杀虫剂等污染物进入水生动物的消化道,它们可以极大地影响优势肠道微生物群的组成,并可能导致个别物种从整个微生物群落中消失[35-37]。
3.2 鱼类肠道微生物多样性及作用
本研究中,野生多鳞白甲鱼肠道微生物的OUT数大于养殖多鳞白甲鱼。表明野生多鳞白甲鱼肠道微生物群落丰度较大。可能是由于野外和人工培育的生境和摄食等方面的不同,导致鱼类肠道微生物群落多样性差异[38-39]。肠道微生物菌群在宿主营养和健康方面具有重要作用[40]。研究表明,鱼类的肠道微生物通过产生与哺乳动物相似的维生素、氨基酸、消化酶和代谢物,参与宿主的营养和生理过程[41-43]。野生多鳞白甲鱼肠道中优势菌群为鲸杆菌属(Cetobacterium),Tsuchiya等[44]研究发现鲸杆菌属微生物可以合成维生素B12,维生素B12不仅促进核酸与蛋白质的生物合成,还参加碳水化合物、脂肪和蛋白质的分解代谢,是人和动物体内必不可少的微量元素。乳杆菌属(Lactobacillus)是人工养殖多鳞白甲鱼肠道微生物中的优势菌群。研究发现,在人工培育系统中,乳杆菌属(Lactobacillus)会发展成为鲤鱼肠道微生物的优势菌群并具有稳定性[45],与本研究结果一致。这可能是由于乳杆菌可以提高鱼类免疫力,从而更好的适应养殖环境。本研究表明,鱼类肠道微生物菌群具有营养及调节消化道免疫功能的作用。然而,与恒温动物相比,鱼类的肠道生态环境复杂多变,因此,肠道微生物在鱼类营养中的确切作用还有待进一步探究。
