低温条件下日本医蛭各组织基因表达转录组测序及qPCR验证
2021-08-10谌颖莲曾德军
余 米,谌颖莲,曹 敏,2,周 梦,曾德军
(1.重庆市药物种植研究所,重庆 408435;2.特色生物资源研究与利用川渝共建重点实验室, 重庆 408435)
日本医蛭(HirudonippnicaWhitman)为《中国药典》收录品种[1],其含有高效抗凝血物质—水蛭素,同时具有抗血栓、抗凝、降血脂等功效,是心脑血管疾病药物的主要动物原材料[2]。日本医蛭的人工养殖是获取日本医蛭药物原材料的主要途径,但其人工繁殖是产业发展的瓶颈,解析日本医蛭繁殖相关分子机理对提升其人工饲养效率及突破其人工繁殖瓶颈具有重要意义。温度是影响日本医蛭繁殖和生长的主要环境因子,不同温度条件下日本医蛭生理状态存在明显差异。日本医蛭繁殖需要适宜的环境温度,目前关于温度对蛭类的影响研究仅限于繁殖性能和抗冻方面[3-5],研究表明低温能够刺激宽体金线蛭的性腺发育[4],但温度对日本医蛭的繁殖情况影响分子机制尚不明确,阻碍了对日本医蛭繁殖相关分子机理的认知和应用。本研究通过设置不同的饲养温度(18℃为日本医蛭的繁殖适宜温度,6℃为日本医蛭的深层休眠温度),对日本医蛭进行饲养,利用转录组测序[6]及实时荧光定量PCR技术检测不同温度梯度下日本医蛭头部、环带和肌肉组织中的基因转录本的表达情况,对进一步了解日本医蛭繁殖的分子机理,加速其人工繁育,提高生产力具有重要意义,同时挖掘出更多与繁殖相关的基因,为深入研究日本医蛭的繁殖分子机理提供参考。
1 材料与方法
1.1 试验材料
40尾日本医蛭来自重庆市药物种植研究所日本医蛭繁育基地,体质量为1.425~2.304 g,体长9.8~ 10.52 cm。分别置于6 ℃、18 ℃和 24 ℃恒温培养箱内饲养30 d,剪取肌肉、环带和头部组织送北京诺禾致源科技股份有限公司进行转录组测序及分析。
1.2 试验试剂
Trizol(大连宝日生物有限公司,货号:9108);反转录试剂盒(美国Thermo公司,货号:K1682);染料型荧光定量PCR Mix(大连宝日生物有限公司,货号:RR820Q);DL2000 Marker(大连宝日生物有限公司,货号:3427Q)、2×Taq PCRMaster Mix(康为世纪生物有限公司,货号:CW0690);Goldview Ⅰ型核酸染料、异丙醇、无水乙醇、氯仿、琼脂糖、荧光定量八连管等均由代理商购买。
1.3 RNA提取
取250 mg左右组织块利用液氮研磨后转至2 mL离心管中,加入1 mL Trizol冰上裂解5 min并摇匀,加入200 μL的氯仿,充分混匀后 12 000 r/min 离心15 min,将上清液转移至1.5 mL离心管中,加入等体积的异丙醇,冰育 20 min,取出后10 000 r/min 离心10 min,去上清液并晾干,加入400 μL 75%无水乙醇洗涤,7 500 r/min 离心5 min后取出晾干,加入50 μL的DEPC水熔解,置于85 ℃水浴锅内5 min后放置-80 ℃冰箱保存。
1.4 cDNA合成
取1 μg的RNA样品利用DNA酶处理2 min后,75 ℃处理 5 min去酶活,加入多聚dT引物和随机引物各1 mol/L(10 μmol/L),65 ℃孵育5 min后加入dNTP、反转录酶、反应Buffer及灭菌水,42 ℃孵育1 h,75 ℃处理5 min去酶活,cDNA样品保存于-20 ℃冰箱。
1.5 引物设计及qPCR反应
利用Primer 5软件及NCBI数据库序列对基因进行qPCR引物设计,详细信息见表1,使用20 μL反应体系,包括10 μL Mix、上下游引物各1 mol/L(10 μmol/L)、cDNA模板1 μL、灭菌水 7 μL,置于PCR仪或荧光定量PCR仪反应;反应程序为:95 ℃预变性5 min 循环内95 ℃变性 30 s,60 ℃退火和延伸45 s,反应40 个循环;熔解曲线绘制程序为60 ℃ 稳定1 min,每5 s升高 0.5 ℃并记录一次荧光值,至95 ℃结束,绘制熔解曲线图,反应产物通过1%琼脂糖凝胶电泳检测片段大小并送样测序检测引物特异性。
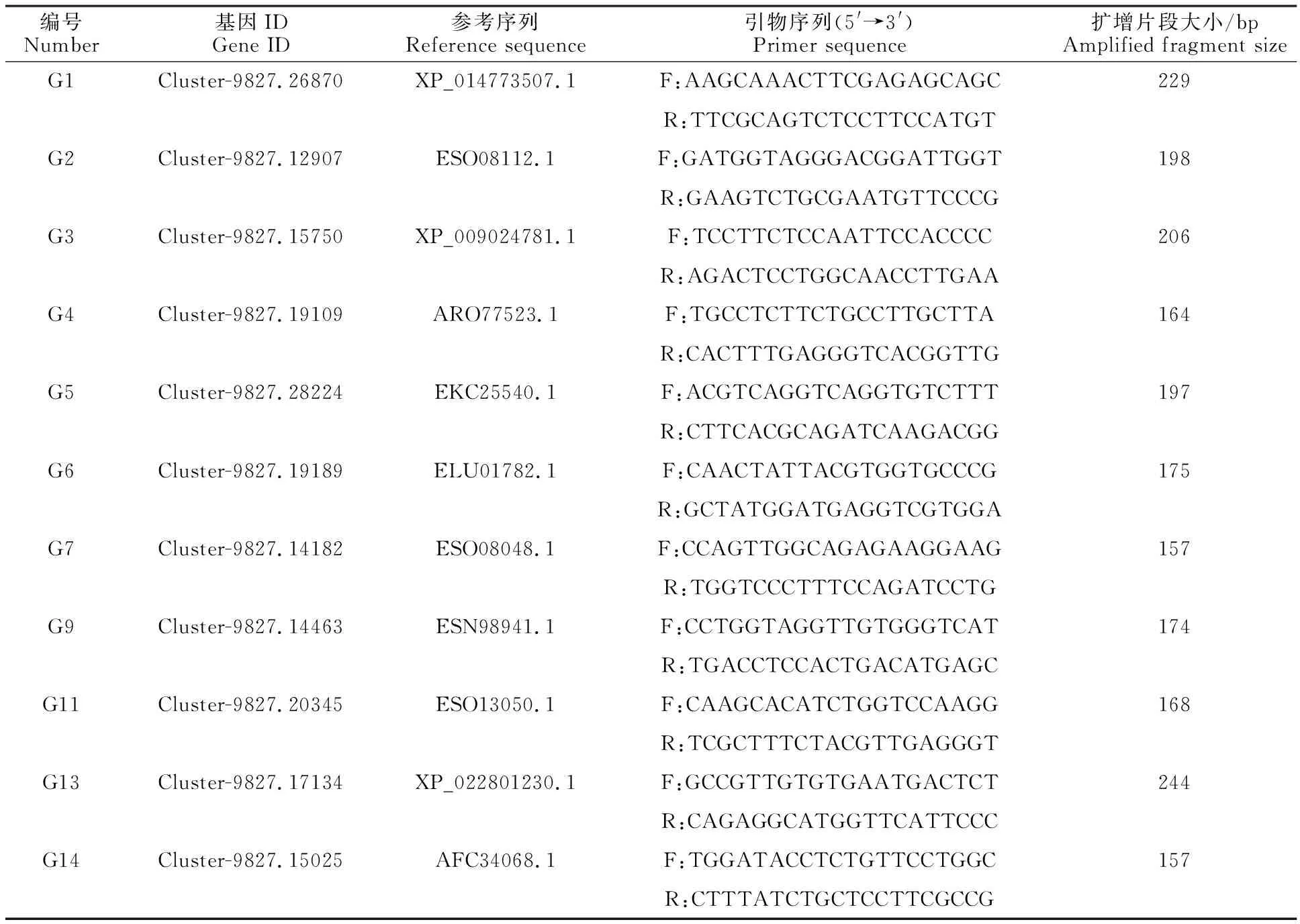
表1 基因qPCR扩增引物序列及信息Table 1 Gene qPCR amplification primer sequence and information
通过设计的引物对各待测基因进行引物PCR扩增,检测扩增反应的特异性,结果显示各基因扩增反应条带单一,未出现非特异扩增条带,能够用于qPCR反应来检测各待测基因的表达情况(图1),同时各基因qPCR扩增熔解曲线峰单一(图2),PCR产物测序结果与预期一致,说明设计的qPCR引物能够准确检测各待测基因在各样品中的表达情况。
1.6 蛋白功能域预测及miRNA亲和预测
使用SMART(http://smart.embl-heidelberg.de/)预测假定蛋白包含的功能域,分析假定蛋白的功能;使用PSI-BLAST(https://www.ncbi.nlm.nih.gov/)比对基因氨基酸序列;使用SWChen 2.0(https://ylchen-swchen.lofter.com/)分析非编码RNA对miRNAs的结合情况。
1.7 统计分析
使用2-δδ算法[7-9]计算各基因在各组织中的相对表达情况;使用SPSS 23.0进行数据统计分析,两组数据之间的比较使用Student-t检验,用“*”和“**”分别表示差异显著(P<0.05)和极显著(P<0.01);多组数据之间的比较使用邓肯法检测,不含有相同大写字母表示差异极显著 (P<0.01),不含有相同小写字母表示差异显著 (P<0.05);利用Graph Pad 8.0绘制基因组织表达热图和柱状图。
2 结果与分析
2.1 转录组测序候选基因表达情况
通过对6 ℃、18 ℃、24 ℃ 3种不同温度条件下饲养的日本医蛭头部、环带和肌肉组织进行转录组测序,选取11 个在各条件下表达具有差异的基因绘制表达热图(图3)并通过对基因序列比对进行功能注释(表2),结果显示在 6 ℃条件下基因G1~G4,G7,G9,G11,G13,G14总体表达下调;G5,G6在总体表达上调;在18 ℃条件下G1、G2、G4、G7、G9、G13和G14在头部组织表达相对较高,G6和G11在环带表相对较高,G3和G5在肌肉组织表达相对较高;对11 个基因的功能进行注释结果显示,11个基因主要涉及肌球蛋白、无脊椎连接蛋白9以及一些假定蛋白和非特征蛋白。
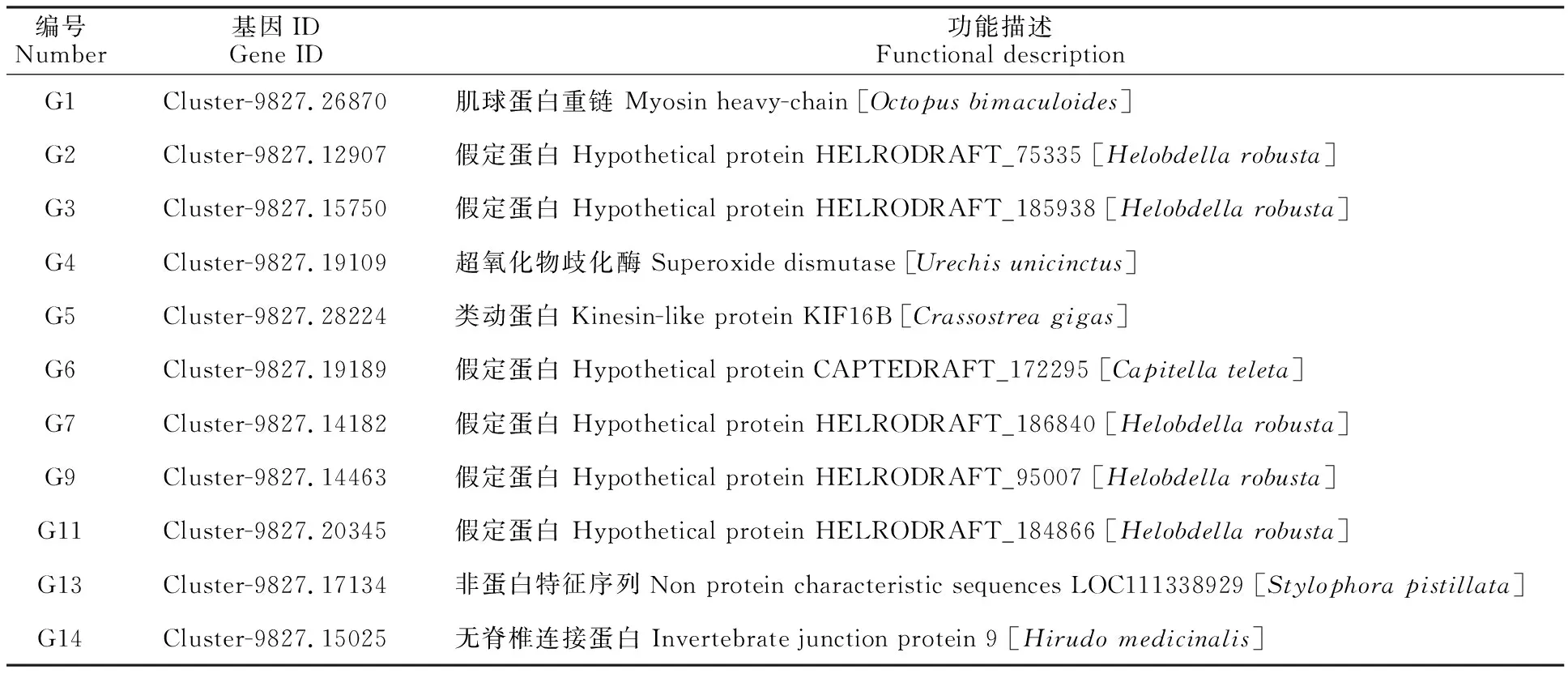
表2 日本医蛭基因功能注释Table 2 Function note of H.nippnica gene
2.2 荧光定量PCR对待测基因表达验证
为进一步验证日本医蛭在不同温度条件下的基因表达的转录组测序结果,对6 ℃、18 ℃、 24 ℃ 3种温度下日本医蛭头部、环带、肌肉组织中的11 个待测基因进行实时荧光定量PCR扩增反应,检测11个待测基因的表达情况(图4~6)。结果显示在6 ℃和24 ℃条件下饲养日本医蛭 30 d后,在日本医蛭肌肉组织中G1和G2基因在 6 ℃条件下的表达极显著低于24 ℃条件下的表达(P<0.01);在日本医蛭头部中6 ℃和24 ℃条件下G13基因表达差异不显著(P>0.05),G14基因在6 ℃条件下的表达极显著低于24 ℃条件下的表达(P<0.01);在日本医蛭环带中G4和G5基因6 ℃饲养条件下的表达显著高于24 ℃饲养条件(P<0.05),在6 ℃饲养条件下,G3基因在环带中的表达显著低于24 ℃饲养条件(P< 0.05)。在6 ℃、18 ℃和24 ℃饲养条件下,对G6、G7、G9、G11基因分别测定其在日本医蛭的环带和头部的表情况(图6),结果显示,在日本医蛭的环带中G6基因的表达随着温度的升高而极显著降低(P<0.01);而在日本医蛭的头部G7和G9基因随温度的升高呈现表达增高趋势,其中G7在24 ℃饲养条件下极显著高于18 ℃和6 ℃条件(P<0.01),G9在18 ℃和24 ℃ 饲养条件下显著高于6 ℃条件(P<0.05),但G11基因随温度的升高表达呈现下降趋势,其中24 ℃饲养条件下G11基因在头部的表达极显著低于6 ℃条件(P<0.01)。
2.3 假定蛋白功能域预测及非编码RNA对miRNA亲和预测
由于G2、G3、G6、G7、G9和G11的的注释属于假定蛋白,为进一步了解它们的功能,对以上6种测序序列进行开放阅读框翻译,将获得的蛋白序列进行功能域预测了解6种假定蛋白可能有关的功能,结果显示,仅有G6、G9和G11呈现出高置信度的功能域,包括G6和G9蛋白的跨膜结构域以及G11蛋白的核糖体功能域L31e(图7),暗示G6和G9可能为跨膜蛋白,而G11与核糖体蛋白相关,具体的功能判断需要进一步分析,而G7没有预测到相关功能域,其他置信度较低功能域已列出见表3,G13基因属于没有蛋白特征的序列,检测其对miRNA的亲和程度来预测其功能,列出亲和排名前十位miRNA(图 8)。

表3 编码基因蛋白序列及功能域预测Table 3 Prediction of protein sequences and functional domains of coding genes
3 讨 论
日本医蛭俗称水蛭、日本医水蛭、稻田医蛭,隶属于医蛭行亚目(Hirudiniformes Caballero)、医蛭科(Hirudinidae Whitman)、医蛭属(Hirudo),在中国南北多省均有分布,由于其含有高效抗凝血物质—水蛭素,是心脑血管疾病药物的主要动物原材料[2,10],近年来随着中药材市场和药企需求的增加,过度捕捞加之天然水域水质的改变,使得天然水域日本医蛭的资源量减少,日本医蛭的人工繁育是获取日本医蛭原材料的主要途径,而目前对日本医蛭的繁殖机理研究尚属空白,而日本医蛭的繁殖需要在适宜的温度条件下进行,因此掌握不同温度梯度下日本医蛭各基因的表达情况对于解析日本医蛭的繁殖分子机理具有重要意义。
通过设置6 ℃、18 ℃、24 ℃ 3种温度梯度的饲养条件,利用转录组学测序的方法对基因在日本医蛭肌肉组织、环带和头部的表达差异进行测定,对其中表达差异的11个基因(表2)进行表达验证,基因的组织表达转录组测序热图结果显示,基因G1~G4和G7,G9,G11,G13,G14在低温条件下总体表达下调,在低温条件下变温动物的代谢情况会相对变慢,基于低温条件下表达量减少推测是代谢变慢造成[4,11],而G5和G6在低温条件下总体表达上调,暗示G5和G6基因可能为刺激日本医蛭性腺发育的繁殖相关基因;18 ℃是日本医蛭的最适繁殖温度,在18 ℃饲养条件下不同组织中G1、G2、G4、G7、G9、G13和G14在头部组织表达相对较高,G6和G11在环带表相对较高,G3和G5在肌肉组织表达相对较高,日本医蛭的头部主要参与神经和体液的调控,因此在头部组织高表达的基因可能涉及其繁殖调控,而环带与日本医蛭的繁殖具有较大的关联,G6和G11的高表达暗示G6和G11基因与日本医蛭的繁殖相关,日本医蛭的肌肉组织能够影响其活动和代谢状况,反映机体的适应能力及对疾病的抵抗力,因此G3和G5可能与其适应性和疾病抗性相关;转录组学的表达测序结果为探究基因在不同组织及不同温度条件下的表达情况及挖掘日本医蛭繁殖相关分子,为研究日本医蛭的繁殖分子机理提供参考[6]。为进一步验证不同温度下各基因的表达情况,利用实时荧光定量PCR试验进一步验证11个基因的表达情况(图4~6),结果显示,低温条件下G1、G2、G3、G14在肌肉、环带和头部组织中均表达下调,G4和G5在环带中表达上调,低温条件下基因的表达上调暗示G4和G5与日本医蛭繁殖相关,同时G6基因在环带中的表达情况随温度的升高而降低,与转录组测序结果一致,进一步暗示指出G6基因与日本医蛭的繁殖密切相关;G7在头部中6 ℃和18 ℃表达极显著低于24 ℃,而6 ℃和18 ℃之间表达差异不明显,且G11在头部中的表达随温度的升高而降低,G11可能属于繁殖促进基因,但需要进一步试验验证;G13在头部低温条件下表达变化差异不显著,G9在头部6 ℃和18 ℃之间表达差异显著,但其他温度比较不显著,G9和G13的的功能还需要进一步实验验证,通过荧光定量对基因表达情况检测结果指出G6基因在日本医蛭的环带中表达随温度的升高而降低,与转录组测序结果一致,指出了G6基因在日本医蛭繁殖过程中的重要性,同时G4和G5在环带中低温条件下表达上调,也指明其繁殖关联性,但与转录组测序结果不一致,需要进一步的试验验证,G11基因在头部组织中低温条件下表达上调,也暗示G11基因对日本医蛭的繁殖具有促进作用,其他基因的功能需要进一步的试验验证。蛋白的功能域结构[12]与非编码RNA对miRNA的亲和能力情况能够反映出未知蛋白和非编码RNA序列可能的功能[8,13],为进一步分析未注释的G2、G3、G6、G7、G9、G11和G13基因,对其假定蛋白进行功能域预测和非编码RNA序列进行miRNA亲和能力评估,探究未注释基因的功能情况[8,13],结果显示G6 和G9存在重复的转膜域结构,G11具有一个核糖体蛋白域结构,可能由于物种之间的差异性,而其他假定蛋白没有显著的功能域结构,不显著的功能域列于表3为其研究提供参考,假定蛋白功能域预测暗示G6和G9属于膜蛋白,而G11与蛋白合成相关,为G6、G9和G11的功能研究提供参考,通过进一步的核酸和氨基酸BLAST比对发现,由于水蛭类物种序列数据核酸信息较少,物种之间的核酸序列差异较大,G6、G9和G11核酸序列与GeneBank比对相似度较低,通过蛋白PSI-BLAST(Position-Specific Iterated BLAST)比较显示,G6与脂肪酸去饱和酶(Omega-3 desaturase-like B[Platynereisdumerilii] ATV93525.1)具有较高的相似性,G9与水通道蛋白(Aquaporin [Eiseniaandrei] CAX48970.1)具有较高相似性,G11与核糖体蛋白(Ribosomal protein rpl31[Eurythoecomplanata] ABW23230.1)具有较高相似性,在特种生物高通量测序中,可通过序列比对的方法预测新基因的功能,但由于低等物种的多样性及日本医蛭序列信息的不完整,导致对基因的注释不完整,PSI-BLAST比对可对保守的氨基酸序列区域给出评分而并非整个蛋白序列比对,能够消除一部分由物种差异导致的非功能保守区域的不相识导致的低评分,但比对结果需要进一步试验验证,由比对结果可知,在低温条件下水蛭可能增加G6脂肪酸去饱和酶的表达量来增加细胞脂膜磷脂脂肪酸链的不规则程度,增加细胞膜的流动性降低脂肪酸凝固点,有利于低温环境下生存,同时去饱和酶的表达量升高也有较大几率增加不饱和脂肪防酸的形成,有利于固醇类、甾类等性激素的合成;生物体内水分的变化能够让生物适应环境温度的变化, G9基因在低温条件下的平均表达量值减少(P>0.05),能够改变细胞水分含量,使其适应更为极端的低温环境;低温条件下生物的代谢活动会减少,G11为核糖体亚基的一部分,在低温条件下表达量出现升高的状况,可能与抗冻蛋白的合成相关,但具体需要进一步研究证明;非编码RNA在细胞的繁殖调控中具有重要作用[14],G13基因没有蛋白的翻译特征,属于非编码RNA序列[15],非编码RNA可通过亲和miRNA来抑制miRNA对下游蛋白的表达调控,而影响动物的繁殖情况[13-14],通过SWChen 2.0程序[8]预测G13基因对miRNA的亲和程度和结合位置(图8),与miRNA亲和程度较强的前十个miRNAs列于表3为其进一步研究提供参考。
4 结 论
通过荧光定量PCR检测结果显示,G4~G6基因在环带中的表达随温度的升高而降低,与转录组测序结果一致,6 ℃条件下日本医蛭基因 G4~G6表达量提高,G4~G6与繁殖具有较强的相关性。
