他克林对猪精子冻后质量、抗氧化能力及糖代谢的影响
2021-08-10陈志英胡传活唐胤晟邓祝新冯显钤许春荣刘德玉谢运法
陈志英,胡传活 ,唐胤晟,邓祝新,许 鹏,冯显钤,许春荣,刘德玉,冯 妮,谢运法,李 铭
(1.广西大学 动物科技学院,南宁 530004; 2.广西畜禽品种改良站,南宁 530001;3.广西科达畜禽改良有限责任公司,南宁 530001;4.来宾市畜牧站,广西来宾 546100)
冷冻精液在畜禽繁殖育种中有保存时间长、成本低、受运输环境影响小、跨区域育种、减少疾病传播等优点,促使精液冷冻技术飞速发展。但因猪精子对温度极其敏感,在冷冻解冻过程中易于应激损伤,导致在生产中使用冷冻精液进行人工授精时产仔率比常规液态保存精液低20%~30%[1]。因此,探索如何改善猪精子冷冻稀释液进而提高冷冻猪精液在市场中的运用具有重要的研究意义和发展前景。
Hu等[2]首次将他克林加入猪精液冷冻稀释液中,并发现0.05、0.10、0.15mmol/L 他克林可以显著或极显著地提高猪精子的冻后质量,其中浓度为0.10mmol/L时效果最好。在此基础上,黄明光等[3]研究发现,他克林对猪精液的常温及低温保存也具有积极作用,其结果也是浓度0.10mmol/L他克林的效果最佳,说明稀释液中他克林能够延长精子的寿命从而显著地改善猪精子的保存效果。但有关他克林对猪精液保护作用的机制尚未有相关研究报道。因此,本研究在Hu等[2]及黄明光等[3]的基础上选取浓度为0.10mmol/L他克林开展试验,以杜洛克公猪为对象,探究他克林对冻融猪精子生物学特性的影响,为促进猪精子的冷冻保存提供参考资料。
1 材料与方法
1.1 主要试剂及耗材
他克林购自药雅科技(上海)有限公司;0.25 mL塑料细管,购于法国卡苏生物公司;线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒(JC-1)、AO荧光染色试剂盒购自北京雷根生物技术有限公司;考马斯蓝R250及己糖激酶(hexokinase,HK)、总胆固醇(totalcholesterol,TC)、丙酮酸(pyruvicacid,PA)、总抗氧能力(total antioxidant capacity,T-AOC)、丙二醛(malondialdehyde,MDA)含量和超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒购于索莱宝生物公司;活性氧(reactive oxygen species ,ROS)检测试剂盒购于碧云天生物公司。精液冷冻液(Ⅰ液、Ⅱ液)及解冻液参照王昕等[4]的方法配制。
1.2 主要仪器
Digitcool程序化自动冷冻仪及SCA自动精液分析仪,购自法国卡苏公司;SD-2数码液晶显微镜,购自深圳泰宇星光电仪器有限公司;电子车载冰箱,购于北京福意联电器有限公司;恒温水浴锅HH-2,购于上海精宏有限公司;Tecan Infinite 200 PRO多功能酶标仪,购自瑞士帝肯公司。
1.3 精液的采集、冷冻与解冻
精液的采集稀释与平衡、冷冻及解冻参照李丹丹等[5]的方法进行,如下。
1.3.1 精液的采集 精液采自广西科达畜禽改良有限责任公司的健康、正常采精的杜洛克种公猪。常温稀释液与精液按体积比1∶1等温稀释后,0.5 h内运至广西畜禽品种改良站实验室进行后续试验。选取镜检活力>0.8的精液用于后续试验。
1.3.2 精液的稀释与平衡 将镜检合格的精液室温下离心(1 200 r/min,6 min),弃上清;与稀释Ⅰ液等体积混合。孵育后加入等体积的冷冻稀释Ⅱ液(即精液∶稀释Ⅰ液∶稀释Ⅱ液 = 1∶1∶1);用0.25 mL的塑料细管分装,2 h内缓慢降温到 4 ℃,并在该温度下平衡2 h。
1.3.3 精液的冷冻 打开冷冻仪,使温度从室温降至4 ℃。精子平衡结束后检测其活力,检测合格后置程序降温仪内,采用猪精液冷冻程序冷冻。程序结束稳定3 ~ 5 min后取出细管迅速分组置液氮罐中保存。
1.3.4 精液的解冻 迅速取出细管置60 ℃水浴复温解冻5 s。擦干细管上的水珠并剪开其两端,将精液倒出,与常温等体积的BTS解冻液混合。
1.4 精子质量检测
1.4.1 活率 参照王捷等[6]的方法,即从各试验组中分别吸取精液20 μL于载玻片上,显微镜(400×)下观察,计数约200个精子,计算运动精子数量,计算精子活率。
1.4.2 质膜完整率 用低渗肿胀法检测精子质膜完整率,具体操作参照李丹丹等[5]的方法,即取果糖-柠檬酸钠低渗溶液将解冻后的精子稀释,并将精子密度调整为1×106mL-1, 37 ℃下孵育30 min后,取20 μL精子悬液置于血球计数板上,随机选取400×普通光学显微镜下5个视野进行观察,计数200个以上精子的质膜完整性。
1.4.3 顶体完整率与畸形率 参照杨宝卫[7]的方法操作,用考马斯亮蓝染色法检测精子的顶体完整率和畸形率,取100 μL精子用1 mL 体积分数2%多聚甲醛溶液固定10 min,2 000 r/min离心5 min,用PBS离心洗2 次并去上清。取10 μL涂片,风干。把涂好的载玻片放人含有考马斯亮蓝的染液中,在37 ℃染色20 min。然后用蒸馏水冲洗,风干,最后在光学显微镜下观察,每次计数200个以上精子,计算顶体完整率和精子畸形率。
1.4.4 精子MMP 调整精子浓度为1×106mL-1,于1 mL的PBS中900 r/min离心10 min,弃上清,重复3次。根据线粒体膜电位检测试剂盒(JC-1)说明书进行操作,涂片后用荧光显微镜观察。
1.4.5 DNA损伤率 取适量精子悬液,按照精子悬液∶染液=19∶1的体积比混合,轻轻混匀,室温避光染色15 min,涂片后荧光显微镜下观察,计数并拍照,DNA损伤的精子数与精子总数的比值即为DNA损伤率。
1.5 抗氧化指标检测
调整精子浓度为1×106mL-1,PBS清洗 3 次后重悬,装载探针37 ℃培养箱孵育20 min后用荧光酶标仪检测精子ROS水平。PBS清洗 3 次后重悬,加入裂解液超声破碎,8 000 r/min低温离心10 min,取上清测蛋白浓度,按照T-AOC检测试剂盒说明书添加工作液,反应10 min后于波长593 nm下测定精子T-AOC。按MDA含量检测试剂盒说明书添加工作液后煮沸30 min,冷却后10 000 r/min常温离心10 min,用酶标仪测定样品在450 nm、532 nm和600 nm的吸光度,计算MDA含量。按SOD检测试剂盒说明书添加工作液,37 ℃水浴30 min后在560 nm下检测SOD活性。
1.6 糖代谢相关指标检测
冷冻-解冻后,于1 mL的PBS中900 r/min离心10 min,弃上清,重复3 次,加入裂解液超声破碎后检测蛋白浓度,根据说明书添加工作液后用分光光度计分别在500 nm、340 nm和520 nm下检测精子总胆固醇(TC)含量、HK活性和丙酮酸(PA)含量。
1.7 统计学处理
所有试验均做3 次以上重复。数据以“平均数±标准差”表示,采用t-检验进行数据分析,P<0.05表示两组比较具有显著性差异;P<0.01 表示两组比较具有极显著性差异。
2 结果与分析
2.1 他克林对猪精子冻后质量的影响
如表1所示,冻融后他克林组精子活率、畸形率极显著高于空白组(P<0.01),质膜完整率、顶体完整率显著高于对照组(P<0.05),新鲜组的质量指标与两个冷冻组的差异之间有统计学意义(P<0.01)。
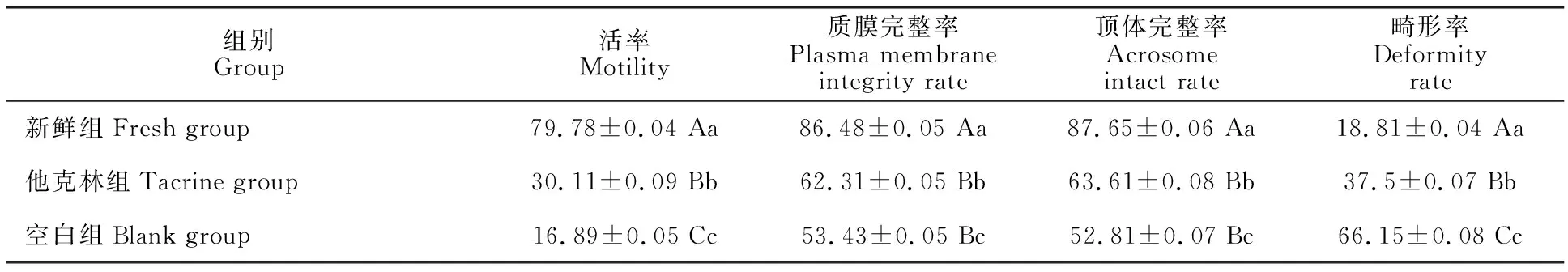
表1 猪精子的冻后质量Table 1 Quality of boar sperm after frozen-thawed %
2.2 他克林对猪精子MMP的影响
400倍荧光显微镜下观察猪精子线粒体膜电位,每次试验不少于200 个精子(图1)。绿色荧光精子说明MMP下降,并且该精子很可能处于凋亡早期。出现红色荧光说明MMP比较正常,精子的状态也比较正常。用发红色荧光的精子百分率 (JC-1%) 代表MMP正常的精子比例。与新鲜组比较,他克林组和空白组的MMP水平均极显著降低 (P<0.01),空白组MMP水平与他克林组差异极显著 (P<0.01) (图2)。
2.3 他克林对猪精子DNA损伤的影响
精子DNA是评价精子功能的重要指标之一,在经历冷冻和复苏这种巨大的温度变化之后精子结构会发生变化[8],由于渗透压的改变,胞内产生的过量活性氧易导致精子核DNA损伤[9]。如图3所示,正常精子细胞核被均匀染成黄绿色荧光,DNA损伤的精子染色质浓缩,细胞核碎裂成点状,被染成大小不一、致密浓染的绿色颗粒。在冷冻液中添加他克林来抑制冷冻-解冻对精子DNA的损伤,结果如图4所示,精子冷冻保存会极显著造成DNA损伤(P<0.01),而他克林显著降低DNA的损伤程度(P<0.05)。
2.4 他克林对猪精子抗氧化指标的影响
精子细胞内线粒体在精子代谢过程中产生大量ROS,活性氧自由基可引起精子膜上脂质过氧化,造成细胞损伤凋亡的同时还能对精子基因组造成伤害[10],因此,总抗氧化能力是检测精子的一项重要指标。结果(图5)表明,新鲜组T-AOC极显著高于两个冷冻组(P<0.01);相较于空白组,添加0.01 mmol/L的他克林能极显著提高精子的 T-AOC(P<0.01)。
SOD是生物体系中抗氧化酶系的重要组成成员,其水平的高低间接反映机体清除自由基的能力,其活性能反映细胞的氧化状态,也可常用来反映衰老死亡的直观指标。本试验发现(图6),冷冻保存的SOD活性精子会极显著降低 (P<0.01),而在冷冻稀释液中加入适量浓度的他克林可显著上调SOD活性,提高抗氧化能力(P<0.05)。
MDA是由机体内自由基于脂质形成过氧化反应的终末产物,能够诱发核酸、蛋白质等生命大分子发生交联聚合,具有细胞毒性,有促凋亡的作用,体内水平高低间接反应细胞受自由基攻击的严重程度[11]。如图7可知,2个冷冻组的MDA含量均高于新鲜组(P<0.01),而他克林组MDA含量显著低于空白组(P<0.05)。进一步证明他克林在精液冷冻保存中对抗氧化有正面影响。
2.5 他克林对猪精子糖代谢指标的影响
胆固醇作为细胞膜的重要成分,它还可以转变为多种具有重要生理作用的物质,因此,胆固醇含量对维持精子代谢平衡是十分重要的。如图8所示,与新鲜组相比,冷冻组总胆固醇含量均极显著降低(P<0.01),而在冷冻液中添加他克林可极显著改善精子胆固醇含量降低的现象(P<0.01)。
葡萄糖在能量代谢和 ATP 的产生中发挥作用,HK为糖酵解过程中第一个调节酶,而糖酵解是精子维持精子活力、氧化磷酸化的主要途径。本试验对HK活性进行检测,结果如图9所示,两个冷冻组与新鲜组相比HK活性均极显著降低 (P<0.01),他克林组与空白组相比HK活性显著上调 (P<0.05)。
哺乳动物精子细胞内能量的来源是ATP,ATP为精子运动、蛋白质调控以及受精作用提供能量,丙酮酸是细胞糖代谢及体内多种物质相互转化的重要中间体,其含量能间接反映糖代谢水平。如图10所示,冷冻使精子总丙酮酸含量显著(试验组,P<0.05)或极显著(对照组,P<0.01)降低,而冷冻液中添加他克林可极显著逆转精子丙酮酸含量降低的现象 (P<0.01),可提高精子对葡萄糖的利用率,维持正常的生理功能和运动。
3 讨 论
精液冷冻保存是目前畜牧业中最常用的生殖技术,是人工授精技术中极其重要的环节,可加快家畜和水产动物的新物种培育以及遗传改良。使优良种公畜的精液能够妥善保存,扩大精液使用范围。但冷冻对精子活率、形态、精子膜和顶体完整性都会产生损伤及影响[12]。同时,精子经过冷冻这一过程会使其 DNA 片段受到损伤,从而影响胚胎的质量和生存能力[13]。冷刺激对猪精子带来不可逆的损伤,可造成膜不稳定、胆固醇损失、膜流动性降低、膜通透性改变和渗透阻力降低,导致低温猝倒、顶体反应和细胞凋亡,并导致精子成功受精的能力下降。膜胆固醇的丧失在细胞凋亡中起主要作用[14-17]。冷冻保存过程中,细胞内线粒体膜电位发生改变,诱导ROS产物产生,引起线粒体膜通透性改变,诱发细胞凋亡,从而造成细胞损伤[18]。氧化应激是由ROS或自由基引起的,精子维持正常生理功能离不开活性氧,ROS能促使精子发生顶体反应及获能[19]。ROS是氧的代谢产物,过高浓度的ROS可以诱导细胞的脂类、蛋白和DNA氧化,对精子质量产生负面影响[20-22],从而引起一系列的病理变化。
他克林自1993年开始运用于治疗阿尔兹海默症,是第一代可逆性抗胆碱酯酶抑制药,可改善记忆能力降低,因其具有肝毒性在临床中应用逐渐减少[23]。近年研究发现他克林可调控 K+和Ca2+通道[24-25],是潜在治疗体外寄生虫药物[26],可抑制细胞凋亡、增加葡萄糖代谢,对神经细胞有保护作用[27-31]。本试验通过在猪精液冷冻稀释液中添加0.10 mmol/L他克林,检测冻融后精子各项质量指标,结果显示猪精液品质得到显著提高,这表明他克林对冷冻保存的猪精子具有保护作用。结果显示0.10 mmol/L他克林处理组的猪精子冻后活率高于冷冻空白组,与Hu等[2]在猪精液冷冻保存过程中添加他克林所得结果一致。他克林可减少冷冻-解冻过程中精子的死亡,从而提高猪精子冻后活率。Hu等[2]的研究中检测了冻后的精子活率以及冻后精子的路径速率、直线运动速率和轨迹速率等运动指标,本试验在检测冻后质量的基本指标后,从抗氧化和糖代谢方面进一步评价他克林对猪精子的保护作用,丰富其理论基础及数据。近年研究显示番茄红素、丹参、枸杞多糖等多种药物在精液保存中可减少氧化应激,提高精子质量[32-34]。张百芳等[35]研究发现双他克林可有效减少严重缺氧、葡萄糖缺乏造成的细胞毒性,一定程度上说明他克林有增加细胞对葡萄糖利用的潜力,本试验结果也显示他克林可显著提高精子糖代谢水平,其结果与张百芳等[35]研究结论一致,而其机制可能与他克林参与离子调控有关。
综上所述,精液冻存会造成精子的损伤,降低精子活率和MMP,还可造成精子DNA损伤数增加,最终导致精子凋亡。当冷冻稀释液中添加他克林,可有效增加质膜完整率、顶体完整率、MMP水平等表观指标,还可以上调SOD活性和MDA含量,增加精子抗氧化能力,并且增加PA、TC含量和HK活性,促进精子对葡萄糖的利用。因此,0.1 mmol/L的他克林可以作为保护精子的有效成分应用到猪精液冷冻中,减缓精子的冷冻损伤,从而达到更佳的冻存效果。但他克林是否可以改善公猪冷冻精液的体外受精及人工授精能力,有待于进一步的研究。
4 结 论
在猪精液冷冻稀释液中添加浓度为0.10 mmol/L的他克林可以提高精子的抗氧化能力和糖代谢水平,并改善冻融后猪精子的质量,试验为探索他克林在猪精子冷冻中的作用提供了基础数据,但其机制还有待深入研究。
