局部晚期食管癌新辅助放化疗方案的临床疗效评价
2021-08-10刘广国邓海军罗文娟苏州税莲蒲铀张黎
刘广国,邓海军,罗文娟,苏州,税莲,蒲铀,张黎
食管癌是常见的恶性肿瘤,在我国的发病率、死亡率分别居恶性肿瘤第六位、第四位,然而约70%患者在确诊时,即是局部晚期,仅依靠单纯手术治疗已经无法达到根治[1]。如今,随着各种治疗技术的发展,食管癌综合治疗手段丰富,如术前或术后放化疗、靶向治疗、免疫治疗等[2]。中国食管癌放射治疗指南指出[3],局部晚期食管癌常见的治疗失败表现是肿瘤局部复发和远处转移。对于可手术局部晚期食管癌,行新辅助放化疗后手术是标准的首选治疗方案,与单纯手术治疗相比,可显著提高局部晚期食管癌患者的局部控制,降低远处转移率,提高患者生存期和生活质量,术后不良反应可耐受。顺铂加氟尿嘧啶是局部晚期食管癌标准的治疗方法;然而,依据RTOG标准评价放疗不良反应和WHO化疗药物毒性反应分度标准,由于同步放化疗的化疗药毒性和生存率并不令人满意,出现3级血液学及恶心、呕吐等消化道毒性发生率为42%,5年生存率为26%[4]。紫杉醇为基础的放化疗方案已在食管癌新辅助放化疗和dCRT的I和II期临床研究,取得了令人满意的结果,病理完全缓解率为19%~53%,高于标准的顺铂加氟尿嘧啶方案,也证实了使用紫杉醇为基础的dCRT方案的普遍性[5]。本研究回顾分析了局部晚期可手术食管癌采用顺铂加紫杉醇或顺铂加氟尿嘧啶新辅助同步放化疗联合手术的治疗方案,讨论其疗效、不良反应以及并发症、2年OS和PFS等,为临床治疗局部晚期食管癌提供个体化的依据。
1 资料与方法
1.1 一般资料
通过回顾性分析,选取我院2015年2月至2017年7月间收治的局部晚期食管癌,纳入符合入组标准72例,分为观察组和对照组。其中男性45例、女性27例,病理为鳞癌61例、腺癌11例;TNM分期、病变部位、病变长度、化疗次数、化疗延迟时间、手术方式等临床特征详见表1;其中患者TNM分期参考2018年版食管癌诊疗指南[2]及美国癌症加委员会第8版分期。本研究入组标准:时间为2015年2月至2017年7月;患者年龄为18~65岁;KPS评分≥70分,既往无其他恶性肿瘤;既往未行放化疗或手术;分期为T1~4N0~1M0;手术为食管癌切除加两野或扩大两野淋巴结清扫术。(2)排除标准:多原发性食管癌;颈段食管癌;非新辅助放化疗者;既往或目前有其他恶性肿瘤病史;术前未按照计划完成治疗;术后生存时间<5个月。本研究经过四川绵阳四0四医院医学伦理委员会批准(2020-15),所有患者及家属已均签署治疗知情同意书。
1.2 治疗方法
1.2.1 新辅助放化疗 入选的72例患者,均采用以铂类为基础的新辅助放化疗方案联合手术。观察组39例,采用TP同步放化疗方案,其中顺铂20 mg/m2,紫杉醇50 mg/m2,第1、8、15、22、29、36天静脉滴注,共5~6周期;对照组采用PF同步放化疗方案,其中顺铂20 mg/m2第1、8、15、22、29、36天静脉滴注,氟尿嘧啶300 mg/m2连续静脉输注96 h,共5~6周期。使用药物信息如下:顺铂(江苏豪森药业集团有限公司,规格2 mL∶10 mg,国药准字H20040812)、紫杉醇(太极集团四川太极制药有限公司,规格5 mL∶30 mg,国药准字H19994040)、氟尿嘧啶(天津金耀药业有限公司,规格10 mL∶0.25 g,国药准字H12020959)。患者放化疗期间密切随访患者的不良反应,给予常规止吐和升白细胞等治疗。
1.2.2 放射治疗 本研究入组的患者均采用6MV调强放射治疗。患者行仰卧位,以热塑膜进行体位固定。采用西门子64排CT行定位扫描,扫描层厚为3 mm,扫描范围根据病变位置、范围设置,CT图像传输至MONACO放射治疗计划系统。放疗靶区勾画参照RTOG、NCCN指南,原发肿瘤(GTVp)为可见的食管病灶,转移淋巴结(GTVn)为可见的转移淋巴结,临床靶区(CTV)为GTVp上下方向外放30 mm,其余方向均外放5~6 mm;GTVn各方向均外放5~6 mm,计划靶区(PTV)在CTV上外放5~8 mm。照射处方剂量为40 Gy,2 Gy/次。治疗计划均满足靶区95%体积达到处方剂量,最大剂量Dmax<110%处方剂量,脊髓Dmax<45 Gy,双肺V5<60%,V20<28%,Dmean<15 Gy,心脏V30<40%。
1.2.3 手术方式 患者新辅助放化疗后4~6周,完善相关检查,如血象、生化常规、CT、钡餐、心肺功能检查等[2]。手术方式为经右胸切除,腹正中切口游离胃,胃经胸骨后路径或食管床路径,左颈部食管胃吻合术,行常规的胸腹二野淋巴结清扫术。
1.3 观察指标
根据RECIST疗效评价标准[6],①近期疗效:在新辅助放化疗结束后的3~4周进行疗效评价,可分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。即CR为所有病灶均消失,PR为靶病灶最长径总和减少≥30%,PD为靶病灶最长径总和增加20%或出现新病灶,SD介于PR和PD之间。 近期总有效率ORR=(CR+PR)/n×100%。手术评价指标:手术根治切除率R0。②远期疗效:评价3年无病生存率PFS、3年生存率。不良反应参照NCI常用药物毒性标准和美国肿瘤放射治疗协作组RTOG分级评价标准,于治疗结束后1个月进行毒性评价,比较两组患者胃肠道反应、粒细胞减少、放射性食管炎、粒细胞下降、过敏反应、毒性等不良反应程度及发生率。术后病理分期参照美国癌症加会AJCC、国际抗癌联盟UICC 2017年第8版分期标准。
1.4 随访
患者新辅助同步放化疗后1 个月复查,包括食道钡餐造影、CT、MRI、超声检查、血液生化等。术后每3 ~ 6 个月随访1次,采用住院、门诊、电话等方式。患者主要终点是2年OS,定义为患者从接受治疗开始,直到患者因肿瘤造成的死亡时间。失访患者为最后一次随访时间;研究结束时仍然存活患者,为随访结束日。次要终点是2年PFS,定义为患者从治疗第1天开始,直到第1次局部治疗失败、转移复发、进展或死亡的时间。其中存活患者的平均随访时间为26.3个月。
1.5 统计学方法

2 结果
2.1新辅助放化疗效果
本研究回顾性分析中观察组及对照组分别有79.5%(31/39)和84.8%(28/33)的患者接受了5~6个周期新辅助化疗,大部分患者均能如期完成同步放化疗。但是,两组患者中均有出现不同程度的延迟化疗情况(<50%),两组治疗总延迟时间无显著性差异。此外,有1例患者只完成了两个周期的新辅助化疗,2例患者只完成了3个周期的新辅助化疗,临床结果显示患者化疗延迟和停药的主要是由治疗引起的毒性所致,且接受化疗周期短的患者依从性更好,但患者的远期生存率有待进一步观察。两组患者的近期疗效如表2所示,其中观察组和对照组患者新辅助放化疗的总有效率分别为92.3%和90.9%,两组差异无统计学意义。

表2 两组患者近期疗效比较
2.2 治疗不良反应
患者经过新辅助同步放化疗后的相关不良反应主要以胃肠道反应、粒细胞减少、放射性肺炎等最常见。观察组出现3级或更高的胃肠道反应发生率显著低于对照组(P=0.036);观察组患者粒细胞减少的发生率明显高于对照组(P=0.033);两组均有出现较高的放射性肺炎发生率(74.4%和75.8%,P=0.898),但3级或更高的放射性肺炎发生率较低(15.4%和12.1%,P=0.898)。两组中出现的其余不良反应无显著性差异(P>0.05)。

表3 两组新辅助治疗后不良反应发生率比较[n(%)]
2.3 围手术期情况
观察组、对照组患者经术前新辅助同步放化疗后,其手术R0切除率分别为94.9%、93.9%,切缘阴性,术后30 d内无死亡。两种方案的手术并发症发生率无显著差异;观察组和对照组的术中出血量、淋巴结清扫个数、手术时间、病理分期等均无统计学差异;两组患者在随访内仅4例出现了较严重的术后并发症,且两组术后并发症无统计学差异,患者经过对症支持治疗后就能有所缓解。
2.4 远期疗效
入组患者随访截至2018年9月30日,随访率100%,存活患者平均随访时间为26.3个月,无失访病例。观察组1年和2年生存率分别为79.5%、59.0%、1年和2年无进展生存率分别为74.4%、53.8%,对照组1年和2年生存率分别为75.8%、54.5%、1年和2年无进展生存率分别为69.7%、45.5%,但两组均无显著性差异。如图1、图2所示。
3 讨论
食管癌是我国高发的恶性肿瘤之一,90%以上的患者是鳞状细胞癌[7],而受生活环境、经济条件、主观意识等众多因素的影响,大量患者临床确诊时已发展至中晚期。研究表明,对于局部晚期可手术食管癌,采用新辅助同步放化疗联合手术是首选的标准治疗方案,是提高局部晚期食管癌患者生存率的必要手段[8]。术前新辅助放化疗的优势包括消除或控制潜在的微小癌和亚临床病灶;增加放射敏感性;缩短治疗时间;可以不同程度减轻肿瘤负荷和组织反应性水肿,使肿瘤降期和缩小的效果,从而提高R0切除率,其化疗药物强度及用药剂量、放疗剂量均应比单纯同步放化疗低;在治疗上,同步放化疗相互促进,可增加局部疗效的作用等[9-10],此外,术前新辅助放化疗患者的耐受性好,不良反应小。

表4 两组围手术期指标比较

图1 观察组和对照组总生存曲线比较
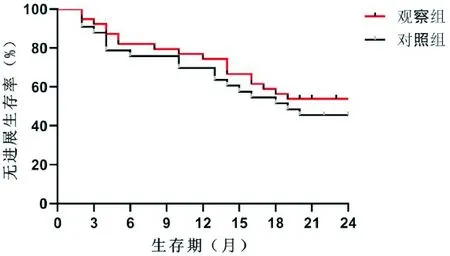
图2 观察组和对照组无进展生存曲线比较
根据目前的临床证据,对于局部晚期可手术的食管鳞状细胞癌或腺癌患者,新辅助CRT与单纯手术相比具有更高的生存率[11]。Walsh等[12]随机选择113例局部晚期食管腺癌患者接受单纯手术或术前顺铂、5-FU和40Gy的放疗。新辅助组的中位生存率和3年生存率明显好于化疗组(分别为16个月和32%vs11个月和6%;P=0.01),化疗组获得25%的病理完全缓解,证实了新辅助治疗的重要性,同样荷兰CROSS-Ⅲ期试验,也证实了患者获得了较长的生存期(实验组和手术组平均分别为49个月和26个月)。目前主要的新辅助化疗方案有顺铂加5-氟尿嘧啶或紫杉醇或卡培他滨或替吉奥,奥沙利铂加5-氟尿嘧啶或卡培他滨或替吉奥等,其疗效及不良反应差异较大。对于晚期食管癌患者,目前常采用化疗组合有顺铂加氟尿嘧啶、卡铂或顺铂加紫杉醇、紫杉醇加顺铂和氟尿嘧啶的三联方案等[13]。顺铂加氟尿嘧啶是食管癌同步放化疗的标准经典方案,但其肾毒性及胃肠道反应发生率较重,临床应用受到局限[14]。新辅助治疗的多模式策略有望得到持续的重点研究,集中资源开发最有效的新辅助CRT方案,以期在晚期食管癌患者的个体化治疗中取得更好的效果。Athauda等[15]基于卡铂在晚期非小细胞肺癌中的优势,尝试在食管胃癌根治性放化疗中用低毒性的卡铂替代顺铂,但临床结果表明,患者的PCR和PFS并无显著改善,仍然缺乏更多前瞻性的随机研究。
对于同步化疗方案,鉴于东西方食管癌患者在治疗策略上存在较大差异,而且在流行病学、肿瘤生物学等方面存在明显差异,现行的食管癌肿瘤学临床实践指南(NCCN指南)主要也是基于西方人群的研究,根据临床研究结果,中国肿瘤学家认为顺铂比卡铂更有效,首选顺铂联合氟尿嘧啶或紫杉醇[16-18]。
多年来,以紫杉醇为基础的治疗方案已经被广泛应用于食管癌患者的同步放化疗中,并在转移性食管癌治疗中取得了令人满意的结果。但随着顺铂加紫杉醇的联合应用,胃肠道反应率较重的担忧得到了进一步解决,患者的耐受性也更好,疗效更佳。张东峰等[19]研究表明,顺铂加紫杉醇的化疗组合,其毒副作用相对较大,但均可耐受,提示部分患者需减量化疗。此外,研究证实,食管癌单用紫杉醇治疗的有效率为 17%~31%,也可用铂类联合紫杉醇作为局部晚期食管癌一线化疗失败后的有效补充治疗方案[20]。根据日本临床肿瘤组9907(JCOG9907)试验结果,对于局部晚期食管癌,日本推荐新辅助化疗方案顺铂加5-氟尿嘧啶两个疗程,然后再行食管切除术和D2淋巴结切除术,与术后相比,术前化疗方案具有剂量强度优势,研究结果表明,紫杉醇、顺铂和氟尿嘧啶的三联和形式治疗方案,虽然血液性毒性更显著,但在术后病理缓解率方面显著优于顺铂加氟尿嘧啶组,其长期预后还需要持续关注。另外,以卡铂和紫杉醇为代表的新辅助化疗联合41.4Gy同期放疗(JCOG1109)在一些西方国家已经显示出了良好的结果,其方案毒性较低,在缓解率和长期生存率方面无显著差异。国内陈广家等[21]研究表明,采用周剂量顺铂加紫杉醇同步放化疗局部晚期食管癌中Ⅰ、Ⅱ级白细胞减少发生率仅为 25%,患者的耐受性好。Liu等[22]评价紫杉醇联合顺铂和5-氟尿嘧啶联合顺铂作为晚期食管鳞癌一线化疗的安全性和有效性,结果表明粒细胞减少是两种治疗方案最常见的毒性反应;对照组粘膜炎的发生率明显高于观察组,观察组的中位PFS更长(P=0.204),此外两组患者的ORR、OS无显著性差异。另外,近期不少研究显示,以紫杉醇为基础的TP方案与基于氟尿嘧啶的FP方案疗效相当,甚至更优[23-24]。
本研究结果表明,顺铂加紫杉醇方案的局部晚期食管癌新辅助放化疗方案并不亚于顺铂加氟尿嘧啶方案,但不能改善患者的OS或PFS。其中,观察组和对照组的RO切除率分别94.9%、93.9%(P>0.05),观察组1年和2年生存率分别为79.5%、59.0%,1年和2年无进展生存率分别为74.4%、53.8%,对照组1年和2年生存率分别为75.8%、54.5%,1年和2年无进展生存率分别为69.7%、45.5%(P>0.05);肿瘤术后pCR率43.6%、39.4%(P>0.05);但观察组的粒细胞减少发生率高于对照组(P<0.05),但经给予升白细胞药后患者均可耐受;对照组胃肠道反应发生率高于观察组(P<0.05),予以常规止吐后患者均可耐受;其余不良反应,两组无统计学差异,与之前报道的结果相似[24-25]。
综上所述,我们的研究表明,对于局部晚期可手术的食管癌患者,采用顺铂加紫杉醇和顺铂加氟尿嘧啶两种标准的新辅助放化疗方案联合手术,均可提高患者的R0切除率,安全性高,不良反应均可耐受且可控制,OS和PFS是相似的;此外,顺铂加紫杉醇方案可提高PCR率,患者发生肾毒性及胃肠道反应较低,但粒细胞减少发生率较高,并不会显著延长OS和PFS。
然而,因本研究样本数局限,以及随访时间较短,采用该治疗方案的患者其远期生存率、不良反应还需进一步观察,需要进一步的前瞻性临床试验和更大样本量的回顾性研究。
