孕妇血清THBS-1,AT-Ⅲ和25(OH)D表达水平对产后出血的预测价值分析
2021-08-10刘慧丽王雪莹姚莉芸石国素唐连敏郝俊兰
刘慧丽,王雪莹,姚莉芸,石国素,唐连敏,郝俊兰
(邢台市第三医院产一科,河北邢台 054000)
产后出血(postpartum hemorrhage,PPH)是妊娠晚期严重并发症之一,为全球范围内孕产妇死亡的主要原因,同时还可引起席汉综合征、生育力丧失、急性肾功能衰竭、弥散性血管内凝血、休克、急性呼吸窘迫综合征等严重并发症,严重威胁孕产妇生命安全[1],绝大多数PPH 导致的孕产妇死亡是可避免的,其关键在于早期预测。研究表明[2],子宫内膜出血、凝血功能障碍、子宫收缩乏力在PPH 发生中扮演重要角色。血小板反应蛋白1(thrombospondin-1,THBS-1)是一种细胞外基质蛋白,参与血管生成调节,高表达THBS-1 可促进子宫内膜细胞增殖,引起血管生成障碍,诱发子宫内膜出血[3]。抗凝血酶-Ⅲ(antithrombin-Ⅲ,AT-Ⅲ)是一种单链糖蛋白,参与维持机体凝血功能平衡,一旦失衡则会增加血栓形成风险,损伤血管内皮,引起出血[4]。25 羟维生素D[25-hydroxyvitamin D,25(OH)D]为机体维生素D(vitamin D,VD)主要存在形式,研究发现钙离子在维持子宫平滑肌舒张、收缩能力中发挥重要作用[5]。本研究就分析孕产妇血清THBS-1,AT-Ⅲ,25(OH)D 水平变化,探讨其与PPH 的关系,并进一步分析PPH 危险因素。
1 材料与方法
1.1 研究对象 选取邢台市第三医院产一科(2018年1月~2019年1月)收治的118 例住院分娩孕产妇,根据分娩后是否PPH 分为两组,PPH 组40 例,年龄20~34 岁,中位年龄27(25,30)岁;孕周32~42周,中位39(36,42)周;体质量45~60kg,中位51(49,53)kg;产次:2 例1 次,38 例≥2 次;分娩方式:19 例自然分娩,21 例剖宫产;11 例胎盘早剥,8 例前置胎盘。无PPH 组78 例,年龄20~34岁,中位年龄28(26,30)岁;孕周33~42 周,中位39(36,42)周;体质量43~60kg,中位52(49,54)kg;产次:5 例1 次,73 例≥2 次;分娩方式:49 例自然分娩,29 例剖宫产;9 例胎盘早剥,8 例前置胎盘。两组孕产妇年龄、孕周、体质量、产次、分娩方式、前置胎盘比例、剖宫产史对比差异无统计学意义(P>0.05)。
纳入标准:①单胎、足月、头正位者;②临床资料完整者;③PPH 符合美国妇产科医师协会定义标准[6]:产后24h 内失血量≥1 000ml 或伴有低血容量症状、体征;④产妇及家属均知情同意;⑤年龄<35 岁;⑥无产后大出血史者。排除标准:①先天畸形者;②心肝肾功能障碍者;③凝血功能异常者;④妊娠并发症者;⑤并发急性心脑血管疾病者。本研究经伦理委员会批准。
1.2 仪器与试剂 THBS-1,AT-Ⅲ,25(OH)D 酶联免疫吸附法试剂盒(上海研生实业有限公司),货号:FT-P32585R,YS-E8549,YS-E6841;酶标仪:南京华东电子集团医疗装备有限责任公司,型号:DG5031。
1.3 方法 采集两组产妇分娩前5 ml空腹静脉血,3 000r/min 离心10 min,半径8 cm,分离血清,酶联吸附法测定THBS-1,AT-Ⅲ,25(OH)D 水平,所有操作严格按照试剂盒说明书进行。
1.4 统计学分析 选用SPSS26.0 统计学软件,计数资料以n(%)表示,χ2或Fisher 检验;正态分布且方差齐计量资料以均数±标准差(±s)表示,两组间t检验;偏态分布或方差不齐计量资料以M(QL,QU)表示,两组间Z检验;多因素Logistics回归分析产妇PPH 危险因素;ROC 曲线分析血清THBS-1,T-Ⅲ,25(OH)D 水平对产妇PPH 的预测价值,曲线下面积(area under curve,AUC)采用Z检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组孕产妇流产史、剖宫产、宫缩乏力、软产道损伤、产程延长情况对比 见表1。PPH 组流产史比例、剖宫产史比例、宫缩乏力比例、软产道损伤比例、产程延长比例均多于无PPH 组,差异有统计学意义(P<0.05)。

表1 两组孕产妇流产史、剖宫产、宫缩乏力、软产道损伤、产程延长情况对比[n(%)]
2.2 两组孕产妇血清THBS-1,AT-Ⅲ,25(OH)D 水平对比 PPH 组血清THBS-1 水平明显高于无PPH 组[290.00(249.61,339.86)]μg/L vs 256.65(232.13,282.93)μg/L],AT-Ⅲ(72.44%±9.50% vs 85.89%±13.02%),25(OH)D(11.46±2.65ng/ml vs 14.27±3.34ng/ml)水平明显低于无PPH 组,差异均有统计学意义(Z=-3.479,t=-5.785,-4.946,P=0.001,<0.001,<0.001)。
2.3 产妇PPH 危险因素的多因素Logistics 回归分析 见表2。以流产史(有=1;无=0)、分娩方式(自然分娩=1;剖宫产=0)、胎盘早剥(是=1;否=0)、宫缩乏力(是=1;否=0)、软产道损伤(是=1;否=0)、产程延长(是=1;否=0)、THBS-1,AT-Ⅲ,25(OH)D 为自变量,是否PPH 为因变量(是=1;否=0),多因素Logistics 回归分析显示,宫缩乏力、软产道损伤、产程延长、THBS-1 为产妇PPH 独立危险因素,AT-Ⅲ,25(OH)D 为独立保护因素(P<0.05)。
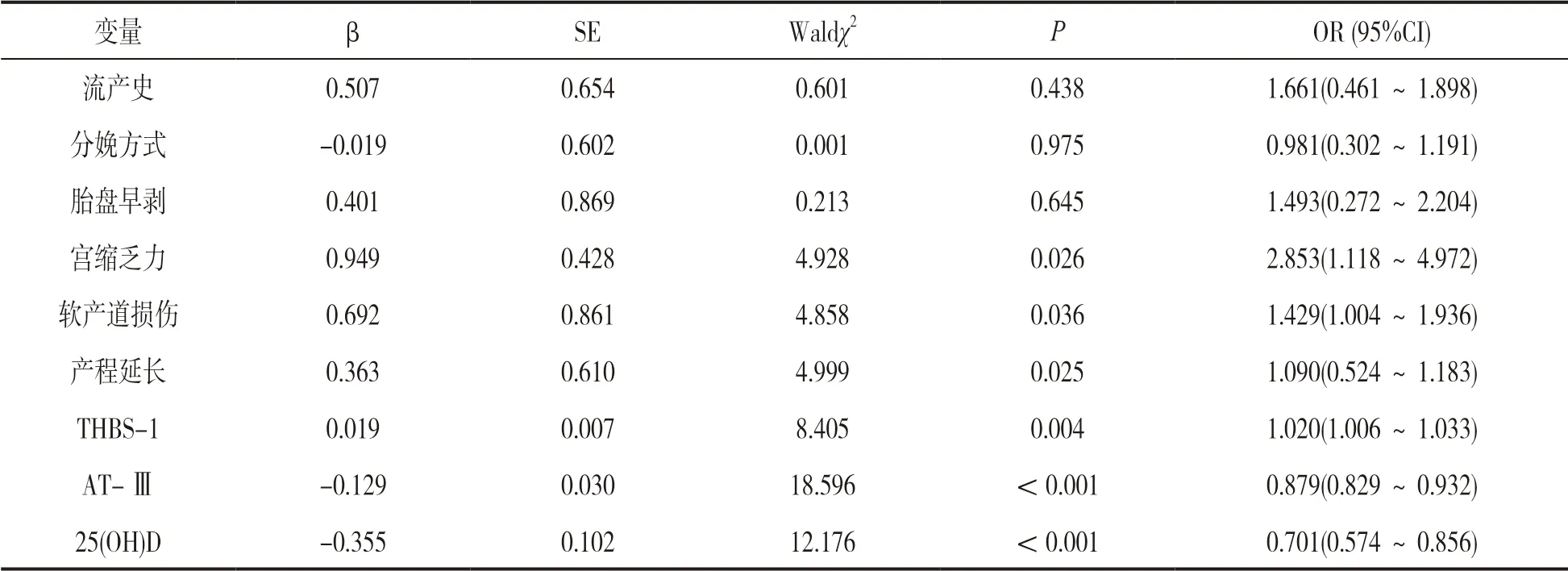
表2 产妇PPH 危险因素的多因素Logistics 回归分析
2.4 血清THBS-1,AT-Ⅲ,25(OH)D 水平对产妇PPH 的预测价值 见表3、图1。ROC 曲线显示,THBS-1+AT- Ⅲ+25(OH)D 联合预测产妇PPH 的AUC 明显大于THBS-1,AT-Ⅲ,25(OH)D 单项预测(Z=4.515,2.853,1.993,P=0.000,0.004,0.046)。
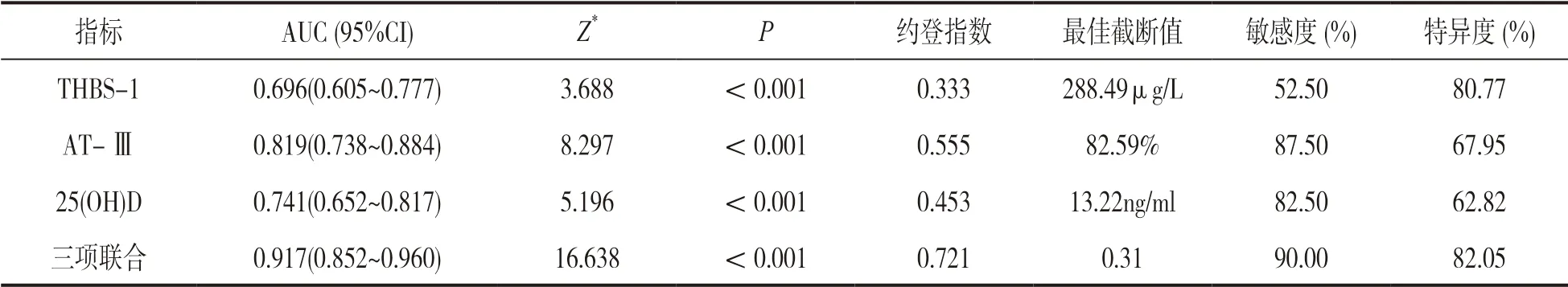
表3 血清THBS-1,AT-Ⅲ,25(OH)D 水平对产妇PPH 的预测价值

图1 血清THBS-1,AT-Ⅲ,25(OH)D 水平预测产妇PPH 的ROC 曲线
3 讨论
PPH 严重威胁孕产妇生命安全,近年来其发生率有上升趋势,尽管目前PPH 的诊断和治疗取得了一定进展,但其仍然是我国乃至全球范围内孕产妇死亡主要原因,因此及早识别PPH 对降低孕产妇死亡率至关重要。
THBS-1 为血小板反应蛋白家族一员,最早由凝血酶刺激血小板α 颗粒发现,后续研究发现其是一种内源性血管生成抑制因子,具备多种生物学功能,包括肿瘤细胞生长和转移、组织修复、胚胎发育、血小板激活和聚集、细胞凋亡、新生血管形成等[7]。近年研究发现,THBS-1 还是一种多功能细胞外基质蛋白,其不同结合位点可结合相应的细胞表面受体,发挥多种生物学功能[8-9]。胎盘血管形成过程中血管机能不全为流产主要原因,冯六连等[10]研究发现,复发性流产患者血清THBS-1 表达明显提升,说明高水平THBS-1 可抑制血管生成,影响胚胎种植,导致流产。试验给予卵巢去势大鼠外源性雌激素,形成无排卵性功能失调性子宫出血模型,结果发现子宫内膜中THBS-1 表达明显提升,提示THBS-1异常表达与功能失调性子宫出血有关[11]。本研究结果显示,PPH 组血清THBS-1 水平明显高于无PPH组(P<0.05),提示THBS-1 可能参与了PPH 发生。进一步研究发现,高THBS-1 水平为产妇PPH 独立危险因素(P<0.05),说明随着血清THBS-1 水平的提升,PPH 发生风险越高,分析是THBS-1 具有抑制血管生成作用,随着其水平提升,可抑制子宫内膜细胞分裂增殖,影响血管形成,不利于内膜自我修复,导致子宫内膜出血。
抗凝血酶为丝氨酸蛋白酶抑制剂超家族成员,主要由肝脏合成,可通过抑制活化凝血因子Ⅱ,Ⅸ,Ⅹ,Ⅺ,Ⅻ发挥抗凝作用[12]。AT-Ⅲ为抗凝系统主要成分,占总活性70%~80%,参与维持机体凝血系统与抗凝血系统的平衡,当机体凝血活性提升时,会大量消耗AT-Ⅲ,因此AT-Ⅲ是评估凝血功能的可靠指标[13]。既往大量研究大多将其应用于脑梗死领域,发现脑出血后血清中AT-Ⅲ表达明显降低,失去抗凝血作用,血液处于高凝状态,加速血栓形成[14]。凝血功能异常为PPH 发生主要因素,近期研究发现[15],PPH 患者血清AT-Ⅲ表达降低,与本研究结果一致,且为产妇PPH 独立保护因素(P<0.05),说明低血清AT-Ⅲ水平会增加PPH 发生风险,分析是血清AT-Ⅲ水平越低,凝血-抗凝血系统失衡越严重,导致凝血功能障碍,血液经久不凝,出血量增加,同时大量出血又会消耗过量血小板和凝血因子,继发纤溶亢进,加重凝血功能障碍。
VD 是种脂溶性维生素,具有调节磷、钙代谢和调节免疫力、促进骨骼发育等作用,生理状态下,VD 能结合其受体,提升机体内钙磷水平,增加骨密度,促进骨骼发育以及维持骨骼肌、平滑肌神经电活动等作用[16]。25(OH)D 为机体VD 主要存在形式,在血液中含量为活性形式1,25 二羟维生素D3的1 000 倍,且具有较高的半衰期,因此其性质稳定,且其不受生活方式和饮食直接影响,故临床常通过检测25(OH)D 水平反映机体VD 表达情况。近年研究发现[17],钙离子与子宫收缩能力相关,妊娠期间子宫体胎盘黏连的部分肌细胞肥大,胞浆内充满具备收缩性能的肌浆球蛋白和肌动蛋白,而钙离子进入肌细胞后可结合肌浆球蛋白和肌动蛋白,促进子宫收缩和舒张,以对子宫壁血管压迫止血,且肌肉收缩复始也会曲折子宫壁血管,利于阻滞血流。此外,钙离子对应凝血因子Ⅳ,可发挥凝血作用,利于子宫胎盘剥离面血栓形成,降低出血量[18]。本研究结果显示,PPH 组血清THBS-1 水平明显高于无PPH 组(P<0.05),其VD 含量的降低可能与胎儿对钙的需求量增加、妊娠晚期甲状腺水平提升引起钙表达异常、肾小球滤过率增加导致钙排泄增加、孕期母体血容量增加导致血钙降低等有关[19]。结果显示,25(OH)D 为产妇PPH 独立保护因素(P<0.05),符合上述报道机制,说明血清25(OH)D 水平降低会增加PPH 风险。结果还显示,宫缩乏力、软产道损伤、产程延长为产妇PPH 危险保护因素(P<0.05),分析是宫缩乏力导致血窦大量开放,引起子宫下段剥离面活跃出血,同时软产道损伤促进血窦大量开放,产程延长会增加宫缩乏力几率[20]。也有研究报道,流产史、分娩方式、胎盘早剥为PPH 危险因素,但本研究多因素分析无相关,可能与本研究样本量和病例选择有关。结果显示,THBS-1,AT-Ⅲ,25(OH)D 预测产妇PPH的AUC 均明显大于真区域(P<0.05),敏感度和特异度分别为52.50%,80.77%;87.50%,67.95%;82.50%,62.82%。说明THBS-1,AT-Ⅲ,25(OH)D均对PPH 具有一定预测价值,而三项联合AUC,敏感度、特异度更高,说明联合检测血清THBS-1,AT-Ⅲ,25(OH)D 水平可提升PPH 预测价值。
由此可见,PPH 产妇血清THBS-1 水平明显提升,AT-Ⅲ,25(OH)D 水平明显降低,为PPH 独立影响因素,联合检测可提升PPH 预测价值。
