基于溶剂、DPP荧光体及底物间相互作用机理的醇、水高选择性化学传感器的制备及性能测试
2021-08-09孙跃禹刘新豪程晓红
葛 涛,常 清,孙跃禹,刘新豪,程晓红
(云南大学 教育部自然资源药物化学重点实验室与天然产物研发中心,化学科学与工程学院,云南 昆明 650500)
区分具有相似理化性质特性的溶剂,例如甲醇和乙醇,是目前人们需要解决的一个具有挑战性的问题.乙醇饮品中的微量甲醇会导致饮用者失明甚至失去生命[1],但是由于甲醇和乙醇的化学结构十分相似,在不使用化学分析手段(如核磁,质谱等)的情况下,要区分它们是十分困难的.区分溶剂及溶剂蒸汽的方法常见的有以下4 种:吸附法[2],溶剂变色法[3],化学反应[4]以及扩散法[5],尽管这些方法均有效果,但都需要复杂的仪器设备、复杂的测量程序、繁琐的数据处理及针对特定化学反应定制检测材料.另外,酒驾是危害社会治安的一大现象,检测酒驾是惩罚酒驾减少危害的重要措施.
吡咯并吡咯二酮(DPP)衍生物是颜色鲜艳的染料,由于DPP 类衍生物良好的光热稳定性、高的荧光量子产率和强的荧光发射,在有机发光二极管、聚合物太阳能电池、染料敏化太阳能电池和有机场效应晶体管等领域具有广泛应用[6-9].近年来,DPP 类衍生物用于传感器的研究也逐渐被报道[10-12].DPP 衍生物作为荧光探针已经用于F-、CN-等阴离子及过渡金属离子等的检测,但用于醇类和水的检测却鲜有报道[13,14].这些传感器的识别机理大多是基于DPP 探针与特定分析物间相互作用导致DPP 探针光物理性质的改变,从而实现检测.这些变化与各种信号机制相关,例如荧光增强/淬灭和比例分析探针与特定分析物相互作用导致的变化(例如,路易斯酸碱相互作用,去质子化,光诱导电荷转移,能量转移,分子间过程,激发态质子转移等).基于DPP 荧光分子、硅胶基质和溶剂分析物之间的相互作用机制制备的传感器文献到目前为止只有1 篇[13],且仅考察了DPP 结构中烷基链长度对识别的影响.
鉴于检测区分甲醇,乙醇等的重要性,本文设计合成3 种带不同取代基的吡咯并吡咯二酮(DPP)衍生物,即DPP 结构中内酰胺氮上带有3 种极性不同的取代基,即多醚链(D-PEO),叔丁酯基(DBoc)和烷基链(D-C12).通过简单的DPP 滴铸法制造出新型便捷的能用裸眼区分乙醇、甲醇和水的传感器,即D-PEO+Si,D-Boc+Si 和D-C12+Si,考察了 取代基极性对传感器识别作用的影响.
1 实验部分
1.1 仪器与试剂核磁共振谱采用Bruker DRX-400 测试;元素分析仪器为Vario EL,荧光光谱分析用Hitch F-4500FL 测试;柱层析及薄层层析硅胶均为青岛海洋化工厂生产.试剂均为商品化分析纯,使用前,THF 用Na 进行干燥,DMF 和氯仿用氢化钙 进行干燥.
1.2 实验过程合成路线见图1.
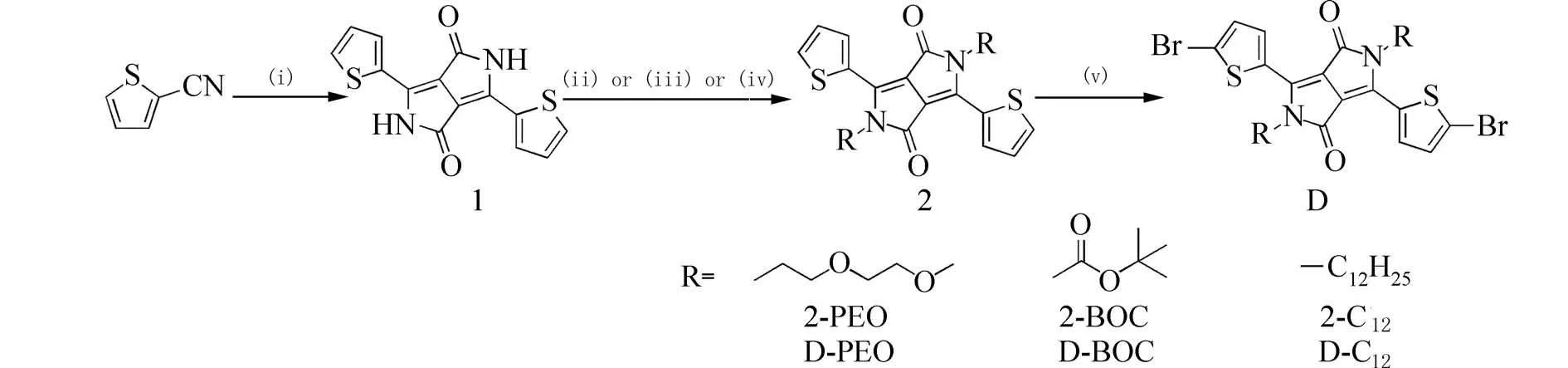
图1 DPP 衍生物的合成Fig.1 Synthesis of DPP derivatives;Reagents and conditions:i)Na,FeCl3,Diisopropyl succinate,2-Methyl-2-Butanol,110 ℃,16 h;ii)2-(2-methoxyethoxy)ethyl 4-methylbenzenesulfonate,Tetrabutylammonium bromide,K2CO3,DMF,120 ℃,12 h;iii)Di-tert-butyl dicarbonate,DMAP,THF,N2,RT,12 h;iv)1-Bromododecane,K2CO3,DMF,120 ℃,12 h;v)NBS,CHCl3,0 ℃,1 h.
1.2.1 化合物3,6-二噻吩-2,5-二氢吡咯并吡咯二酮1的合成 按文献[15,16]合成,谱图与文献报道 一致.
1.2.2 化合物2,5-双(2-(2-甲氧基乙氧基)乙基)-3,6-二噻吩-2,5-二氢吡咯并吡咯二酮2-PEO的合成 按文献[17,18]合成.N2条件下,在配有回流装置的100 mL 三口瓶中加入化合物1(200 mg,0.67 mmol),K2CO3(460 mg,3.33 mmol)和四丁基溴化铵(50 mg),加入20 mL 无水DMF 使其溶解,通15 min N2,加入溶于5 mL 无水DMF 的二乙二醇单甲醚对甲苯磺酸酯(913 mg,3.33 mmol),再通10 min N2后于120 ℃下反应40 h,TLC 监测反应.反应结束后,用二氯甲烷萃取有机层,合并有机层,无水硫酸钠干燥,减压浓缩除去溶剂.柱层析分离提纯[V(石油醚):V(二氯甲烷)=1∶3 ],得到暗紫色固体192 mg,产率57%.1H NMR(400 MHz,CDCl3)δ:8.75~8.74(m,3.9 Hz,2H,Ar-H),7.64~7.93(m,5.0 Hz,2H,Ar-H),7.27~7.25(t,4.5 Hz,2H,Ar-H),4.30~4.27(t,6.4 Hz,4H),3.81~3.78(t,6.4 Hz,4H),3.65~3.62(m,6.3 Hz,4 H),3.50~3.47(m,4.9 Hz,2H),3.32(s,6H).
1.2.3 化合物1,4-二氧二叔丁基-3,6-二噻吩吡咯并吡咯二酮2-BOC 和1,4-双十二烷氧基-3,6-二噻吩吡咯并吡咯二酮2-C12的合成 参考文献[19,20]和 [21]合成,谱图与文献报道一致.
1.2.4 化合物3,6-二溴噻吩-2,5-二(2-(2-甲氧基乙氧基)乙基)-2,5-二氢吡咯并吡咯二酮DPEO 的合成 将化合物2-PEO(192 mg,0.38 mmol)溶解于30 mL CHCl3中,在冰浴条件下将NBS(149 mg,0.84 mmol)分批次加入到反应液中,在黑暗条件下搅拌1 h,TLC 监测反应,反应完全后,将反应液倒入40 mL 甲醇中,搅拌20 min,过滤洗涤固体.将滤饼在真空中干燥,得到暗紫色固体209 mg,产率83%.1H NMR(400 MHz,CDCl3)δ:8.48~8.47(m,4.2 Hz,2H,Ar-H),7.21~7.20(m,4.1 Hz,2H,Ar-H),4.19~4.16(t,6.0 Hz,4H),3.79~3.76(t,6.0 Hz,4H),3.63~3.61(m,6.3 Hz,4H),3.50~3.47(m,4.9 Hz,2H),3.33(s,6H).13C NMR(100 MHz,CDCl3)δ:161.3,139.4,134.8,131.3,131.01 119.3,107.9,71.8,70.5,68.8,59.0,42.3.元素分 析(C24H26Br2N2O6S2,662.41,w/%)计算值:C 4 3.52,H 3.96;实验值:C 43.45,H 3.89.
1.2.5 化合物1,4-二氧二叔丁基-3,6-二溴噻吩吡咯并吡咯二酮D-Boc,1,4-双十二烷氧基-3,6-二溴噻吩吡咯并吡咯二酮D-C12的合成 参考文献[22,23]合 成,谱图与文献报道一致.
1.3 传感器的制备、荧光观察及量子产率计算将合成出来的3 种DPP 衍生物(D-PEO,D-Boc 和D-C12)分别溶于二氯甲烷中配制成1×10-3mol/L的溶液,再将溶液用毛细管滴到硅胶板上.于50 ℃下短暂加热除去溶剂,无需进一步处理即可作为传感器使用.将传感器浸入目标溶剂分析物(如:甲醇、乙醇、乙酸乙酯和水等溶剂分析物)中,在365 nm的紫外灯照射下观察浸入溶剂前后传感器颜色的变化,并将浸水的传感器进行荧光测试,按照φ=φd-(1-Ad)φi(φ为荧光量子产率,φd为直接激发时的荧光量子产率,Ad为直接激发时的吸收率,φi为间接激发时的量子产率)公式进行量子产率 的计算.
2 结果与讨论
2.1 DPP 传感器对各种溶剂的识别测试了3 个DPP 衍生物(D-PEO,D-Boc 和D-C12)制备的传感器对醇类、有机溶剂和水的识别性能[如图2(a),(b)和(c)],结果列于表1 中.

表1 传感器在各种溶剂分析物中荧光变化Tab.1 Sensor fluorescence changes in various solvent

图2 室温下,在365 nm 紫外灯下3 种传感器浸入不同溶剂中的荧光变化图Fig.2 Fluorescence changes of DPP sensors immersed in different solvents under 365 nm UV at room temperature
在365 nm 的紫外光照射下传感器D-PEO+Si呈现出亮黄色荧光,D-Boc+Si 为土黄色荧光,DC12+Si 为浅黄色荧光.传感器D-PEO+Si 在甲醇、正丁醇、乙酸乙酯、二氯甲烷和正己烷中均为亮黄色荧光,荧光颜色几乎没有变化,在乙醇和乙二醇中其荧光颜色呈现出金黄色,并且乙二醇中荧光较暗;传感器D-Boc+Si 在甲醇和乙二醇溶剂中其荧光会完全淬灭呈现为暗紫色,在乙醇溶剂中荧光颜色保持土黄色,在正丁醇、乙酸乙酯、二氯甲烷和正己烷中荧光由土黄色变为亮黄色,除正己烷外,传感器荧光向四周扩散;传感器D-C12+Si 在甲醇溶剂中荧光几乎完全淬灭并呈现为暗紫色,在乙醇中荧光部分淬灭呈现淡紫色且周围有较暗的浅黄色荧光,在乙二醇中荧光变弱为暗橙色,在正丁醇中荧光变为黄色,在乙酸乙酯、二氯甲烷和正己烷中荧光颜色分别为亮黄色、橙黄色、亮黄色.3 个传感器相同点在于在水溶剂分析物中荧光会完全淬灭并呈现为紫红色.荧光改变的原因是由于3种DPP 衍生物(D-PEO,D-Boc 和D-C12)的极性不同,因此化合物与硅胶之间形成的氢键结合能力也有很大不同,其中以D-PEO 的极性最大,D-Boc 的次之,D-C12的最小,所以D-PEO 与硅胶氢键结合最为紧密,超强极性的水溶剂能破坏其与硅胶之间氢键结合,将D-PEO 置换出来,置换出的D-PEO会发生聚集从而导致D-PEO 荧光淬灭;甲醇、乙二醇的极性足够引起D-Boc 和D-C12的荧光降低甚至消失,乙醇能使D-C12荧光部分淬灭,这是因为它们的极性刚好能够引起DPP 与硅胶之间氢键结合被破坏,溶剂与DPP 分子发生交换从而产生聚集引起荧光降低或淬灭[24].因此,传感器D-PEO+Si 可以明显地识别水;D-Boc+Si 可以识别水、甲醇和乙 二醇;D-C12+Si 对上述各种醇和水的识别效果最好.
2.2 DPP 传感器对水的循环识别将制备好的DPP 传感器浸没在水中(溶剂分析物)后[如图3(a),(b)和(c)所示],在365 nm 紫外灯照射下原来的黄色荧光完全淬灭,但是将浸没后的传感器于150 ℃下干燥后荧光又完全恢复,经荧光光谱测试发现,3 个DPP 衍生物浸没于水中后其荧光强度降到最低,接近于无荧光,但是将传感器中的水除去后,荧光强度又会恢复.因此将3 个化合物进行多次重复浸水干燥试验并对其荧光量子产率进行测试计算[如图4(a),(b)和(c)],发现3 个DPP 衍生物传感器在浸水之后量子产率在0.1%左右,接近于无荧光.而其中D-PEO+Si 在多次干燥后量子产率与没浸水之前都在14.5%左右,几乎没有任何变化,DC12+Si 的量子产率从原来的10.1%降到第1 次干燥的9%之后量子产率就没有明显变化.但是DBoc+Si 的量子产率却从原本的11.4%降到第1 次干燥后的8.1%,第2 次干燥后的6%,第3 次干燥后的2.4%,第4 次干燥后的1.2%,这是因为D-Boc会与硅胶相互作用并且其中的Boc 基团在高温下会脱去,因此在多次干燥时,其荧光量子产率会一直下降[25].从测试结果可以知道制备的传感器DPEO+Si 和D-C12+Si 可以循环使用,而D-Boc 只可以 制备成一次性的传感器.

图3 DPP 传感器的荧光光谱Fig.3 Fluorescence spectrum of DPP sensor

图4 DPP 传感器的量子产率Fig.4 Quantum yield of DPP sensor
3 结论
设计并制备了3 个新型的光学溶剂传感器,该系统是基于溶剂分析物、DPP 荧光衍生物和硅胶基质之间相互作用的改变导致荧光变化而开发的.DPP 衍生物中基团极性的改变会改变其与硅胶基质间的氢键相互作用以及它们与醇和水间的相互作用及溶解性,最终溶剂环境的改变导致DPP 衍生物在硅胶板上形成不同程度的聚集,从而产生荧光淬灭作为传感信号,因此通过简单的光学观察便可对溶剂进行检测[13].在研制的3 个DPP 衍生物传感器中,D-C12+Si 在各种醇溶剂分析物中荧光强弱都不一样,识别效果最好,D-Boc+Si 能够识别甲醇、乙二醇,D-PEO+Si 只能够识别乙醇;以水为溶剂分析物,测试了浸水前和干燥后的循环量子产率,结果表明,D-PEO+Si 和D-C12+Si 的荧光量子产率可以恢复,荧光可循环恢复,传感器可以循环使用,而D-Boc+Si 的量子产率会逐渐降低,荧光淬灭不可逆,不可以循环利用.所以无论化学结构如何相似,通过荧光变化传感器可以明显地区分乙醇、水以及对人体有害的甲醇并且可以做到循环利用.本文的研究为便捷、实惠的传感器的研究提供了新途径.
