植物乳杆菌抑制产肠毒素型大肠杆菌诱发猪肠上皮细胞炎症反应的分子机制
2021-08-09李海花梁东梅乔家运
李海花 梁东梅 乔家运*
(1.天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津 300384;2.天津师范大学生命科学学院,天津市动物多样性保护与利用重点实验室,天津 300387)
仔猪早期断奶是提高养猪生产效率常用的手段,但早期断奶容易造成仔猪胃肠功能紊乱,使得细菌性腹泻如大肠杆菌病经常发生,因此在实际生产中常在饲粮中添加抗生素来预防仔猪腹泻[1]。根据我国农业农村部2016年发布的数据显示,我国新生仔猪8.79亿头,其中大约有1.52亿头死于断奶后腹泻,导致损失高达240亿元,这给养猪业造成了巨大的经济损失[2]。当前,“禁抗令”已正式生效,原本利用抗生素预防腹泻的措施已禁止使用,因此,寻找抗生素替代品保护仔猪肠道健康显得尤为急迫和重要。乳酸菌具有调节肠道菌群平衡、预防仔猪腹泻、提高肠道健康的作用,已经作为一种安全的饲料添加剂被广泛应用。Toll样受体(Toll-like receptor,TLR)和NOD样受体(NOD-like receptor,NLR)是识别各种入侵病原体的模式识别受体,在先天免疫反应中起着关键作用[3]。TLR或NLR识别病原微生物后,通过上游信号级联反应,激活丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和核转录因子-κB(nuclear factor-κB,NF-κB)等关键蛋白,从而调控下游促炎性细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin-8,IL-8)和白细胞介素-1β(interleukin-1β,IL-1β)的生成,进而引起机体的炎症反应和细胞损伤[4]。乳酸菌具有抑制产肠毒素型大肠杆菌(enterotoxigenicEscherichiacoli,ETEC)引起的肠上皮细胞炎症反应的作用[5],然而其分子机制尚不是十分清楚。因此,本研究利用ETEC诱导的猪肠上皮细胞炎症反应模型,研究植物乳杆菌(Lactobacillusplantarum)对MAPK和NF-κB信号通路关键蛋白的调控作用,揭示植物乳杆菌调节猪肠上皮炎症反应的分子机制,为其在仔猪饲粮中的应用提供理论依据。
1 材料与方法
1.1 试验细胞和菌株
猪肠上皮细胞IPEC-J2购自上海冠导生物工程有限公司;ETEC K88和植物乳杆菌均为天津农学院动物医学与动物科学学院实验室保存。
1.2 试验试剂
RPMI 1640基础培养液、胎牛血清和二甲基亚砜(dimethyl sulfoxide,DMSO)等常用细胞培养相关试剂均购自美国Gibco公司,猪IL-1β、IL-8和TNF-α检测试剂盒均购自美国BD公司,猪乳酸脱氢酶(lactic dehydrogenase,LDH)检测试剂盒购自上海酶联生物科技有限公司,DNA和RNA核酸萃取试剂盒、反转录试剂盒和实时荧光定量PCR试剂盒均购买于美国GeneCpoeia公司,p38 MAPK抑制剂(SB-203580)、NF-κB p65抑制剂(BAY11-7082)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)MAPK抑制剂(SCH772984)购自美国MCE公司,抗闭合小环蛋白(zonula occludens,ZO)-1抗体和抗闭锁蛋白(occludin)抗体均购自Abcam公司,抗ERK MAPK抗体、抗磷酸化ERK-MAPK抗体、抗NF-κB p65抗体、抗磷酸化NF-κB p65抗体、抗p38 MAPK抗体、抗磷酸化p38 MAPK抗体和抗3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体均自美国CST公司。
1.3 促炎性细胞因子的检测
在本试验开始前,首先对植物乳杆菌使用的最佳剂量进行筛选,利用感染复数(multiplicity of infection,MOI)分别为0、1、10、30和100的植物乳杆菌作用IPEC-J2细胞3 h,检测培养上清液中IL-1β、IL-8和TNF-α的含量、细胞的形态变化以及植物乳杆菌黏附细胞的数量,依据细胞形态正常、无炎症反应和植物乳杆菌黏附细胞数量等因素确定植物乳杆菌的最佳使用剂量为MOI=30。
试验设以下处理:空白对照组(不进行处理)、ETEC组(ETEC刺激细胞)、植物乳杆菌+ETEC组(按顺序使用植物乳杆菌、ETEC刺激细胞)。 将IPEC-J2细胞接种于24孔培养板,用含10%胎牛血清和1%青链霉素的RPMI 1640培养液,在37 ℃和5% CO2条件下培养,待细胞融合度达到80%时,加入植物乳杆菌(MOI=30)预作用细胞3 h,在ETEC(1×103CFU/mL)分别作用IPEC-J2细胞3、6、12和24 h后,收集培养上清液,经3 000 r/min离心20 min后,按照IL-1β、IL-8和TNF-α检测试剂盒说明书进行上清液中促炎性细胞因子含量的检测。
1.4 TLR和NLR表达的测定
将IPEC-J2细胞接种于24孔培养板,待细胞融合度达到80%时,加入植物乳杆菌预作用细胞3 h,再用ETEC分别刺激细胞3、6、12和24 h,同时设立未处理的空白对照组和ETEC组,收集细胞。采用实时荧光定量PCR检测TLR2、TLR4、NLRP3、NLRP6和GAPDHmRNA相对表达量。相关引物设计、RNA提取及反转录、实时荧光定量PCR反应条件和相对定量法2-△△Ct法的计算参照Qiao等[6]的方法。
1.5 Western blot检测细胞中靶蛋白的表达
将IPEC-J2细胞接种于培养皿,待细胞融合度达到80%时,加入植物乳杆菌预作用细胞3 h,再用ETEC分别刺激细胞1、3、6和24 h,同时设立未处理的空白对照组和ETEC组,收集细胞。根据Qiao等[6]的Western blot检测方法,测定靶蛋白ZO-1和occludin的表达量以及NF-κB p65、ERK MAPK和p38 MAPK的磷酸化水平,同时检测内参GAPDH的表达量。用Gel-Pro analyzer软件分析各组上述蛋白条带浓度,并进行相对定量分析。
1.6 抑制剂处理细胞及其样品检测
将IPEC-J2细胞接种于24孔培养板,待细胞融合度达到80%时,分别用10 μmol/L的抑制剂SB-203580、SCH772984和BAY11-7082处理细胞1 h,置换培养液,加入植物乳杆菌处理细胞3 h,再用ETEC分别处理细胞24 h,分别收集培养上清液、细胞和凋亡小体。试验设以下处理:空白对照组(不进行处理)、ETEC组(ETEC刺激细胞)、抑制剂+ETEC组(按顺序用抑制剂、ETEC刺激细胞)、植物乳杆菌+ETEC组(按顺序使用植物乳杆菌、ETEC刺激细胞)和抑制剂+植物乳杆菌+ETEC组(按顺序使用抑制剂、植物乳杆菌、ETEC刺激细胞)。按照LDH试剂盒说明书进行上清液、凋亡小体和贴壁细胞中LDH活性的检测。细胞的损伤程度根据公式来评估,细胞毒性(%)=培养上清液中LDH活性/总LDH活性。IL-1β、IL-8和TNF-α含量的检测方法同上。
1.7 数据统计分析
利用Excel 2007对试验数据进行初步处理,采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),采用LSD法进行多重比较,采用GraphPad Prism 5软件进行图像处理及分析,试验结果用“平均值±标准差”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 植物乳杆菌对ETEC感染的猪肠上皮细胞产生促炎性细胞因子的影响
由表1可知,与空白对照组相比,ETEC组IL-1β、IL-8和TNF-α含量在6、12和24 h显著或极显著升高(P<0.05或P<0.01),TNF-α含量在3 h极显著升高(P<0.01),而IL-1β和IL-8含量在3 h均无显著变化(P>0.05)。与ETEC组相比,植物乳杆菌+ETEC组IL-1β含量在12和24 h极显著降低(P<0.01),在3和6 h均无显著差异(P>0.05),IL-8和TNF-α含量在24 h均极显著降低(P<0.01)。结果表明,ETEC感染促进猪肠上皮细胞产生促炎性细胞因子,植物乳杆菌能够降低ETEC诱导的促炎性细胞因子的含量。
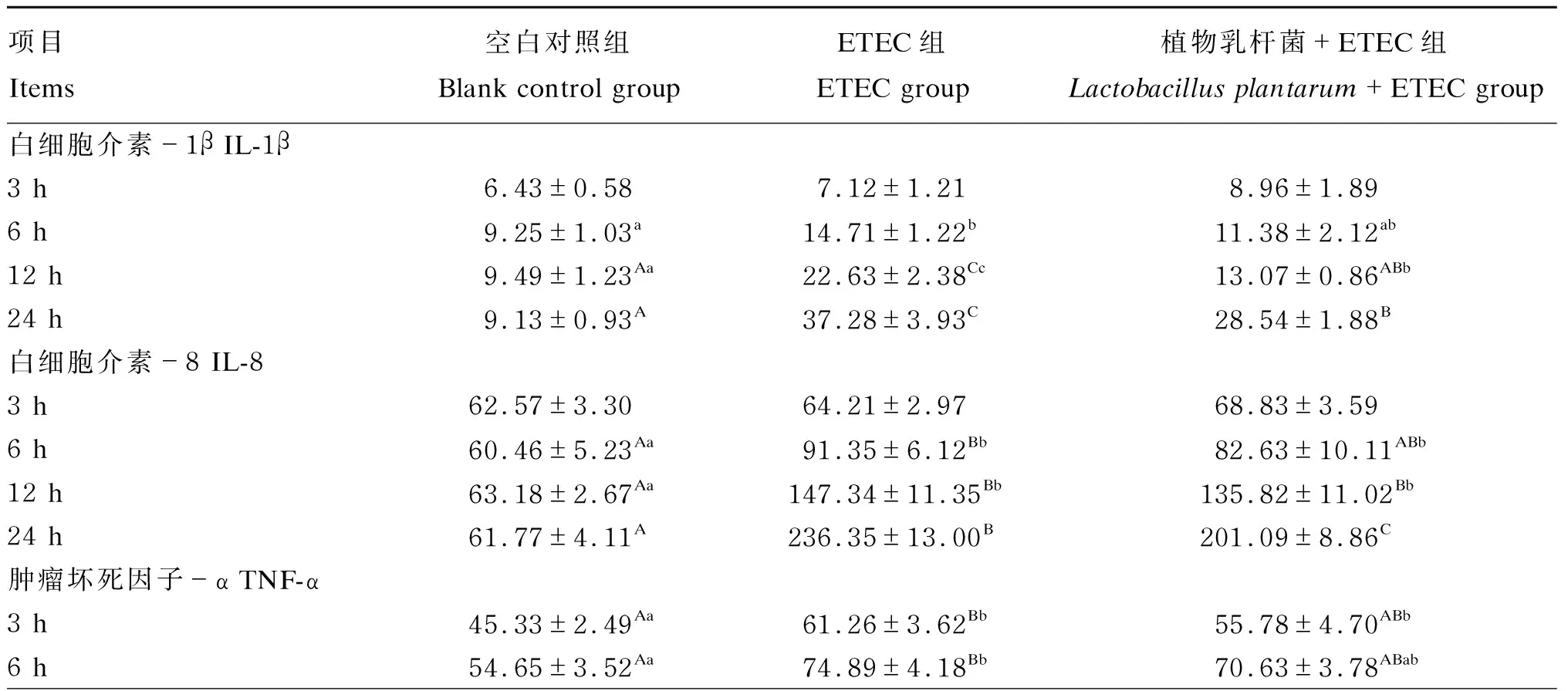
表1 植物乳杆菌对ETEC感染的猪肠上皮细胞产生促炎性细胞因子的影响
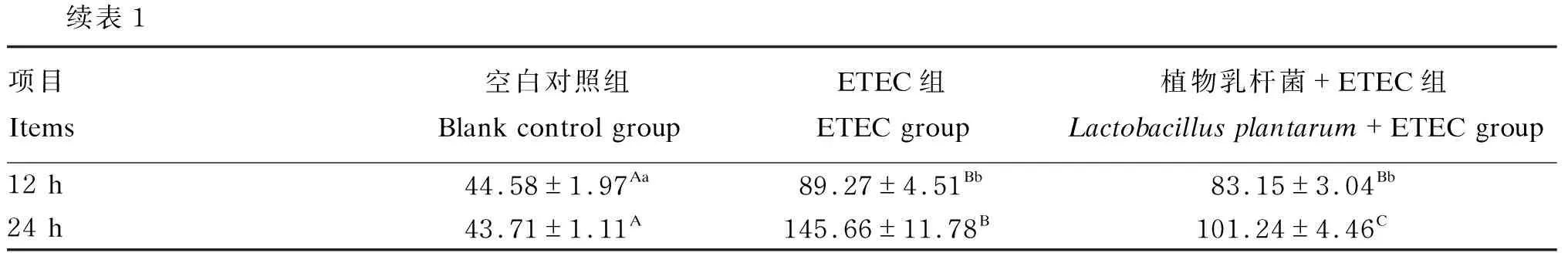
续表1项目 Items空白对照组 Blank control groupETEC组 ETEC group植物乳杆菌+ETEC组 Lactobacillus plantarum+ETEC group12 h44.58±1.97Aa89.27±4.51Bb83.15±3.04Bb24 h43.71±1.11A145.66±11.78B101.24±4.46C
2.2 植物乳杆菌对ETEC感染的猪肠上皮细胞TLR和NLR表达的影响
由表2可知,与空白对照组相比,ETEC组TLR2、TLR4、NLRP3和NLRP6 mRNA相对表达量在6、12和24 h显著或极显著升高(P<0.05或P<0.01),TLR4和NLRP3 mRNA相对表达量在3 h均极显著升高(P<0.01)。与ETEC组相比,植物乳杆菌+ETEC组TLR2 mRNA相对表达量在3和6 h均极显著升高(P<0.01),且在24 h极显著降低(P<0.01);TLR4 mRNA相对表达量在6和12 h均极显著升高(P<0.01),NLRP3和NLRP6 mRNA相对表达量在3和6 h显著或极显著升高(P<0.05或P<0.01),且NLRP3 mRNA相对表达量在12和24 h均极显著降低(P<0.01)。结果表明,ETEC感染促进猪肠上皮细胞表达TLR2、TLR4、NLRP3和NLRP6;植物乳杆菌能够在ETEC感染前期促进ETEC感染细胞表达微生物识别受体,在感染后期能够降低ETEC诱导的受体表达。
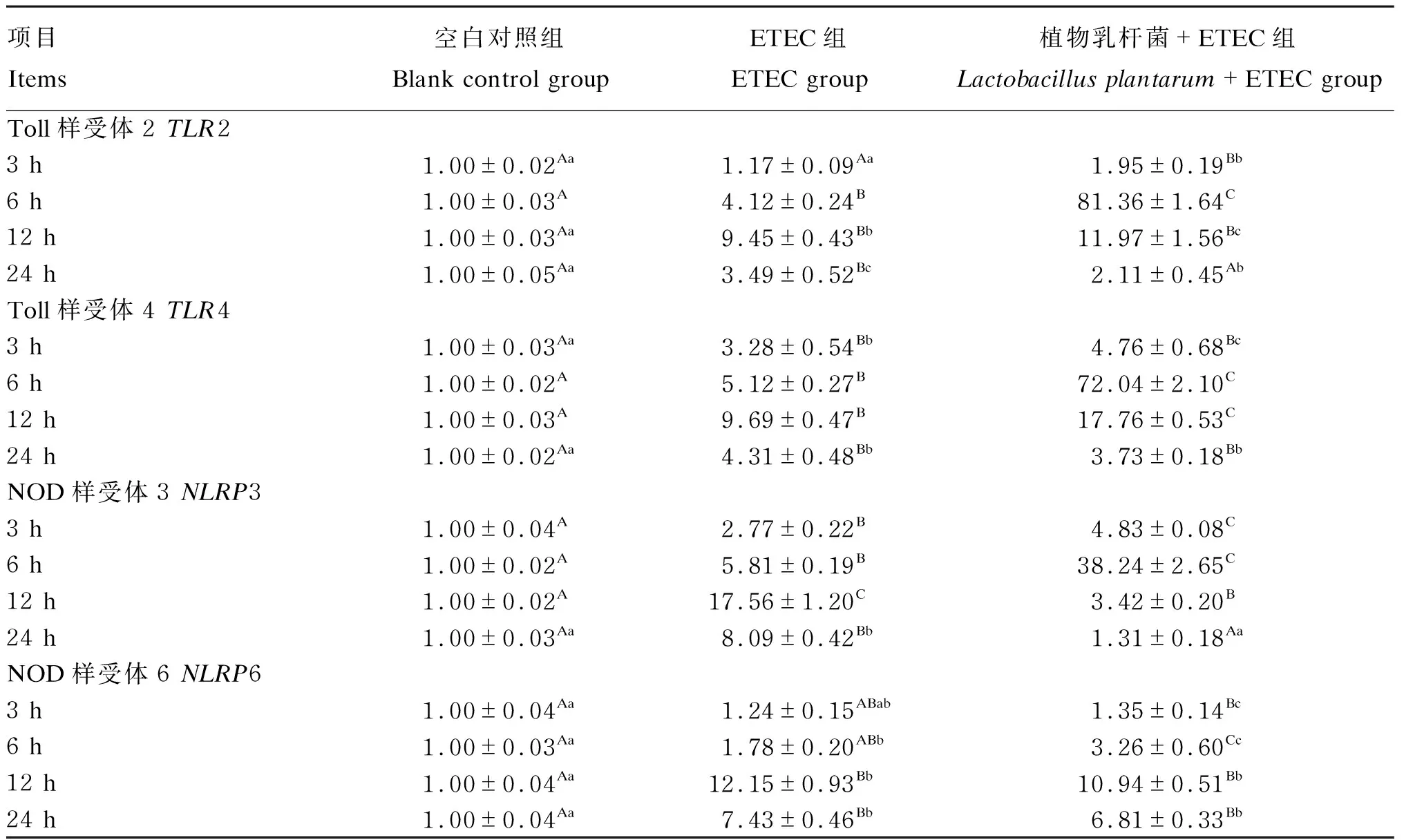
表2 植物乳杆菌对ETEC感染的猪肠上皮细胞TLR和NLR表达的影响
2.3 植物乳杆菌对ETEC感染的猪肠上皮细胞中MAPK和NF-κB磷酸化的影响
由图1可知,与空白对照组相比,ETEC组ERK-MAPK磷酸化水平在3 h显著升高(P<0.05),在6 h极显著降低(P<0.01);p38 MAPK磷酸化水平在3 h极显著升高(P<0.01),在1和6 h均无显著变化(P>0.05);NF-κB p65磷酸化水平在1、3和6 h显著或极显著升高(P<0.05或P<0.01)。与ETEC组相比,植物乳杆菌+ETEC组ERK-MAPK磷酸化水平在1和3 h显著或极显著升高(P<0.05或P<0.01),在6 h无显著变化(P>0.05);p38 MAPK和NF-κB p65磷酸化水平在3和6 h均极显著降低(P<0.01),在1 h无显著变化(P>0.05)。结果表明,ETEC感染引起细胞中ERK-MAPK、p38 MAPK和NF-κB p65磷酸化水平升高,植物乳杆菌不仅能降低ETEC诱导的p38 MAPK和NF-κB p65的磷酸化水平,还可提高ETEC诱导的ERK-MAPK的磷酸化水平。
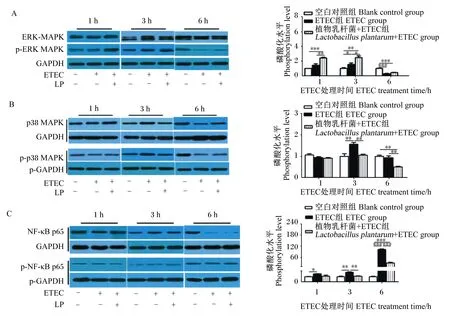
ERK-MAPK:细胞外信号调节激酶-丝裂原活化蛋白激酶 extracellular signal-regulated kinase-mitogen activated protein kinase;p-ERK MAPK:磷酸化细胞外信号调节激酶-丝裂原活化蛋白激酶 phospho-extracellular signal-regulated kinase-mitogen activated protein kinase;p38 MAPK:p38丝裂原活化蛋白激酶 p38 mitogen activated protein kinase;p-p38 MAPK:磷酸化p38丝裂原活化蛋白激酶 phospho-p38 mitogen activated protein kinase;NF-κB p65:核转录因子-κB p65 nuclear factor-κB p65;p-NF-κB p65:磷酸化核转录因子-κB p65 phospho-nuclear factor-κB p65;GAPDH:3-磷酸甘油醛脱氢酶 glyceraldehyde-3-phosphate dehydrogenase;p-GAPDH:磷酸化3-磷酸甘油醛脱氢酶 phospho-glyceraldehyde-3-phosphate dehydrogenase;ETEC:产肠毒素型大肠杆菌 enterotoxigenic Escherichia coli;LP:植物乳杆菌 Lactobacillus plantarum。
2.4 植物乳杆菌对ETEC感染的猪肠上皮细胞中紧密连接蛋白表达的影响
由图2可知,与空白对照组相比,ETEC组ZO-1和occludin的表达量在6和24 h均极显著降低(P<0.01);与ETEC组相比,植物乳杆菌+ETEC组ZO-1和occludin的表达量在6和24 h显著或极显著升高(P<0.05或P<0.01)。结果表明,ETEC感染能够引起猪肠上皮细胞中紧密连接蛋白ZO-1和occludin表达量下降,但是植物乳杆菌能够逆转ETEC造成的紧密连接蛋白表达下降。

ZO-1:闭合小环蛋白-1 zonula occludens-1;Occludin:闭锁蛋白;GAPDH:3-磷酸甘油醛脱氢酶 glyceraldehyde-3-phosphate dehydrogenase;ETEC:产肠毒素型大肠杆菌 enterotoxigenic Escherichia coli;LP:植物乳杆菌 Lactobacillus plantarum。
2.5 靶蛋白在植物乳杆菌调控猪肠上皮细胞产生促炎性细胞因子中的作用
由表3可知,与空白对照组相比,ETEC组IL-1β、IL-8和TNF-α含量均极显著升高(P<0.01)。与ETEC组相比,抑制剂+ETEC组、植物乳杆菌+ETEC组和抑制剂+植物乳杆菌+ETEC组IL-1β、IL-8和TNF-α含量均极显著降低(P<0.01)。与植物乳杆菌+ETEC组相比,抑制剂+植物乳杆菌+ETEC组在p38 MAPK活性被抑制后IL-1β含量极显著降低(P<0.01),IL-8含量呈下降趋势但差异不显著(P>0.05);在NF-κB p65活性被抑制后IL-8含量显著降低(P<0.05),TNF-α含量极显著降低(P<0.01),IL-1β含量呈下降趋势但差异不显著(P>0.05);在ERK-MAPK活性被抑制后IL-1β含量极显著降低(P<0.01),TNF-α含量显著降低(P<0.05),IL-8含量呈下降趋势但差异不显著(P>0.05)。结果表明,植物乳杆菌和靶蛋白抑制剂共同作用或植物乳杆菌单独作用均能够降低ETEC诱导的促炎性细胞因子的生成,并且靶蛋白抑制剂对植物乳杆菌调控部分促炎性细胞因子的产生有协同作用。
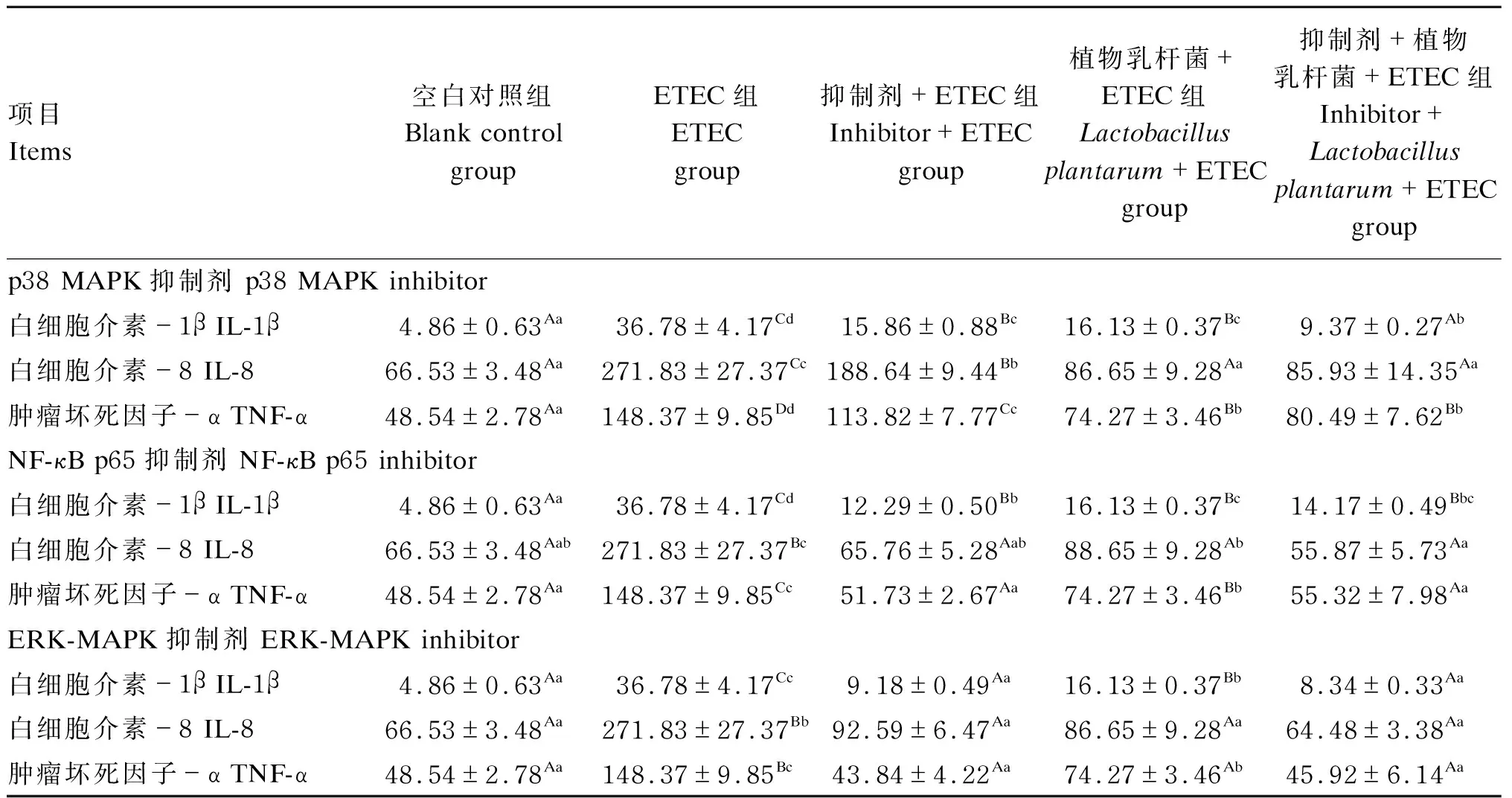
表3 靶蛋白在植物乳杆菌调控猪肠上皮细胞产生促炎性细胞因子中的作用
2.6 植物乳杆菌对ETEC诱导的猪肠上皮细胞细胞毒性的影响
由表4可知,与空白对照组相比,ETEC组细胞毒性极显著升高(P<0.01);与ETEC组相比,抑制剂+ETEC组、植物乳杆菌+ETEC组和抑制剂+植物乳杆菌+ETEC组细胞毒性均极显著降低(P<0.01);与植物乳杆菌+ETEC组相比,抑制剂+植物乳杆菌+ETEC组在ERK-MAPK活性被抑制时细胞毒性显著下降(P<0.05),在p38 MAPK和NF-κB p65活性被抑制时细胞毒性无显著变化(P>0.05)。结果表明,ETEC感染增加了猪肠上皮细胞细胞毒性,植物乳杆菌和ERK-MAPK抑制剂共同作用或植物乳杆菌单独作用均能够降低ETEC诱导的细胞毒性,并且部分抑制剂对植物乳杆菌降低ETEC诱导的细胞毒性具有协同作用。
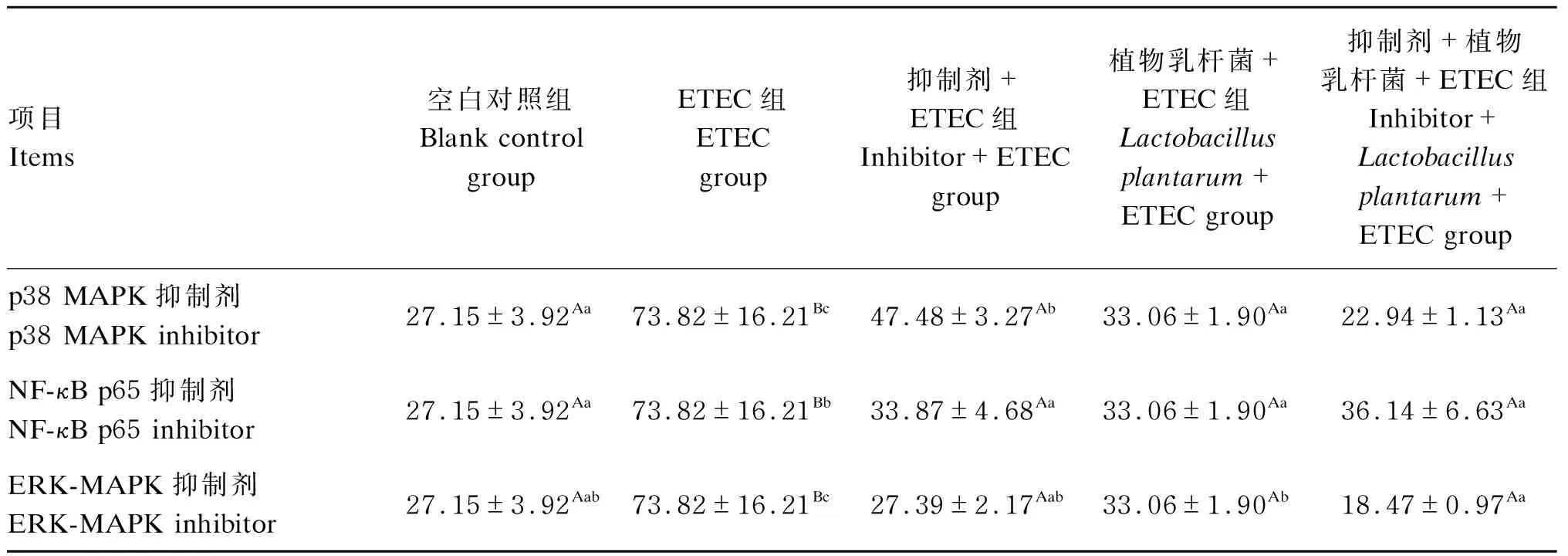
表4 植物乳杆菌对ETEC诱导的猪肠上皮细胞细胞毒性的影响
3 讨 论
3.1 植物乳杆菌对ETEC感染的猪肠上皮细胞产生促炎性细胞因子的影响
细胞因子由激活的免疫细胞(如巨噬细胞等)和基质细胞(如上皮细胞等)产生,具有广泛而复杂的生物学作用,其中一个十分重要的作用就是参与免疫应答与免疫调节。TNF-α和白细胞介素-1(interleukin-1,IL-1)能够使巨噬细胞活化,增强其吞噬、杀伤等活性,同时TNF-α具有细胞毒作用,可促进中性粒细胞活化,这些免疫细胞的活化均有助于机体清除入侵的病原菌。IL-8又称为趋化因子,能够募集免疫细胞到病原菌感染部位,从而使免疫细胞能够在特定部位发挥杀伤作用,有利于机体抵抗病原菌感染和维持自身免疫平衡。适量的TNF-α、IL-1和IL-8能够发挥上述积极作用,过量的这些细胞因子则会给机体正常组织带来较大的损伤,例如活化的中性粒细胞可以溶解细胞和结缔组织。因此,如果细胞因子过量的话,冗余的中性粒细胞就会被激活,导致较多的细胞和组织损伤,破坏机体的免疫平衡。本研究发现,ETEC感染的猪肠上皮细胞能够产生大量的TNF-α、IL-1β和IL-8,同时释放出大量的LDH(表现为细胞毒性增强)于培养液中,对自身造成了损伤,然而,被植物乳杆菌预处理的猪肠上皮细胞在被ETEC感染后,其产生的TNF-α、IL-1β和IL-8含量以及释放的LDH活性均显著下降。植物乳杆菌10hk2株能够减弱脂多糖(LPS)处理的小鼠巨噬细胞产生炎性细胞因子,同时增加抗炎性细胞因子的产生,从而减轻了LPS诱导的炎症反应[7]。这表明,植物乳杆菌能够降低ETEC感染的细胞产生促炎性细胞因子,减轻该病原菌引起的肠上皮细胞损伤。
3.2 植物乳杆菌对ETEC感染的猪肠上皮细胞TLR和NLR表达的影响
先天性免疫反应通过细胞的模式识别受体识别入侵的微生物,TLR和NLR是2类重要的模式识别受体,它们一旦识别微生物后就会活化免疫细胞,通过下游信号级联反应,最终产生多种细胞因子,发挥相应的生物学功能[8]。TLR2和TLR4均是细胞膜表面受体,它们识别的微生物具有其分子结构特征性,TLR4主要识别LPS,而TLR2的配体较TLR4的广泛,可以识别脂蛋白、脂磷壁酸和脂多肽等。在本研究中,ETEC的刺激增加猪肠上皮细胞中TLR2和TLR4的mRNA相对表达量,在ETEC感染3~12 h植物乳杆菌预处理的细胞中TLR2和TLR4的mRNA相对表达量增加,但是在ETEC感染24 h植物乳杆菌预处理的细胞中TLR2的mRNA相对表达量开始下降。NLR是TLR的胞质对应物,在病原体出现时会启动先天性免疫反应[9]。此外,本试验中,ETEC的刺激增加猪肠上皮细胞中NLRP3和NLRP6的mRNA相对表达量,在ETEC感染3~6 h植物乳杆菌预处理的细胞中NLRP3和NLRP6的mRNA相对表达量显著提高,但是在ETEC感染12 h植物乳杆菌预处理的细胞中NLRP3的mRNA相对表达量开始下降。这说明,植物乳杆菌对TLR2、TLR4、NLRP3和NLRP6表达的调控是一个动态的过程,在ETEC感染早期TLR2、TLR4和NLRP3的高表达能够使IPEC-J2细胞通过识别更多的ETEC分子结构而活性增强,从而产生较多的促炎性细胞因子,有助于清除ETEC;而在感染后期TLR2和NLRP3的低表达可以降低促炎性细胞因子的生成,有助于减轻对IPEC-J2细胞的损伤。NLRP6是一个抑制天然免疫反应的模式识别受体,在ETEC感染植物乳杆菌预处理的细胞早期NLRP6的mRNA相对表达量较高,这有助于减轻或避免过强的免疫反应带来的细胞损伤。这表明,植物乳杆菌通过调节TLR2、TLR4、NLRP3和NLRP6表达来调节促炎性细胞因子的生成,有助于减轻ETEC感染引起的肠上皮细胞损伤。因此,我们猜测植物乳杆菌介导的TLR2、TLR4和NLRP3依赖性信号通路的激活可能会诱导一些炎症细胞的募集和激活,成为宿主细胞抵抗ETEC诱导的炎症反应的一种防御性策略。与本研究结果一致的是,鼠李糖乳杆菌(Lactobacillusrhamnosus)GR-1[10]或植物乳杆菌NDC 75017[11]处理的细胞中TLR2的表达水平也表现为提高;嗜酸乳杆菌预饲仔猪后,也能够降低ETEC感染仔猪脾脏和肠系膜淋巴结中TLR2和TLR4的表达[12]。
3.3 植物乳杆菌对ETEC感染的猪肠上皮细胞中MAPK和NF-κB磷酸化的影响
TLR和NLR识别入侵病原体后,就会激活信号通路关键蛋白如MAPK和NF-κB,最终调控相关基因的表达。NF-κB是一种重要的核转录因子,能够调控多种炎症相关细胞因子如TNF-α、IL-1和IL-8等的产生。TNF-α的产生和NF-κB的活化能够形成一个正向反馈回路,即NF-κB的活化促进TNF-α的产生,TNF-α的产生又可产生信号级联反应,引起NF-κB的活化[13]。蛋白质磷酸化是信号转导系统调控的核心,因为它起着开关的作用来开启或关闭蛋白质的活性。因此,本研究对NF-κB亚基p65的磷酸化进行了测定。结果表明,植物乳杆菌对NF-κB p65的磷酸化有显著的抑制作用。因此,我们推测,植物乳杆菌可能至少部分通过NF-κB依赖的信号转导途径对ETEC感染的IPEC-J2细胞产生抗炎作用。本研究发现,植物乳杆菌预处理后能够减弱ETEC诱导的猪肠上皮细胞产生促炎性细胞因子IL-1β、IL-8和TNF-α。与本研究发现一致,植物乳杆菌10hk2株能够通过抑制NF-κB的活化减弱LPS处理的小鼠巨噬细胞产生炎性细胞因子[7]。罗伊氏乳杆菌(Lactobacillusreuteri)也可以下调ETEC感染的猪小肠上皮细胞产生促炎性细胞因子IL-8和白细胞介素-6(interleukin-6,IL-6)[14]。此外,本研究还发现,特异性信号通路抑制剂对植物乳杆菌下调ETEC诱导的细胞炎症反应具有协同作用。
TLR和NLR表达下降能够减弱MAPK和NF-κB的磷酸化,导致多种细胞因子分泌下降[15]。本研究表明,在ETEC感染后期植物乳杆菌使ETEC感染的猪肠上皮细胞表达TLR2、TLR4和NLRP3的能力下降,同时植物乳杆菌还能够降低ETEC诱导的p38 MAPK和NF-κB p65磷酸化水平。前人研究表明,詹氏乳杆菌(Lactobacillusjensenii)和食淀粉乳杆菌(Lactobacillusamylovorus)在下调TLR4依赖性NF-κB和MAPK激活以及触发TLR负调节因子,包括Toll相互作用蛋白(Toll interacting protein,Tollip)、B细胞淋巴瘤3编码的蛋白质(B-cell lymphoma 3-encoded protein,Bcl3)、肿瘤坏死因子-α诱导蛋白3(A20)、丝裂原活化蛋白激酶磷酸酶1(mitogen-activated protein kinase phosphatase 1,MKP-1)和抑制性白细胞介素-1受体(interleukin-1 receptor,IL-1R)相关激酶等中发挥保护作用[16-17]。副干酪乳杆菌(Lactobacillusparacasei)能够通过诱导TLR2依赖性NF-κB信号通路激活的负调节因子来抑制单核巨噬细胞产生促炎性细胞因子[18]。因此,我们推测植物乳杆菌引起的NF-κB磷酸化水平下降可能与TLR2活化相关。他们的研究结果与我们的研究结果相结合,提供了一种益生菌通过减轻炎症反应来保护肠细胞免受ETEC造成损伤的可能性。ERK和p38是MAPK中2个不同的家族,参与炎性反应。在本研究中,植物乳杆菌可在ETEC感染后3~6 h使细胞中p38 MAPK磷酸化受到抑制,但是在同一组中观察到了ERK-MAPK磷酸化的增强,这说明植物乳杆菌调节ETEC诱导炎症反应存在着复杂性,还需要我们进行更深入的研究。NLRP6可以抑制MAPK和NF-κB信号通路[6,19-20]。在本研究中,植物乳杆菌还能够提高ETEC感染细胞中NLRP6的mRNA相对表达量,同时还降低了该细胞中p38 MAPK和NF-κB p65的磷酸化水平,这表明NLRP6在植物乳杆菌调节肠上皮细胞炎症反应中发挥着一定的作用。
3.4 植物乳杆菌对ETEC感染的猪肠上皮细胞中紧密连接蛋白表达的影响
肠道屏障与功能性紧密连接蛋白密切相关,紧密连接蛋白是位于上皮细胞之间的动态复合体,是一种基于分子电荷和大小的细胞旁通透性的关键结构[21]。从这个意义上说,这种多功能和连续装配的任何变化都可能导致细胞旁通透性的限制,使离子和溶质的进入或净流动成为可能。紧密连接包括跨膜蛋白(封闭蛋白和闭合蛋白)以及各种被招募到顶外侧膜的胞浆蛋白,包括ZO-1、ZO-2、ZO-3、扣带蛋白(cingulin)和7H6[22]。在ETEC感染的猪肠上皮细胞中,紧密连接的完整性和规律渗透率被负面影响[22];在早期断奶仔猪中,ETEC的感染能够增加紧密连接的通透性[23];罗伊氏乳杆菌能够通过维持ZO-1的正常位置,可以降低ETEC诱导的膜屏障损伤[24]。这些结果与本研究的结果是一致的,ETEC感染能够降低紧密连接蛋白ZO-1和occludin的表达,但是这种不利的影响在植物乳杆菌预处理的细胞中能够被部分逆转。这说明,植物乳杆菌调控肠上皮细胞紧密连接蛋白表达有助于维护肠上皮细胞的完整性。
3.5 植物乳杆菌对ETEC诱导的猪肠上皮细胞细胞毒性的影响
LDH是一种存在于细胞质中的氧化还原酶,广泛存在于组织中。细胞内或细胞外应激都会导致黏屏障功能受损,刺激细胞随后释放LDH,常用培养液中LDH的活性来表示细胞损伤程度[25]。因此,培养液中LDH的活性通常作为细胞损伤或死亡的一种标志。本研究结果发现ETEC能够诱导猪肠上皮细胞炎症反应,释放大量LDH,而植物乳杆菌的加入能够显著降低ETEC感染细胞释放LDH。这说明,植物乳杆菌能够保护猪肠上皮细胞膜的完整性,并且在特异性信号通路抑制剂存在的情况下这种保护作用能够被提高,植物乳杆菌对炎症反应的调节作用可能有助于提高上皮细胞的屏障功能。
4 结 论
植物乳杆菌通过促进ETEC感染的猪肠上皮细胞过表达NLRP6,抑制ETEC感染细胞过表达TLR2和NLRP3,下调感染细胞中p38 MAPK和NF-κB p65的磷酸化水平,以及抑制促炎性细胞因子的产生,从而减轻肠上皮细胞的炎症反应。此外,植物乳杆菌还可促进紧密连接蛋白ZO-1和occludin的表达,减轻感染细胞的损伤程度,有助于维护肠上皮细胞的完整性。
