湿态发酵豆粕对肉鸡生长性能、抗氧化能力和肠道健康的影响
2021-08-09鲁春灵李军国蒋万春于纪宾
鲁春灵 李军国 蒋万春 于纪宾 杨 洁*
(1.中国农业科学院饲料研究所,北京 100081;2.河北工程大学生命科学与食品工程学院,邯郸 056038)
发酵饲料原料是指将单一饲料原料作为发酵底物,接种单一或复合菌种再通过发酵工程技术发酵3~5 d后制成的原料[1]。发酵饲料原料具有较低的抗营养因子、较小的蛋白分子质量以及富含活性益生菌等特点。饲粮中添加一定比例的发酵饲料原料不仅能提高动物的饲料转化效率和生长性能,而且可以抑制有害菌的生长和疾病发生,特别是缓解动物营养性腹泻的问题。因此,从动物健康水平以及动物食品安全性角度出发,发酵饲料原料可以在一定程度上减少抗生素等药物的使用[2]。
豆粕粗蛋白质含量为43%~46%,不但蛋白质含量高,而且氨基酸平衡良好,除了半胱氨酸与蛋氨酸外,必需和非必需氨基酸比例都很高[3]。然而,豆粕中含有一定的抗营养因子,这降低了蛋白质和矿物质等的消化率,降低了豆粕蛋白质的营养价值,导致畜禽消化和代谢疾病,从而降低了畜禽的生长性能和价值。与豆粕相比,发酵豆粕降低了豆粕中的抗营养因子含量,半纤维素和植酸磷含量也显著下降,而且还能利用发酵微生物的菌体蛋白质,粗蛋白质含量提高约10%,并且三氯乙酸可溶性蛋白、小肽和游离氨基酸的含量也提高了6.5倍;同时,发酵豆粕中的高浓度乳酸和低pH抑制了肠杆菌科细菌的增殖[4]。因此,发酵豆粕在畜禽生产中被广泛应用。
相关研究表明,发酵湿饲料饲喂肉仔鸡可降低胚胎死亡率,提高雏鸡的出栏数[5]。发酵饲料饲喂雏鸡后,十二指肠和盲肠中乳杆菌总数显著升高,而乳酸菌分泌乳酸降低胃肠道pH,从而抑制大肠杆菌生长。湿发酵芝麻粕和黑曲霉发酵银杏叶对肉仔鸡、肉鸭的脂肪代谢、胸肌肉品质和脂肪酸组成都有积极的影响,黑曲霉发酵银杏叶还可以减少脂质过氧化[6-7]。发酵豆粕、发酵橄榄叶和发酵湿饲料均可以显著提高肉鸡的生长性能和屠宰性能,降低腹脂率[8-10]。复合菌制剂和发酵木薯废浆通过提高盲肠内容物中丁酸和丙酸含量来改善肉鸡肠道对病原体的过度炎症反应[11-12]。发酵豆粕和发酵湿饲料可以抑制沙门氏菌在肠道和内脏器官的定植和侵袭,降低异嗜性细胞与淋巴细胞比值,改善肠道组织形态和健康[13-14]。肉鸡饲喂益生菌发酵饲料后,发现消化性能、血清白细胞介素-4含量以及淀粉酶、蛋白酶等消化酶活性都显著提高[15]。研究还表明,发酵豆粕和菜籽粕能通过提高肉鸡血浆中免疫球蛋白含量、血清中新城疫病毒的酶联免疫吸附试验(ELISA)效价、细胞介导的免疫反应(CMI)值以及新城疫病毒抗体滴度来改善免疫应答[16-19]。
发酵饲料原料在畜禽养殖中应用广泛,但固态发酵烘干过程增加了饲料企业成本同时还降低了益生菌活性。湿态发酵原料可以降低饲料加工成本的同时保护益生菌活性,但是湿态发酵原料由于水分含量高,在畜禽养殖中添加量受到限制,实际生产中湿态发酵原料添加比例在5%左右,益生菌活性得不到很好的利用,湿态发酵原料在畜禽生产应用中鲜有报道。因此,本文旨在通过研究饲粮添加不同比例湿态发酵豆粕对肉鸡生长性能、抗氧化能力和肠道健康的影响,从而为肉鸡养殖提供参考。
1 材料与方法
1.1 试验设计
试验选取1日龄科宝肉仔鸡768只,按体重相近原则随机分为4组,每组12个重复,每个重复16只鸡(公母各占1/2)。对照组(F0组)饲喂不添加湿态发酵豆粕的基础饲粮,基础饲粮为参照NRC(1994)[20]营养需要配制的配合饲料;试验组饲喂在基础饲粮中分别添加6%(F6组)、8%(F8组)和10%(F10组)湿态发酵豆粕(活菌数为4.34×106CFU/g)的试验饲粮,其中湿态发酵豆粕和玉米粉按3∶7比例预混合后再添加到配合饲料中。各组饲粮组成及营养水平见表1。试验期42 d,期间肉仔鸡自由采食、充足饮水,按正常免疫程序进行免疫接种。
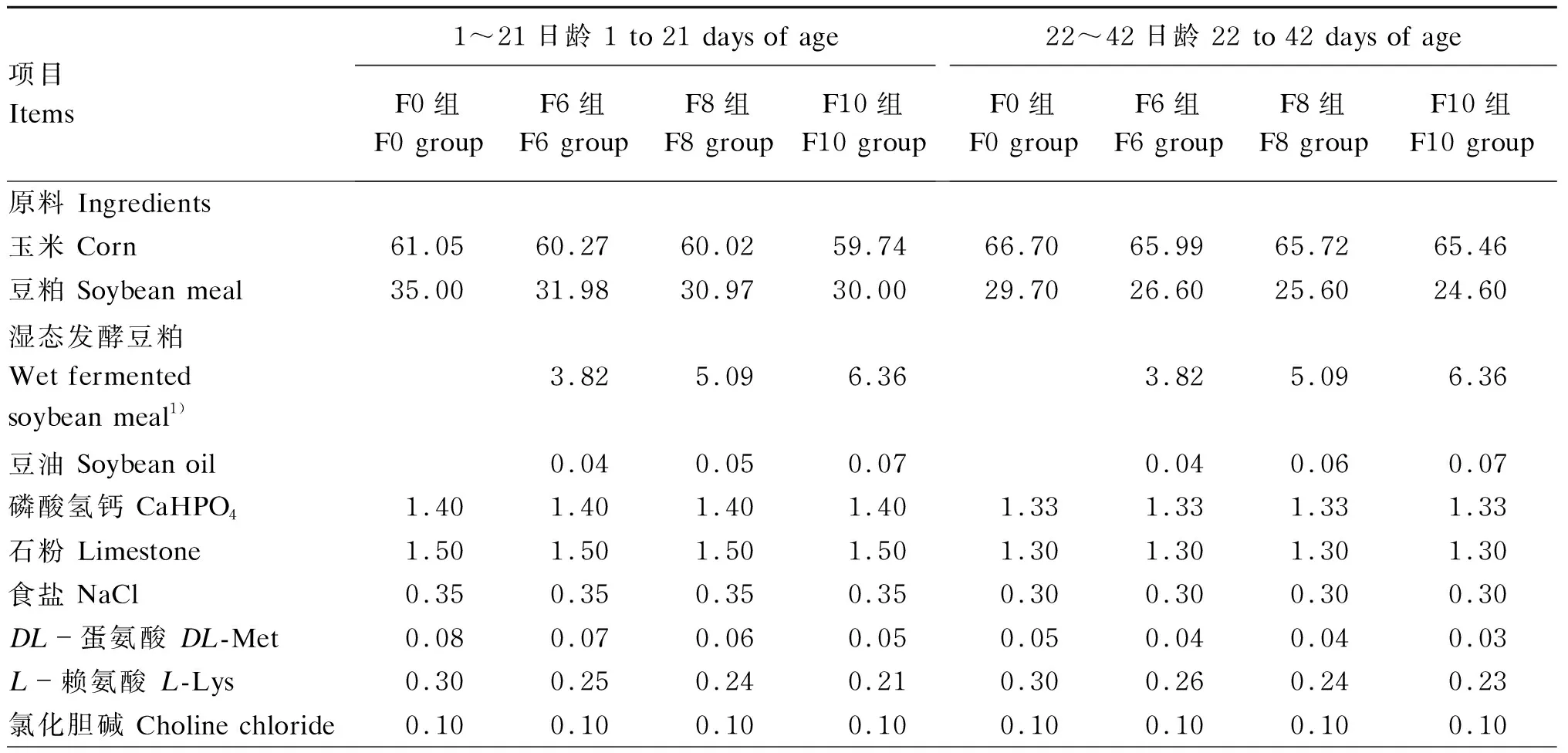
表1 饲粮组成及营养水平(风干基础)

1)湿态发酵豆粕水分含量为44.01%。The moisture content in wet fermented soybean meal was 44.01%。
1.2 指标检测
1.2.1 饲粮中有益菌数量
饲粮中芽孢杆菌、乳酸菌和酵母菌数量测定参考刘晓明等[21]的方法。
1.2.2 生长性能
每日观察并记录鸡群发病和死亡只数,分别于21和42日龄每个重复随机选取1只鸡进行个体空腹称重,统计试验期内的采食量,计算各组前期(1~21日龄)、后期(22~42日龄)和全期(1~42日龄)的平均体重、平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。计算公式为:
ADFI(g/d)=总耗料量/(只数×天数);
ADG(g/d)=总增重/(只数×天数);
F/G=总耗料量/总增重。
1.2.3 屠宰性能
42日龄时,每重复随机挑选1只肉鸡,颈静脉放血处死,测定屠宰率、全净膛率、胸肌率和腿肌率。计算公式为:
屠宰率(%)=100×屠体重/活体重;
全净膛率(%)=100×全净膛重/活体重;
胸肌率(%)=100×胸肌重/全净膛重;
腿肌率(%)=100×腿肌重/全净膛重。
1.2.4 免疫器官指数
42日龄时,每个重复随机选取1只肉鸡,颈静脉放血处死,分离脾脏和法氏囊并称重,计算免疫器官指数。
免疫器官指数(mg/g)=免疫器官重/活体重。
1.2.5 肉品质
42日龄时,每个重复随机选取1只肉鸡,屠宰解剖后,统一取左侧和右侧整块胸肌和腿肌,测定肉品质。
1)肉色:取样现场立即测定。采用CR-10全自动色差计测定胸肌和腿肌新鲜切面的亮度(L*)值、红度(a*)值和黄度(b*)值。
2)滴水损失:试验第42天时,将肉鸡胸肌修整为3 cm×2 cm×1 cm的肉块,称重(W1),然后用细铁丝钩住肉样,使肌纤维垂直向下,悬吊于4 ℃,24 h后取出肉样后称重(W2),计算24 h滴水损失;再过24 h后取出肉样称重(W3),计算48 h滴水损失;再过24 h后取出肉样称重(W4),计算72 h滴水损失。每个样品2个平行,计算公式为:
24 h滴水损失(%)=100×(W1-W2)/W1;
48 h滴水损失(%)=100×(W1-W3)/W1;
72 h滴水损失(%)=100×(W1-W4)/W1。
3)pH:胸肌置于4 ℃中保存24 h后,将HANNA HI8424C酸度计(意大利)的电极头插入肌肉中(深度不小于1 cm),电极头部完全包埋后读取pH。每个样品于不同位置测量3次,结果取其平均值。
4)蒸煮损失:试验第42天,屠宰肉鸡,用取样器切取肉块,并去除结缔组织,再用密封袋包装。在4 ℃条件下熟化24 h,称取胸肌重量(W1)。之后在Thermopet NTT-1100恒温水浴锅(日本)中75 ℃水浴15 min,用滤纸擦干,称胸肌重量(W2),蒸煮损失计算公式为:
蒸煮损失(%)=100×(W1-W2)/W1。
5)剪切力:将测定蒸煮损失后的样品顺着肌纤维方向切为截面为1 cm×1 cm的3个肉条,再以垂直肌纤维方向采用TA-XY2i质构仪(美国)对其进行剪切,每个肉条剪切1次,读取3次剪切力读数的平均值。
1.2.6 血清生化和抗氧化指标
42日龄时,每个重复随机选取1只肉鸡,颈静脉放血处死,取血,4 000 r/min离心5 min分离血清,-20 ℃保存待测。测定血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、尿素氮(UN)和丙二醛(MDA)含量、总抗氧化能力(T-AOC)以及谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性。上述指标采用科华ZY KHB-1280全自动生化仪(上海)测定。
1.2.7 小肠组织形态
42日龄时,每个重复随机选取1只肉鸡,剪取十二指肠、空肠和回肠组织,用生理盐水洗净内容物后,置于4%多聚甲醛中固定。组织经脱水、包埋后,制作厚度为4 μm组织切片,并进行苏木精-伊红(HE)染色。每例样本选取3个完整的典型绒毛和隐窝,使用医学图像分析软件ImagePro Plus 7.0测量绒毛高度和隐窝深度,并计算绒毛高度/隐窝深度(V/C)值。
1.2.8 盲肠微生物
盲肠微生物测定参考刘凤美等[22]的方法。
1.3 数据统计分析
试验数据采用SPSS 20.0统计软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,显著性水平为P<0.05,结果用“平均值±标准差”表示。
2 结果与分析
2.1 湿态发酵豆粕对饲粮中有益菌数量的影响
由表2可知,与对照组(F0组)相比,试验组1~21日龄饲粮中芽孢杆菌和乳酸菌数量以及22~42日龄饲粮中芽孢杆菌、乳酸菌和酵母菌数量均显著提高(P<0.05),F10组1~21日龄饲粮中酵母菌数量显著提高(P<0.05)。
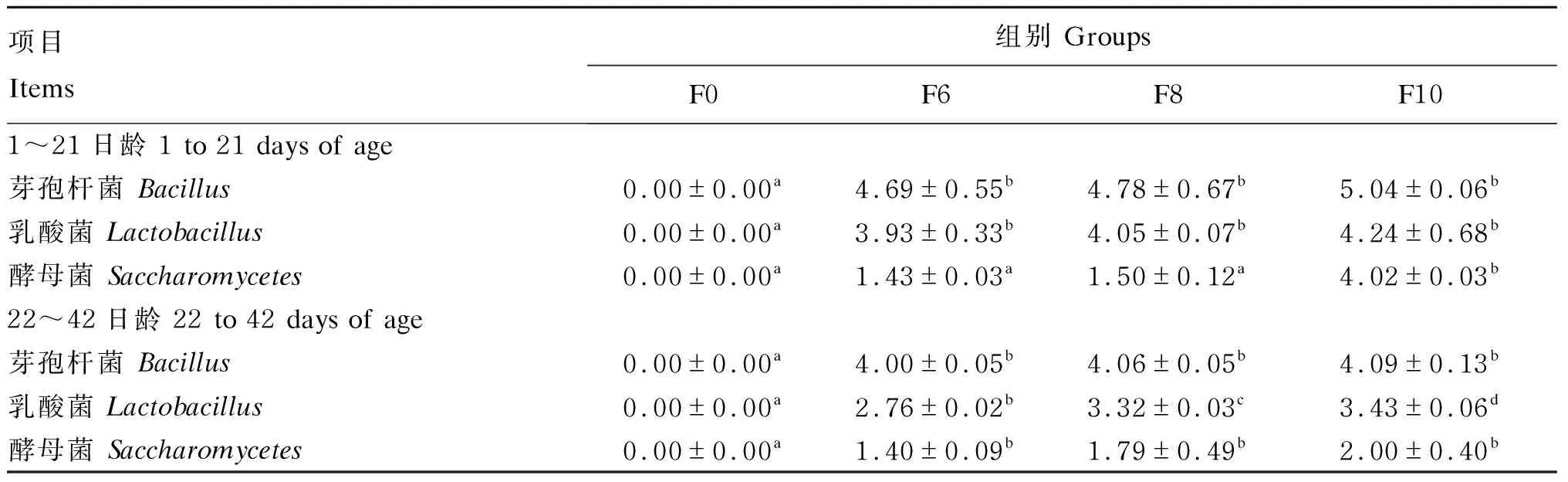
表2 湿态发酵豆粕对饲粮中有益菌数量的影响
2.2 湿态发酵豆粕对肉鸡生长性能的影响
由表3知,与F0组相比,F10组肉鸡1~21日龄平均体重显著提高(P<0.05),其他各试验组差异不显著(P>0.05);与F0组、F6组和F8组相比,F10组肉鸡1~21日龄料重比显著降低(P<0.05),F0组、F6组和F8组之间差异不显著(P>0.05);各组肉鸡1~21日龄平均日采食量和平均日增重之间差异均不显著(P>0.05)。
与F0组和F6组相比,F8组和F10组肉鸡22~42日龄平均体重显著提高(P<0.05),平均日采食量显著提高(P<0.05);与F0组相比,F10组肉鸡22~42日龄平均日增重显著提高(P<0.05),其他各试验组差异不显著(P>0.05);与F0组相比,F8组和F10组肉鸡22~42日龄料重比显著降低(P<0.05),F6组差异不显著(P>0.05)。
与F0组相比,F8组和F10组肉鸡1~42日龄平均日增重显著提高(P<0.05),F6组差异不显著(P>0.05);各组肉鸡1~42日龄平均日采食量和料重比之间差异均不显著(P>0.05)。

表3 湿态发酵豆粕对肉鸡生长性能的影响
2.3 湿态发酵豆粕对肉鸡屠宰性能的影响
由表4可知,随着湿态发酵饲料添加比例的提高,各组肉鸡屠宰率、全净膛率和腿肌率均有升高的趋势,但差异不显著(P>0.05),这说明添加湿态发酵豆粕可以获得较多的可食用肉质[23]。
表4 湿态发酵豆粕对肉鸡屠宰性能的影响
2.4 湿态发酵豆粕对肉鸡免疫器官指数的影响
由表5可知,随着湿态发酵豆粕添加比例的提高,各组肉鸡脾脏指数和法氏囊指数有升高的趋势,但差异不显著(P>0.05),这说明湿态发酵豆粕对机体的免疫机能有一定的促进作用。

表5 湿态发酵豆粕对肉鸡免疫器官指数的影响
2.5 湿态发酵豆粕对肉鸡肉品质的影响
由表6可知,随着湿态发酵豆粕添加比例的提高,各组肉鸡胸肌和腿肌的肉色有升高的趋势,但差异不显著(P>0.05)。肉的颜色是影响消费者购买肉产品的最主要因素,肉色提高可以得到更多消费者青睐[24]。
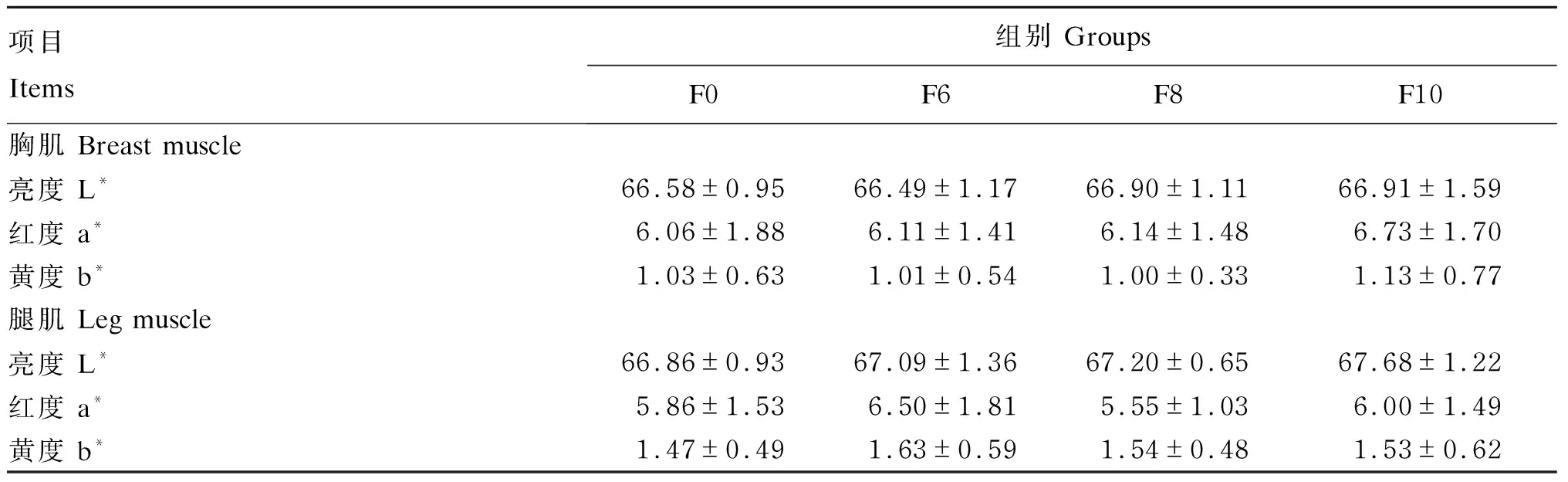
表6 湿态发酵豆粕对肉鸡肉色的影响
由表7可知,与F0组、F6组和F10组相比,F8组肉鸡胸肌pH显著降低(P<0.05),优质鸡肉的pH为6.0~6.5[25],F0组和F8组不符合优质鸡肉标准。随着湿态发酵豆粕添加比例的提高,各组肉鸡胸肌蒸煮损失、剪切力和滴水损失有降低趋势,但差异不显著(P>0.05),这说明湿态发酵豆粕可以提高肉鸡肌肉系水力,进而改善肌肉嫩度和口感[26]。
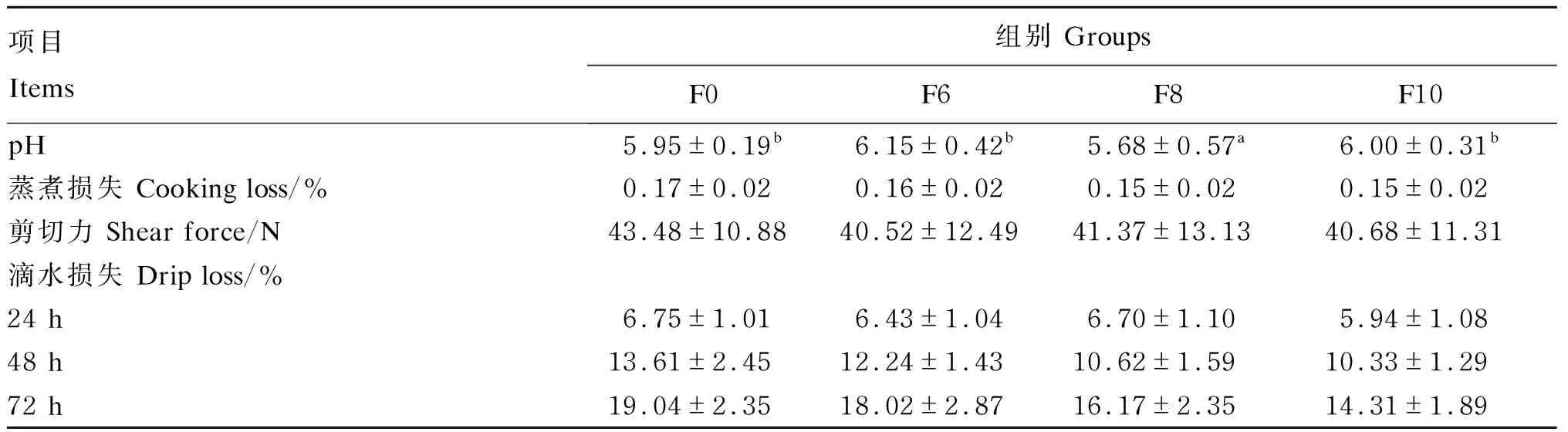
表7 湿态发酵豆粕对肉鸡胸肌肉品质影响
2.6 湿态发酵豆粕对肉鸡血清生化和抗氧化指标的影响
由表8可知,随着湿态发酵豆粕添加比例的提高,各组肉鸡血清ALB、IgM和IgA含量有升高趋势,但各组血清生化指标差异不显著(P>0.05)。免疫球蛋白广泛参与动物机体的体液免疫[27],本试验结果说明湿态发酵豆粕对肉鸡的体液免疫具有一定的促进作用。
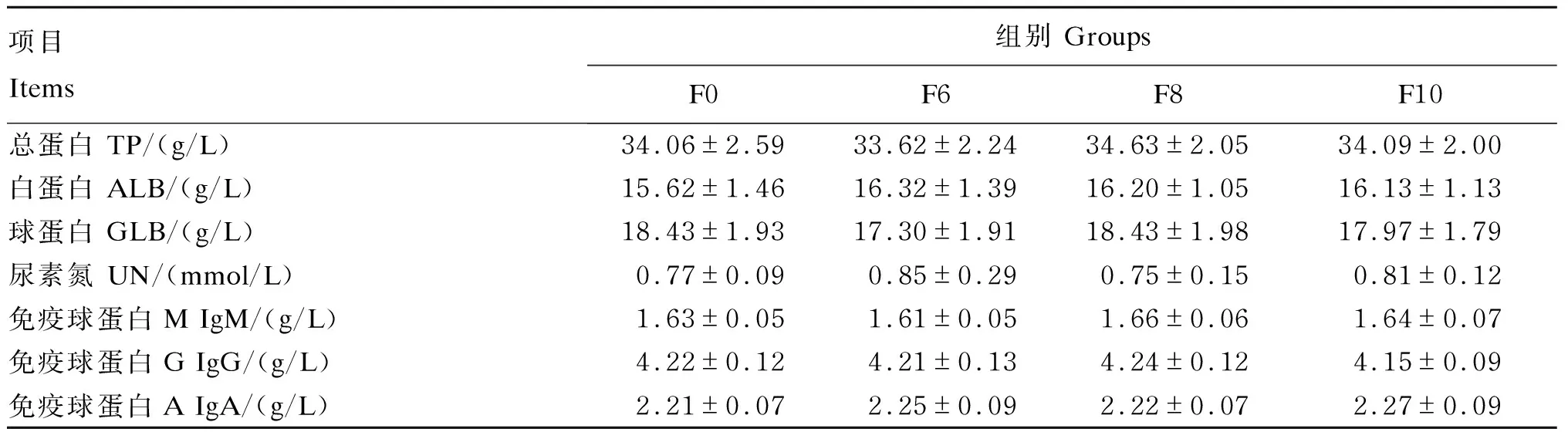
表8 湿态发酵豆粕对肉鸡血清生化指标的影响
由表9可知,与F0组相比,F10组肉鸡血清SOD活性显著提高(P<0.05),其他各试验组差异不显著(P>0.05);与F0组相比,F6组、F8组和F10组肉鸡血清MDA含量显著降低(P<0.05);各组间其他血清抗氧化指标差异不显著(P>0.05)。
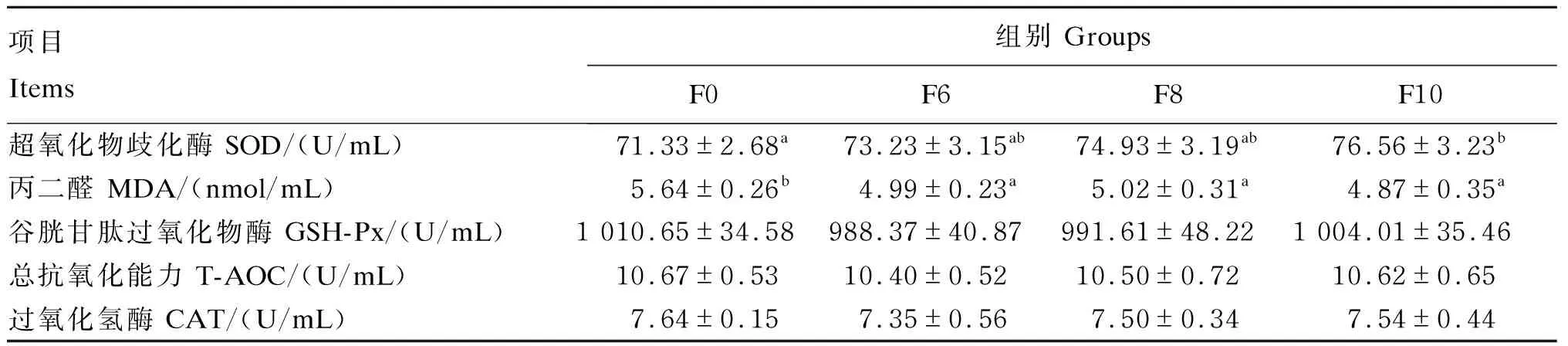
表9 湿态发酵豆粕对肉鸡血清抗氧化指标的影响
2.7 湿态发酵豆粕对肉鸡小肠组织形态和盲肠微生物的影响
由表10可知,与F0组和F6组相比,F8组和F10组肉鸡十二指肠绒毛高度显著提高(P<0.05);与F0组、F6组和F8组相比,F10组肉鸡十二指肠隐窝深度显著降低,F8组肉鸡十二指肠隐窝深度显著低于F0组(P<0.05);与F0组、F6组和F8组相比,F10组肉鸡十二指肠V/C值显著提高(P<0.05),F8组肉鸡十二指肠V/C值与F0组和F6相比显著提高(P<0.05),F0组和F6组差异不显著(P>0.05)。
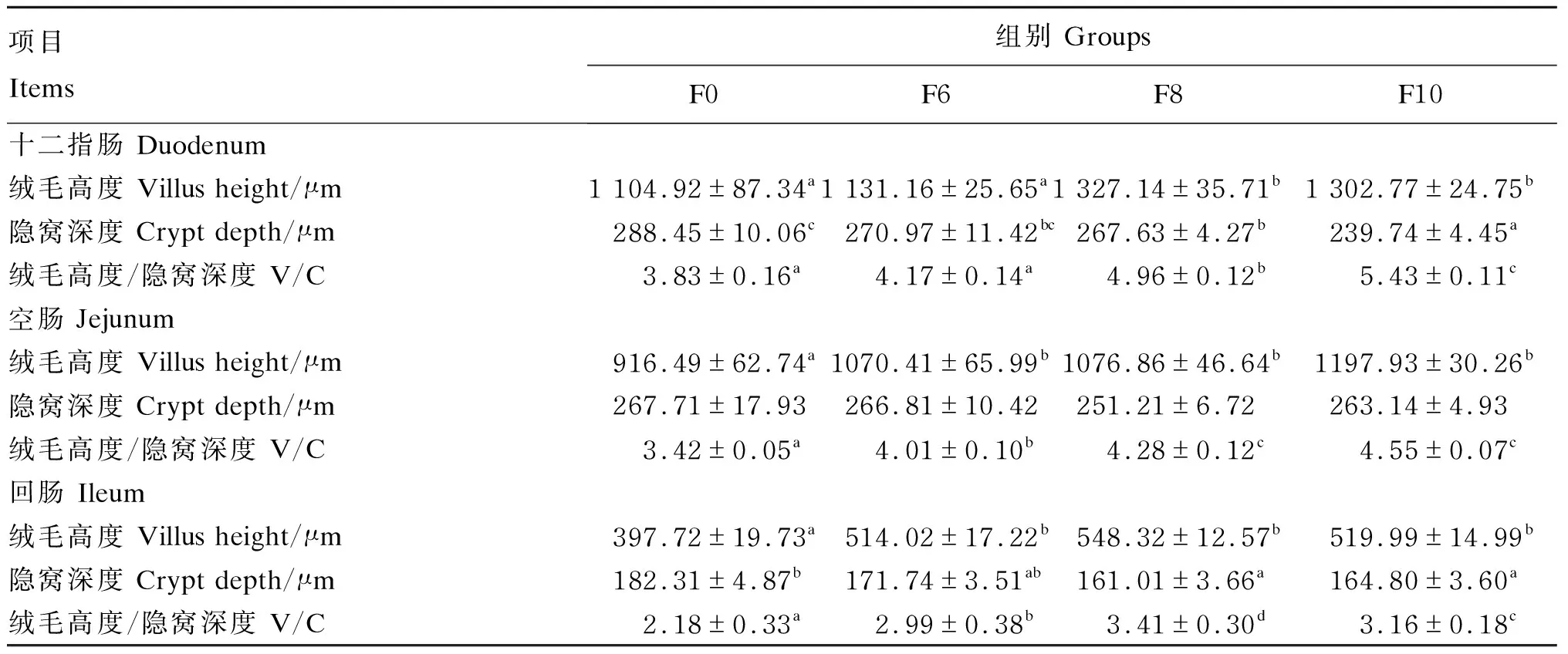
表10 湿态发酵豆粕对肉鸡小肠组织形态的影响
与F0组相比,F6组、F8组和F10组肉鸡空肠绒毛高度和V/C值显著提高(P<0.05);与F0组和F6组相比,F8组和F10组肉鸡空肠V/C值显著提高(P<0.05);各组肉鸡空肠隐窝深度差异不显著(P>0.05)。
与F0组相比,F6组、F8组和F10组肉鸡回肠绒毛高度和V/C值显著提高(P<0.05);F8组和F10组肉鸡回肠隐窝深度显著降低(P<0.05),F6组差异不显著(P>0.05)。各组肉鸡十二指肠、空肠和回肠的组织切片见图1。
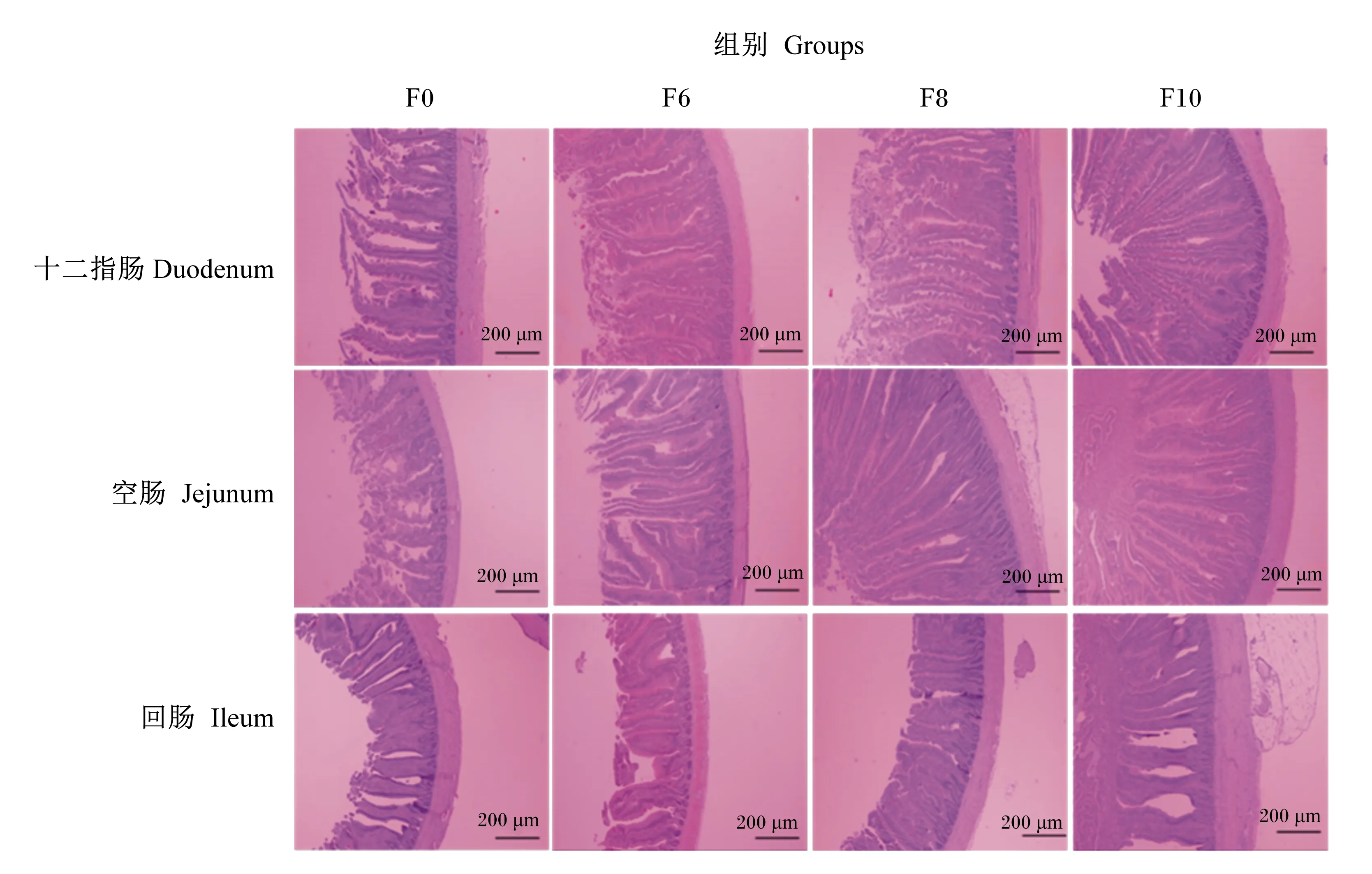
图1 肉鸡十二指肠、空肠和回肠的组织切片
由表11可知,与F0组和F6组相比,F10组肉鸡盲肠乳酸菌数量显著提高(P<0.05),F6组和F8组肉鸡盲肠乳酸菌数量显著高于F0组(P<0.05);与F0组相比,F10组肉鸡盲肠沙门氏菌数量显著降低(P<0.05),其他各试验组差异不显著(P>0.05);各组肉鸡盲肠大肠杆菌数量之间差异不显著(P>0.05)。

表11 湿态发酵豆粕对肉鸡盲肠微生物的影响
3 讨 论
3.1 湿态发酵豆粕对肉鸡生长性能的影响
豆粕中含有胰蛋白酶抑制剂等多种抗营养因子,然而家禽缺乏消化豆粕抗营养因子的内源性水解酶导致豆粕利用受到限制。豆粕在发酵过程中可降低抗营养因子含量,并将大分子蛋白质降解为动物机体易消化和利用的小分子蛋白,进而提高饲料转化效率,这是发酵豆粕能改善肉鸡生长性能的主要原因。魏莲清等[28]和Niu等[29]研究发现,饲粮添加6%发酵棉籽粕可提高肉鸡生长性能。柯祥军等[8]研究发现,饲粮添加10%发酵豆粕也可提高肉鸡生长性能和屠宰性能。Akinola等[10]研究发现,饲粮按1∶1.3的比例与水混合发酵成发酵湿饲料饲喂肉鸡提高了肉鸡的平均体重。本试验中,与F0组相比,F10组肉鸡1~21日龄平均体重显著提高;与F0组、F6组和F8组相比,F10组肉鸡1~21日龄料重比显著降低;与F0组和F6组相比,F8组和F10组肉鸡22~42日龄平均体重和平均日采食量显著提高;与F0组相比,F8组和F10组肉鸡22~42日龄料重比显著降低。这说明添加湿态发酵豆粕可以提高肉鸡生长性能。这可能是因为湿态发酵豆粕中的芽孢杆菌、乳酸菌和酵母菌在发酵过程中将大分子蛋白质转化为小肽和氨基酸,同时降低了抗营养因子、粗纤维和粗脂肪等含量,提高了必需氨基酸和营养物质消化率[30-31]。湿态发酵豆粕中的芽孢杆菌还可以降低pH,从而给乳酸菌提供合适的环境,乳酸菌产生乳酸又进一步使环境中pH下降,进而抑制有害菌繁殖,改善肠道健康,从而提高生长性能。芽孢杆菌还可增强免疫功能并促进肠道内源性抗菌肽的合成,进而提高生长性能[32]。然而,也有研究表明,益生菌对肉鸡的生长性能影响没有显著影响[33]。这些结果的差异可能与益生菌的菌种、接种量、制备方法、禽龄、饲粮组成和卫生状况有关[34]。
3.2 湿态发酵豆粕对肉鸡血清免疫和抗氧化指标的影响
脾脏是一种外周免疫器官,对保护性免疫反应有重要影响。法氏囊被认为是肉鸡免疫球蛋白合成的主要部位,与B淋巴细胞发育有关,并为B淋巴细胞的产生提供必要的微环境。免疫器官重量的增加表明肉鸡的免疫健康状况较好[35]。Naji等[16]研究发现,饲粮添加丁酸梭菌显著提高了肉鸡法氏囊指数。而本试验发现,饲喂湿态发酵豆粕后,肉鸡胸腺指数和法氏囊指数没有显著性差异,但有上升的趋势,说明湿态发酵豆粕对机体的免疫机能有一定的促进作用,这可能是因为湿态发酵豆粕中芽孢杆菌有利于法氏囊的发育[35]。与本研究结果相似,Tang等[36]和Choi等[37]研究发现发酵海藻饲喂肉鸡后,免疫器官指数没有显著变化,这可能与发酵菌种和发酵方法有关。
氧化应激是指体内氧化与抗氧化作用失衡的一种状态,主要由活性氧引起。活性氧包括超氧阴离子自由基、羟基自由基和过氧化氢,是正常耗氧代谢过程的产物[38]。SOD是一种抗超氧阴离子自由基的天然清除剂,在保护细胞免受由活性氧引起的损害中起着重要作用。MDA是重要的脂质过氧化产物之一,其含量可以间接反映细胞的氧化损伤程度[39]。发酵黄芪饲喂肉鸡使得血清SOD活性提高,血清MDA含量降低[40];在肉鸡饲粮中添加黑曲霉发酵松针和黑曲霉发酵银杏叶也有类似效果[6,41];饲粮添加25%发酵豆粕可以提高肉仔鸡的生长性能和血清免疫力[42]。在本试验中,饲粮添加湿态发酵豆粕没有引起大多数血清抗氧化指标的显著变化,但是与F0组相比,F10组肉鸡血清SOD活性显著提高,血清MDA含量显著降低,这说明湿态发酵豆粕可能通过其中益生菌的金属离子螯合能力,调节信号传导途径来调节宿主的氧化还原状态[43]。乳酸菌和芽孢杆菌可能通过增加抗氧化剂基因的表达来增强抗氧化剂酶的活性,抑制可能引起细胞损伤的过量活性氧,并最终降低组织的MDA含量[44-45]。同时,湿态发酵豆粕在发酵过程中芽孢杆菌可能产生抗氧化酶、氨基酸、乳酸和抗氧化维生素,进而提高肉鸡抗氧化能力[43]。
3.3 湿态发酵豆粕对肉鸡小肠组织形态和盲肠微生物的影响
肠道健康与肉鸡的生长性能密切相关。肠道绒毛高度和隐窝深度被认为是评估肠道健康的重要指标[46]。绒毛高度增加,肠表面积增大,可以提高养分吸收效率,改善肉鸡的生长性能。相反,较短的绒毛和较深的隐窝可能降低营养吸收效率,从而降低抵抗力和生长性能[45]。
发酵饲料可以提高肉鸡肠道内乳酸菌数量[13,16,18],增加有益菌的丰度和减少潜在有害细菌的丰度,抑制肉鸡肠道内有害菌的增殖,从而改善肠道健康[42,47]。Feng等[48]研究发现,饲喂发酵豆粕饲粮能显著提高肉鸡十二指肠和空肠绒毛高度。Chachaj等[49]研究发现,饲粮添加6%发酵豆粕能够提高肉鸡肠道绒毛高度,减少空肠中真菌和大肠菌群总数。在本试验中,饲粮添加湿态发酵豆粕能提高肉鸡小肠各肠段绒毛高度,降低隐窝深度;还可以提高盲肠乳酸菌数量,降低沙门氏菌数量。这可能与芽孢杆菌产生的蛋白酶、脂肪酶和淀粉酶降解豆粕中抗营养因子,促使小肽等小分子物质增加有关。Yang等[50]研究发现,肉鸡饲粮中添加芽孢杆菌可以促进养分吸收进而诱导肉鸡的肠道上皮细胞增殖,改善肠道健康。湿态发酵豆粕中的乳酸菌还可以产生短链脂肪酸,降低肠道不同部位的pH,从而形成天然的防御屏障,抵抗感染和沙门氏菌等病原菌,改善肠道菌群的平衡,从而提高肠道健康[51]。
4 结 论
饲粮添加湿态发酵豆粕可以显著提高肉鸡生长性能和抗氧化能力,改善小肠组织形态,提高盲肠乳酸菌数量,降低盲肠沙门氏菌数量,并且添加比例为10%时效果最佳。
