小球藻营养强化即食香肠的品质特性
2021-08-09王璐肖珊杨小莹胡峣峣王波蔡燕雪王际辉李琳
王璐,肖珊,*,杨小莹,胡峣峣,王波,蔡燕雪,王际辉,,李琳
1(大连工业大学 生物工程学院,辽宁 大连,116034) 2(东莞理工学院 化学工程与能源技术学院,广东 东莞,523808)
小球藻(Chlorella)为绿藻门普生性单细胞绿色微藻,广泛分布于淡水和海水[1]中,富含多种营养物质以及活性代谢产物,具有免疫调节[2]、抗氧化以及降血糖和降血脂[3]等作用,被联合国粮食及农业组织评为“绿色健康食品”。小球藻应用范围广泛,可作为食品和饲料添加剂,也可作为高价值食品补充剂[4]。美国和日本将小球藻作为优良食品和动物饲料添加剂已有30多年的历史。近年来,东亚和欧洲每年生产数千吨的小球藻作为饲料添加剂、保健食品、营养补充食品或药物[5]。在各类小球藻中,蛋白核小球藻因其富含丰富的蛋白质和多糖,其中蛋白质含量占50%(干重)左右,被视为理想的蛋白质来源,在食品领域具有较好的应用前景[6]。
世界卫生组织早在2013年就已经提倡消费者选择富含多不饱和脂肪酸的肉制品[7],因此,研发健康营养的肉制品已经成为肉制品加工领域的发展趋势。目前,小球藻作为食品添加剂已经应用于大米、酿酒、发酵大豆制品、豆腐、面食、发酵乳制品等食品的品质改良和调味[8]。在肉制品加工中加入小球藻制备功能性肉制品,以提高肉制品的营养价值并改善其储藏特性尚不明晰。本研究往即食香肠中添加不同浓度的蛋白核小球藻,探究蛋白核小球藻对即食香肠的品质特性的影响,为未来开发以小球藻为营养强化剂的功能性肉制品提供参考。
1 材料与方法
1.1 材料与试剂
蛋白核小球藻粉,大连健洋生物科技有限公司;猪肉,大连沃尔玛超市;白酒、食盐、白砂糖、味精、焦磷酸钠、葵花籽油均为食品级;维生素C、维生素E含量测试盒,南京建成生物工程研究所;叶黄素标准品,大连美伦生物技术有限公司;2-硫代巴比妥酸,国药集团化学试剂有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH),上海麦克林生物有限公司;乙二醇双(2-氨基乙基醚)四乙酸(glycol-bis-(2-aminoethylether)-N,N,N′,N′-tetraacetic acid,EGTA),生工生物工程(上海)股份有限公司;其他有机试剂均为分析纯。
1.2 仪器与设备
KDY—9820全自动凯氏定氮仪,上海培欧分析仪器有限公司;安捷伦7890A型气相、5975C型质谱联用仪,美国安捷伦科技有限公司;H2050R-1高速冷冻离心机,湖南湘仪实验仪器开发有限公司;U-5100分光光度计,日立公司;水浴锅,上海精宏实验设备有限公司。
1.3 试验方法
1.3.1 香肠加工制作
制备破壁小球藻粉:小球藻粉与纯净水的料液比为1∶10(g∶mL);细胞破碎仪处理45 min,冷冻干燥获取破壁小球藻粉。实验共4个处理组,分别为空白对照组(未添加小球藻),低浓度添加组(小球藻添加量为0.5%,质量分数,下同),中浓度添加组(1.5%),高浓度添加组(3.0%),每个处理组分别制作3批香肠,每批12根。
即食香肠的具体制作过程为:肥瘦比为2∶8的猪前腿肉放入绞肉盘孔径为10 mm的绞肉机中绞碎,并混合均匀,将原料肉、食盐(2.5%,肉总质量计,下同)、白糖(1.5%)、料酒(1.5%)、焦磷酸钠(0.2%)、味精(0.1%)以及与原料肉同质量的冰水(1∶1)混合物共同放入斩拌机中,高速斩拌3 min;再分别加入破壁小球藻粉(0.5%、1.5%、3.0%,肉总质量计),以未加小球藻为对照组。高速斩拌:肠馅温度为12 ℃,即达到斩拌终点。4 ℃腌制2 h,猪小肠衣灌肠,并扎12个小孔排出肠衣内气体,沸水煮25 min(香肠中心温度70~74 ℃),透氧包装袋包装,置于4 ℃条件下保藏7 d,分别在第0、1、3、5和7天时检测香肠品质相关指标。
1.3.2 香肠营养成分测定
按照《GB 5009.5—2016 食品国家安全标准 食品中蛋白质的测定》[9-12]测定香肠中水分、蛋白质、脂肪和灰分的含量。采用苯酚硫酸法[13]测定香肠中总糖含量。采用维生素C、维生素E含量测试盒测定香肠中维生素C和维生素E含量。膳食纤维含量按照MOHAMED等[14]的方法进行测定。叶黄素含量测定具体步骤为:4 ℃条件下取4 g香肠样品与18 mL丙酮溶剂均质5 min,于8 000 r/min离心10 min,用0.45 μm滤膜过滤上清液。液相色谱条件按照V(甲醇)∶V(乙腈)=95∶5进行等度色谱分析,进样量10 μL,流速1 mL/min,所用色谱柱为C18柱(依利特),柱温为室温,检测波长为446 nm。以叶黄素标品做标准曲线计算出香肠的叶黄素含量。参考邓祥元等[15]的方法测定叶绿素含量:取0.5 g香肠样品与10 mL甲醇-乙醇溶液(体积比为1∶3)均质5 min,于8 000 r/min离心10 min,取上清液,分别在645和663 nm波长处测定吸光度,并按照公式(1)、(2)和(3)计算。
(1)
(2)
ωT/(mg·g-1)=ωa+ωb
(3)
式中:m,香肠样品的质量,g;V,甲醇-乙醇溶液的体积,mL;ωa,叶绿素a含量;ωb,叶绿素b含量;ωT,总叶绿素含量。
1.3.3 香肠抗氧化能力测定
1.3.3.1 丙二醛(malondialdehyde,MDA)含量测定
参考韩衍青[16]的方法,实验在冰浴上进行。将10 g香肠与50 mL 75 g/L三氯乙酸溶液均质5 min,从双层滤纸中提取2次。取5 mL上清液与5 mL 0.02 mol/L 硫代巴比妥酸溶液涡旋混匀,90 ℃条件下水浴45 min,自来水冷却至室温。测定上清液在532和600 nm处的吸光度,并按照公式(4)计算样品中MDA含量,用mg MDA/kg表示。
(4)
式中:m,香肠样品的质量,g;4.68为换算系数。
1.3.3.2 蛋白质羰基含量测定
参考LUND等[17]的方法并做适当改动:实验在冰浴上进行。将2 g香肠样品与20 mL焦磷酸缓冲液(pH 7.4)均质5 min,取2份2 mL样品与2 mL 200 g/L三氯乙酸溶液混匀,于12 000 r/min下离心5 min,弃上清液,一份样品中加入2 mL 10 mmol/L的DNPH溶液(溶剂为2 mol/L HCl溶液),另一份加入2 mL 2 mol/L的HCl溶液作为对照组。避光反应30 min(每3 min旋涡振荡10 s),分别添加2 mL 200 g/L三氯乙酸溶液沉淀蛋白,于12 000 r/min离心5 min。取沉淀于2 mL乙酸乙酯-乙醇溶液(体积比为 1∶1)中沉淀,重复洗涤3次。将沉淀溶解于2 mL 6 mol/L的盐酸胍溶液(溶剂为20 mmol/L KH2PHO4溶液,pH 2.3)中,4 ℃冷藏过夜。于12 000 r/min离心5 min,取上层清液在370 nm测定吸光值,并按照公式(5)计算羰基含量。
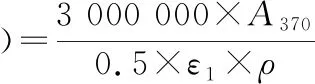
(5)
式中:ρ,蛋白质质量浓度,mg/mL;ε1,摩尔消光系数为22 000 L/(mol·cm)。
1.3.4 香肠持水力测定
根据MARTI-QUIJAL等[18]的方法对香肠的持水力进行测定,表示为香肠的烹饪损失。将香肠切为5 mm薄片,准确称取香肠质量m1。将20 mL去离子水加入含有切碎香肠样品的离心管中,搅拌均匀后室温静置24 h。20 ℃条件下于14 000 r/min离心30 min,立即取出称取质量m2。按照公式(6)计算香肠持水力。
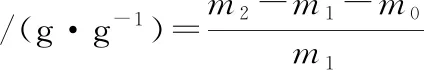
(6)
式中:m1,香肠样品干重,g;m2,离心管质量和香肠样品湿重,g;m0,离心管质量,g。
1.3.5 香肠感官评价
由8名通过基本味觉鉴定程序,并且具有定量描述分析经验的评委组成感官评价小组,进行了气味、质构、颜色及总体可接受程度分析,并最终确定香肠气味感官评定词为海苔味、紫菜味、抹茶味、青草味、鲜味、咸味、酸败味、肉腥味,对上述描述词进行定义并确定参照样(1=无气味,5=气味强烈),如表l所示。质构描述指标为咀嚼弹性(1=非常不理想,5=非常理想),颜色指标设为颜色可接受程度(1=非常不理想,5=非常理想)。可接受度指标设为总体可接受程度(1=非常不理想,5=非常理想)。使用感官分析评分尺度表进行评分。样品评定后用清水漱口,以免影响评价员的判断。
1.3.6 数据分析
每个实验组设置3个重复,采用Excel 2010软件对数据进行处理(计算平均值和标准偏差);采用SPSS Statistics 19.0软件对数据进行显著性分析,采用Origin 2018进行绘图,所有统计分析的显著水平均为P<0.05。
2 结果与分析
2.1 香肠的营养成分及含量
如表2所示,与对照组相比,低浓度添加组(0.5%)、中浓度添加组(1.5%)和高浓度添加组(3.0%)香肠中的叶绿素(13.99、45.00和95.44 mg/g),维生素C(9.49、17.63和26.44 μg/g),维生素E(3.94、9.92和15.76 μg/g)含量均显著高于对照组,并且随着小球藻添加量的增加,其含量也显著增加;1.5%和3.0%添加组香肠中的蛋白质(25.43%和27.16%)含量显著高于对照组(P<0.05),分别提高了5.39%和11.41%,这是因为蛋白核小球藻中含有丰富的蛋白质。综合而言,随着香肠中小球藻添加量增加,香肠中的营养成分及含量也增加,其中3.0%组香肠的营养成分及含量最高。在ANDRESSA的报道[19]中也发现了这一结果,说明小球藻能够增加新的营养成分,提高香肠的营养价值。
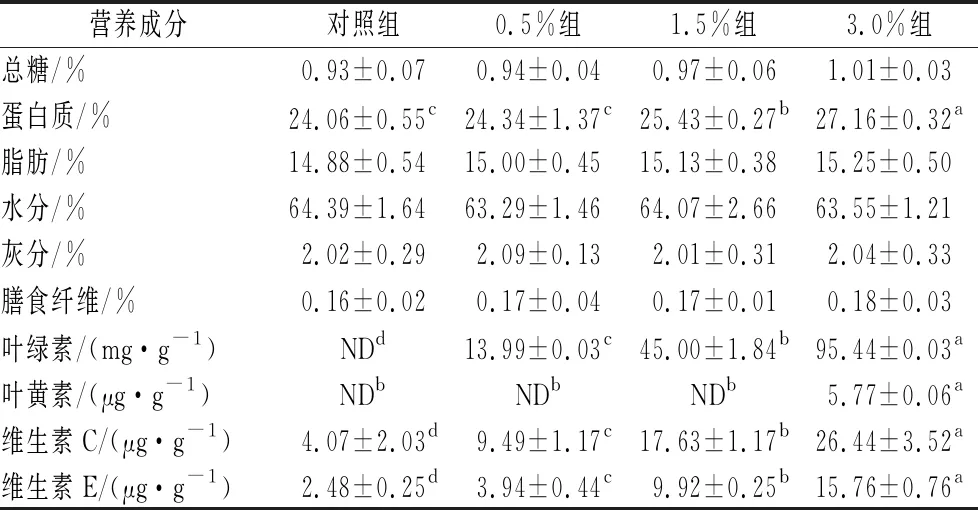
表2 香肠的营养成分及含量
2.2 香肠抗氧化能力分析
2.2.1 香肠储藏过程中的脂质氧化分析
香肠中MDA含量越多表示脂肪氧化的程度越高。如图1所示,储藏第0天时,0.5%组、1.5%组、3.0%组香肠MDA含量为2.12、1.45、0.81 mg/kg,与对照组相比分别减少了36.14%、56.33%和75.60%,均显著低于对照组。储藏第3天至第7天,0.5%组香肠的MDA含量与对照组无显著差异,可能是香肠中小球藻含量不足导致,而1.5%组和3.0%组香肠中的MDA含量上升缓慢,与对照组相比具有显著差异(P<0.05)。储藏第7天时,各处理组香肠的MDA含量分别为7.27、6.62、4.88 mg/kg,与对照组相比分别减少了7.86%、16.10%和38.15%。
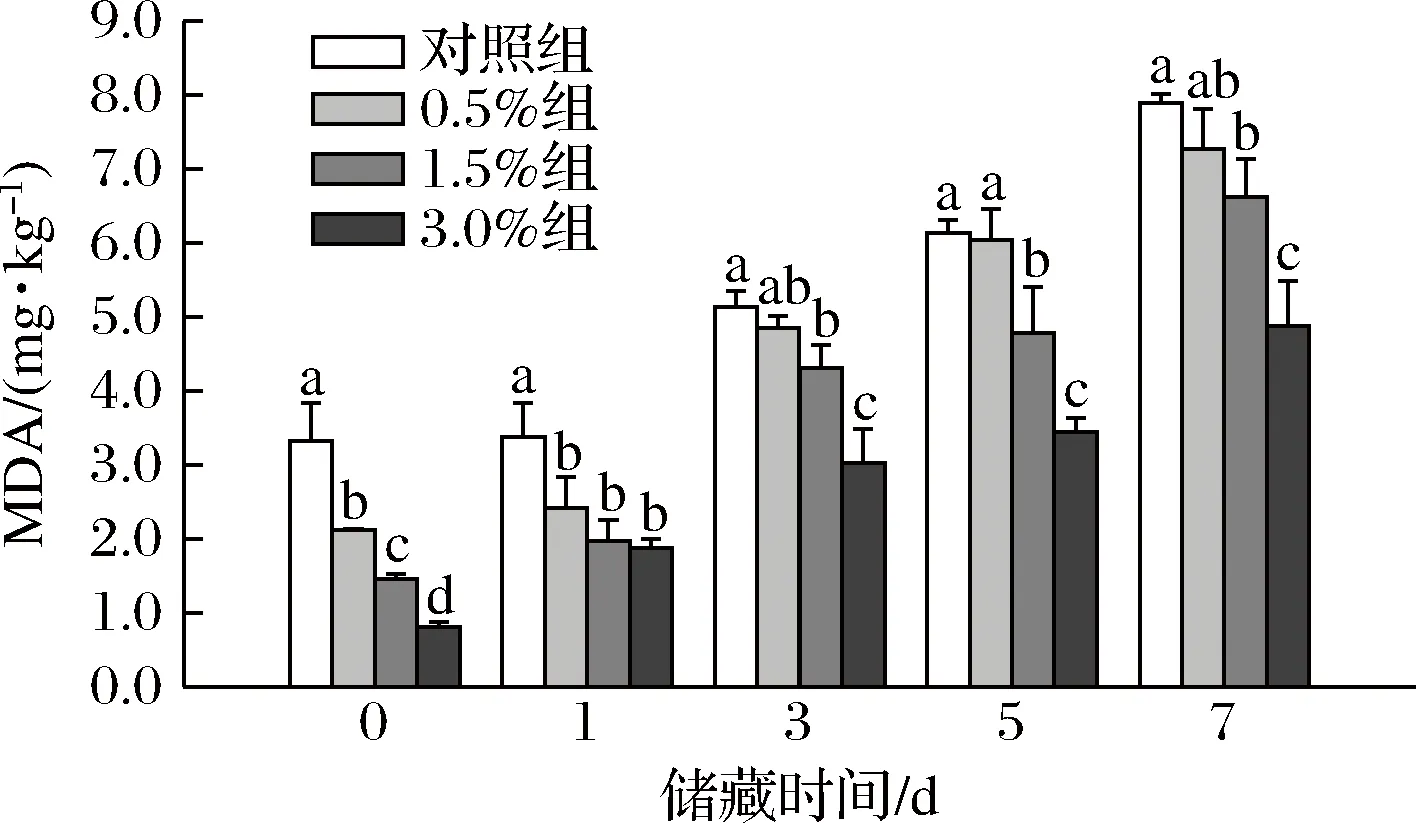
图1 不同储藏阶段香肠的脂质氧化变化
综上说明添加小球藻能够提高香肠的抗氧化能力,并与小球藻添加量呈正相关。香肠MDA含量出现显著差异的原因是因为小球藻中存在具有抗氧化作用的物质。关于小球藻具有抗氧化能力已有相关报道,GOIRIS等[20]报道了小球藻中的叶黄素、叶绿素、维生素C、维生素E和酚类物质均具有较强的抗氧化性,并能抑制熟肉中的脂质氧化,与本实验结果一致。综合结果表明小球藻能够显著抑制香肠中MDA的生成,小球藻营养强化香肠具有较好的抗脂质氧化能力。
2.2.2 香肠储藏过程中蛋白质氧化程度变化
蛋白质羰基化不仅会影响肉制品的颜色和质地,还会造成必需氨基酸等营养物质的流失,降低蛋白质的消化率[21]。如图2所示,储藏期间各实验组香肠的羰基含量均呈现上升趋势,储藏第0天时,1.5%组和3.0%组香肠羰基含量显著低于对照组和0.5%组,分别为0.29和0.26 nmol/mg,而0.5%组与对照组之间无显著差异,这一结果表明当小球藻添加量为1.5%和3.0%时能够显著抑制香肠的蛋白质氧化(P<0.05)。在同一储藏天数内,1.5%组和3.0%组香肠的羰基含量均显著低于对照组,储藏第7天时,1.5%和3.0%组香肠的羰基含量与对照组相比分别减少了9.19%和17.67%,为2.57和2.33 nmol/mg。说明高浓度添加小球藻能够显著抑制香肠在储藏过程中羰基化合物质的形成,且香肠中小球藻的添加量越高,羰基含量越低,说明香肠蛋白质氧化程度与小球藻添加量成负相关。
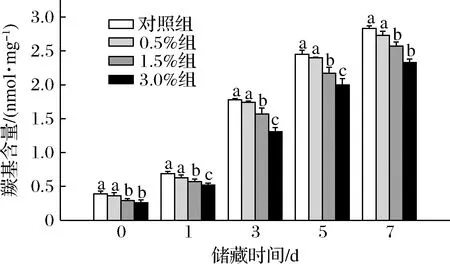
图2 不同储藏阶段香肠的蛋白质氧化程度变化
2.3 香肠储藏过程中的持水力变化
肉制品持水力大代表肉的汁液多,具有良好的加工和食用品质。图3所示,香肠的持水力随着储藏时间延长呈现下降趋势。储藏第0天至第5天,3.0%组香肠的持水力均显著高于对照组(P<0.05),而其他2个添加组与对照组无显著差异。储藏第7天时,4个处理组之间均无显著差异。3.0%组香肠持水力增强可能与小球藻中所含有的膳食纤维有关,在表2的香肠营养成分及含量结果显示,与对照组相比,3.0%组香肠中膳食纤维含量增加了11.11%。秦卫东等[22]报道在香肠中加入牛蒡膳食纤维,能够提高香肠的持水力并降低蒸煮损失,其结果与本实验结果一致。另外在PARK等[23]的报道中,添加适量膳食纤维能够较好地提高肉制品可接受程度。
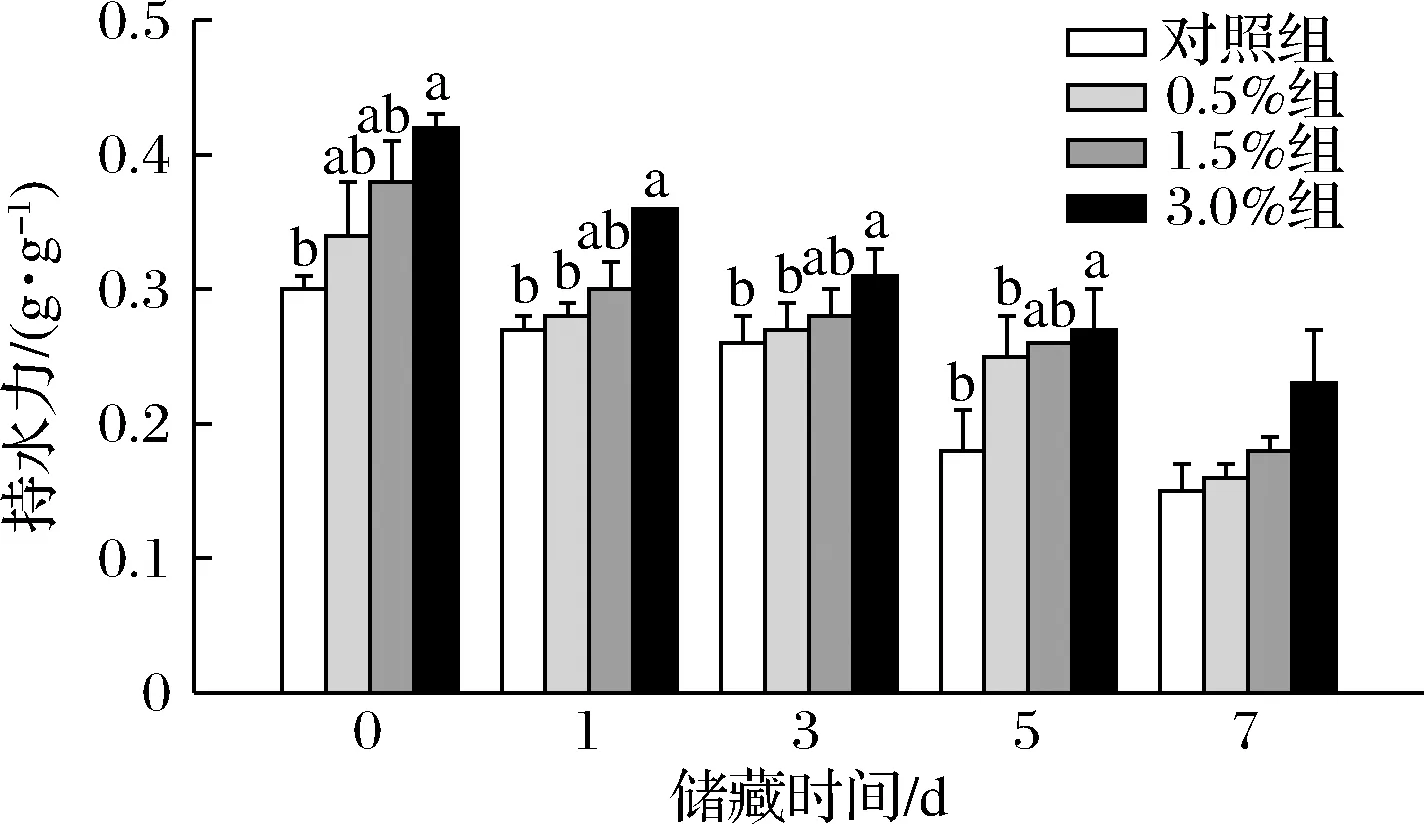
图3 不同储藏阶段香肠的持水力变化
2.4 香肠的感官评价
根据图4所示,对照组香肠的肉腥味得分最高,为2.2分,其次为0.5%组,为1.6分,1.5%组和3.0%组得分最低,均为1.4分。这一结果表明小球藻能够在一定程度上掩盖香肠的肉腥味。另外,在对香肠有积极影响的风味中,0.5%组,1.5%组,3.0%组分别在紫菜味、海苔味、抹茶味中的得分最高,为3.0分、3.7分和4.2分,说明香肠中小球藻添加量不同会导致其风味多样化。在咀嚼弹性得分中,添加组香肠的评分略低于对照组。在颜色的可接受度方面和总体可接受程度方面,1.5%组香肠的得分均为最高。以上结果表明,将小球藻作为食品添加剂添加到香肠中,可以赋予香肠特殊的风味,其中1.5%组香肠的可接受程度最高,未来可能更能够受到消费者欢迎。
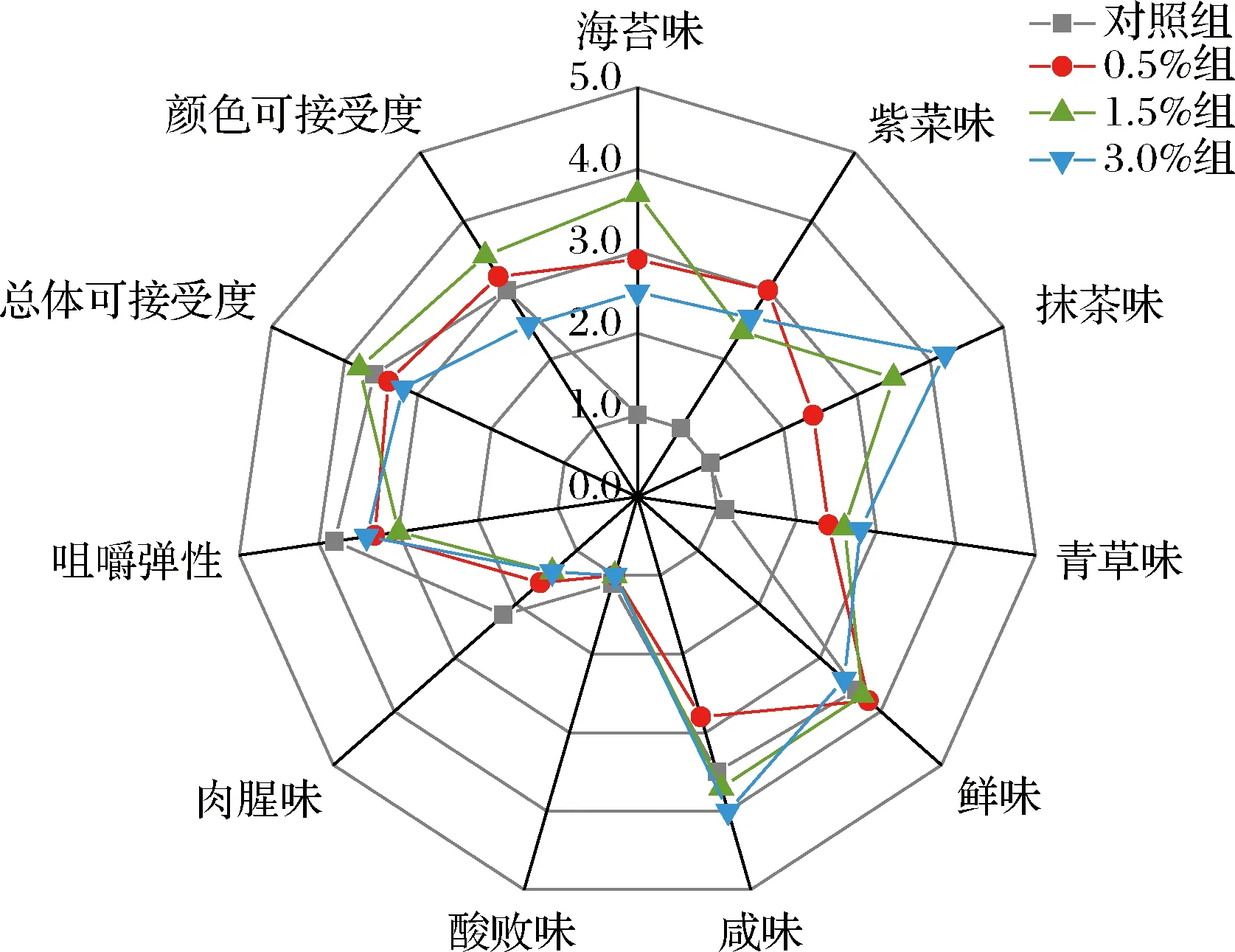
图4 香肠感官评价
3 结论与讨论
结果表明,与对照组相比,随着香肠中蛋白核小球藻含量的增加,香肠中的蛋白质、叶黄素、叶绿素、维生素C和维生素E等营养成分显著提高,其中3.0%添加组香肠的营养成分含量最高。香肠脂质氧化和蛋白质氧化分析结果表明,蛋白核小球藻可以作为天然抗氧化剂并能够显著提高香肠的抗氧化能力。感官评价结果表明,蛋白核小球藻营养强化香肠具有海苔味、紫菜味、抹茶味等特征性风味,其中1.5%添加组香肠的颜色和总体可接受程度的评分最高。由于小球藻中色素的作用,添加不同浓度的小球藻香肠会呈现不同程度的绿色,添加量越大,颜色越深,在一定程度上会影响消费者的感官体验,这也是未来研发小球藻香肠亟需解决的问题。综上所述,在香肠中添加适量的蛋白核小球藻能够提高香肠的营养价值,丰富香肠的风味,延长香肠的货架期,未来可作为食品营养强化剂应用于肉制品的生产加工中。
