藜麦蛋白的提取与超滤分离
2021-08-09唐子箫李俊华朱晓军杨严俊
唐子箫,李俊华,朱晓军,杨严俊*
1(食品科学与技术国家重点实验室(江南大学) 江苏 无锡,214122)2(国家功能食品工程技术研究中心(江南大学) 江苏 无锡,214122)3(江南大学 食品学院,江苏 无锡,214122)4(中藜农业科技(江苏)有限公司 江苏 南通,226000)
藜麦原产于南美洲,是联合国粮农组织认可的最适宜于人类食用的“全营养食品”之一[1],也被国际营养学家称之为“营养黄金”、“超级谷物”、“未来食品”[2]。同时由于藜麦可以生长在高原、海边、盐碱地区等恶劣条件下[3],近些年也已经被很多自然条件较差的亚洲国家引进并推广种植。藜麦的营养价值超过任何一种传统的粮食作物,除了丰富的钙、铁、锌、硒以及维生素等微量营养元素外,其蛋白质含量可以达到13.1%~16.7%,高于大米、大麦和玉米,且蛋白质品质不亚于肉源蛋白与奶源蛋白[4],包含了人体所需全部必需氨基酸,比例适当,数量充足。除了含有人体所需的9种必需氨基酸,特别是多数作物中第一限制性氨基酸——赖氨酸[5],还含有许多非必需氨基酸。因此,藜麦蛋白无论是作为植物基奶源,还是植物肉原料都具有十分广阔的应用前景。
然而,作为一种新兴的植物资源,目前对藜麦蛋白制备方法的研究还较为缺乏。近年来,碱提酸沉法因其操作简单、成本低、可以大规模生产等特性,成为工业中最常用的制备藜麦蛋白的方式[6-7]。但调节pH需要使用大量酸碱,造成污染同时也会使得蛋白变性。酶法制备蛋白以其条件温和、耗时短、操作简便[8]等特点,引起了一些学者的关注,但是酶法制备蛋白往往后续分离困难,纯度较低。超滤作为一种近年发展起来的新兴膜分离技术,具备操作简单、能耗低、条件相对温和等优势[9],在蛋白制备领域发挥越来越大的作用。且使用超滤的方法制备藜麦蛋白的相关研究尚未见报道。
本实验以脱皮藜麦为原料,探索利用碱液提取、超滤纯化藜麦蛋白的工艺条件,并对膜法制备藜麦蛋白进行结构组成分析与营养价值评估,以期为未来藜麦蛋白的工业化生产提供一定参考。
1 材料与方法
1.1 材料与试剂
脱皮藜麦,中藜农业科技公司;NaOH、酒石酸钾钠、蒽酮、H2SO4、Na2SO4、CuSO4·5 H2O、盐酸、溴甲酚绿、甲基红、硼酸,均为分析纯,国药集团化学试剂有限公司。实验用水均为去离子水。
1.2 仪器与设备
800Y型高速多功能粉碎机,武义海纳电器有限公司;GZX-9146MBE电热鼓风干燥箱,上海博讯实业有限公司;AB204-N型分析天平、EL20型pH计,METTLER TOLEDO(上海)公司;AAH44212K型恒温水浴摇床,韩国杰奥特公司;UH5300紫外分光光度计,日本日立公司;K9840型微量凯氏定氮仪,济南海能仪器股份有限公司;5430R型冷冻离心机,德国Eppendrof公司;SD-1500型立式喷雾干燥机,上海沃迪科技有限公司;1260自动氨基酸分析仪,美国Agilent公司;GST-3-1200型马弗炉,上海广树机电有限公司;RNF0 460-016型多功能卷式膜设备、PE50(切割分子量50 kDa)型和PE5(切割分子量5 kDa)型卷式膜,无锡海思瑞公司。
1.3 实验方法
1.3.1 藜麦蛋白的制备工艺
藜麦蛋白的制备工艺如图1所示。

图1 工艺流程图
1.3.2 藜麦蛋白浸提工艺优化
将脱皮藜麦使用室温自来水清洗2次以去除杂质,于45 ℃烘箱中烘干后粉碎。藜麦粉末通过60目筛后备用。
1.3.2.1 料液比
精确称取3 g藜麦粉末加入50 mL离心管中,按照碱液质量浓度1.25 g/L,振荡速率120 r/min,浸提时间3 h,浸提温度25 ℃,控制料液比分别为1∶4、1∶6、1∶8、1∶10和1∶12(g∶mL)在水浴摇床中进行蛋白浸提。
1.3.2.2 碱液浓度
精确称取3 g藜麦粉末加入50 mL离心管中,按照料液比1∶10(g∶mL),振荡速率120 r/min,浸提时间3 h,浸提温度25 ℃,分别控制碱液质量浓度0.5、0.75、1.00、1.25和1.5 g/L在水浴摇床中进行蛋白浸提。
1.3.2.3 浸提时间
精确称取3 g藜麦粉末加入50 mL离心管中,按照料液比1∶10(g∶mL),振荡速率120 r/min,浸提时间3 h,浸提温度25 ℃,在水浴摇床中分别提取1、2、3、4和5 h。
1.3.2.4 浸提温度
精确称取3 g藜麦粉末加入50 mL离心管中,按照料液比1∶10(g∶mL),碱液质量浓度1 g/L,振荡速率120 r/min,分别控制浸提温度25、30、35、40、45 ℃,在水浴摇床中提取3 h。
1.3.3 藜麦蛋白的超滤浓缩
1.3.3.1 超滤工艺流程
超滤工艺流程如图2所示。
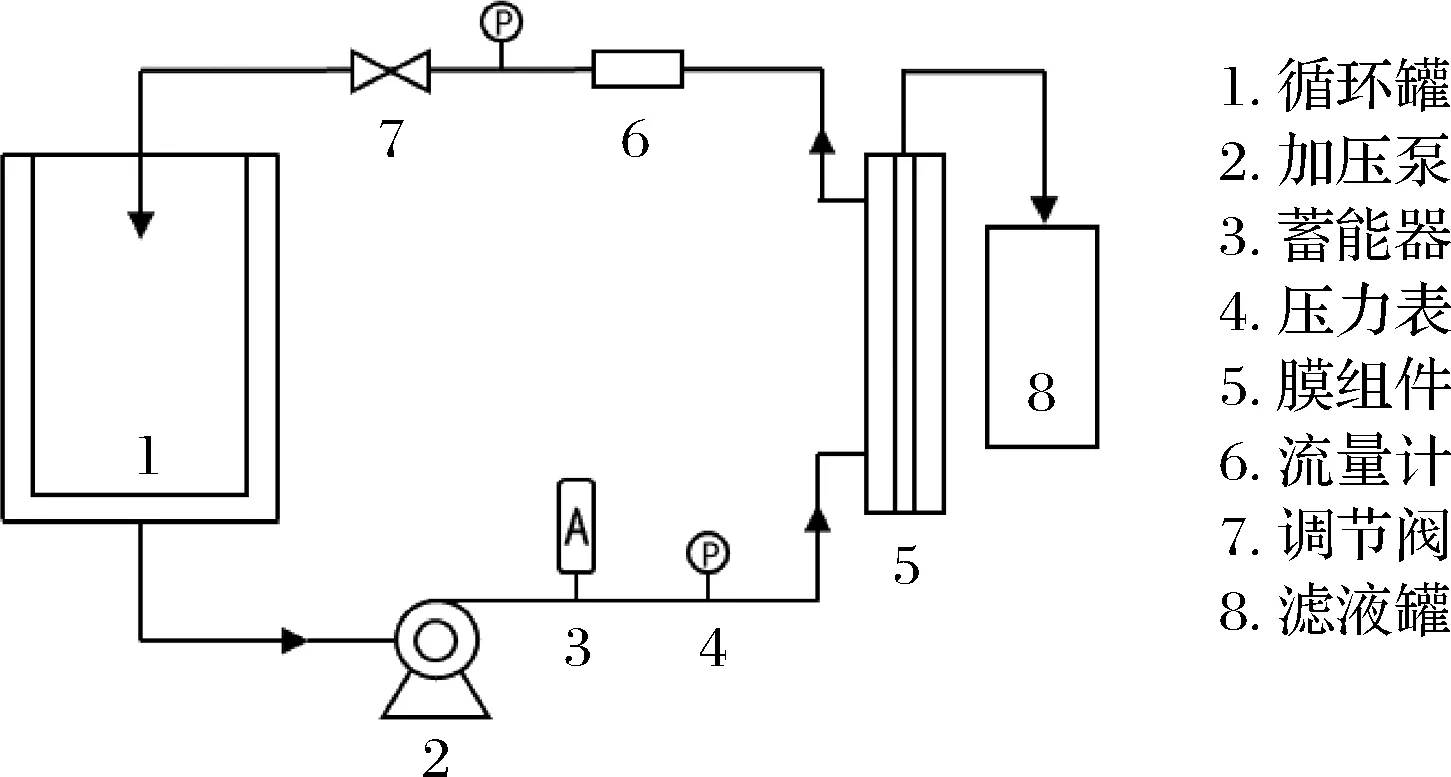
图2 超滤工艺流程
1.3.3.2 超滤膜的选择
藜麦蛋白提取液依据1.3.2 藜麦蛋白浸提工艺优化方案制备,在温度25 ℃,压强0.2 MPa,循环流量5 L/min条件下,分别测试PES50型与PES5型卷式超滤膜各项性能指标,选择浓缩蛋白工艺膜组件。
1.3.3.3 超滤工艺选择
藜麦蛋白提取液依据1.3.2 藜麦蛋白浸提工艺优化方案制备,在温度25 ℃,压强0.2 MPa,循环流量5 L/min条件下,将提取液浓缩为原有体积一半后,兑水恢复至原有体积,重复这一过程记录每一阶段初始与末尾膜通量。
1.3.4 测定方法
1.3.4.1 基本组成成分的测定
脱皮藜麦的蛋白质测定参照GB/T 5009.5—2016使用凯氏定氮法;脂肪含量测定参照GB 5009.6—2016使用索氏提取法;淀粉含量测定参照GB 5009.9—2016;膳食纤维含量测定参照GB 5009.88—2014;水分含量测定参照GB 5009.3—2016;灰分含量测定参照GB 5009.4—2016。
1.3.4.2 蛋白浓度的测定
蛋白浓度的测定使用双缩脲法[10]。
1.3.4.3 总糖浓度的测定
总糖浓度的测定使用硫酸蒽酮法[11]。
1.3.4.4 蛋白浸出率的测定
蛋白浸出率按公式(1)计算:

(1)
1.3.4.5 截留率的测定
截留率是膜分离技术的一项重要指标,指膜截留的特定溶质占溶液总特定溶质的比率,在一定条件下,被截住物质的最小分子质量即为膜的截留分子量。为了获得更高的蛋白得率,同时分离糖等小分子杂质,本课题使用截留率R表征膜的分离能力,截留率R按公式(2)计算:
(2)
式中:ρ1,透过液的总糖或蛋白质质量浓度,mg/L;ρ2,进料液的总糖或蛋白质质量浓度,mg/L。
1.3.4.6 膜通量的测定
膜通量为单位时间内通过单位有效膜面积的流量,其单位一般为L/(m2·h),高膜通量意味着可以用更短的时间在更小的膜面积下达成过滤效果。膜通量J按公式(3)计算:
(3)
式中:V,取样体积,L;t,取样时间,h;A,膜面积,m2。
1.3.4.7 溶液固形物含量的测定
固形物含量测定参考石磊等[12]使用的折光法。取超滤截留液、透过液,快速于折光仪上读数,依据温度计读数进行温差补偿,每个样品取3次分别读数并计算固形物含量(%)平均值。
1.3.4.8 蛋白得率的计算
蛋白得率按公式(4)计算:
蛋白得率/%=蛋白浸出率×R蛋白×100
(4)
1.3.5 喷雾干燥
将浓缩蛋白样品以进风温度180~190 ℃,出风温度70~80 ℃进行喷雾干燥。
1.3.6 凝胶电泳分析
参照王棐等[6]的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)方法,并稍作修改。分离胶浓度为12%,浓缩胶浓度为4%。使用20 g/L SDS,100 g/L甘油,50 g/L β-巯基乙醇和0.2 g/L溴酚蓝溶于0.01 mol/L pH 7.4的Tris-HCl缓冲液,配制2 mg/mL的蛋白溶液,沸水加热5 min后点样,上样量为10 μL。浓缩胶阶段使用电压80 V,分离胶阶段使用电压120 V。电泳结束使用考马斯亮蓝R-250染色。
1.3.7 氨基酸分析
称取0.5 mL样品至水解管中,加入8 mL 6 mol/L HCl溶液,充氮密封后,120 ℃水解22 h后,加入4.8 mL 10 mol/L NaOH溶液中和,然后用去离子水定容至25 mL,过滤,离心(10 000 r/min,30 min),取上清液,使用0.22 μm滤膜过滤。另外取相同样品进行碱水解后测定色氨酸。使用氨基酸分析仪进行分析检测。
1.3.8 营养价值评价
营养价值评价采用氨基酸评分(amino acid score,AAS)、化学评分(chemical score,CS)、必需氨基酸指数(essential amino acid index,EAAI)进行,分别按公式(5)(6)(7)计算:
(5)
(6)
(7)
式中:n,比较的氨基酸个数;a,b,…,h分别为藜麦每种必需氨基酸的含量,g/100 g (蛋白质);ae,be,…,he分别为鸡蛋蛋白质的每种必需氨基酸的含量,g/100 g (蛋白质)。
1.3.9 数据分析
数据作图采用Origin 17.0。数据均以平均值±标准偏差表示。
2 结果与讨论
2.1 碱提取工艺优化
在工业生产中,高料液比会使用更多的水,意味着需要更大的罐体,这不仅造成设备成本上升,并且使蛋白浓度较低,也会使得浓缩成本变大。而在低料液比下,由于膳食纤维等多糖类物质吸水膨胀[13],使得反应体系黏度大,传质困难,降低了浸出率。如图3-a所示,随着料液比增加,蛋白的浸出率逐渐上升,并在料液比1∶10(g∶mL)时趋于稳定,继续增加料液比并不能使蛋白浸出率上升,反而会因为提取液蛋白浓度低,造成后续蛋白浓缩困难加大。因此,浸提的料液比在1∶10(g∶mL)较为合适。
碱液浓度会影响蛋白提取率和纯度[14],从图3-b观察到,在碱液质量浓度0.5~1.25 g/L范围内,蛋白质的浸出率会持续升高,这是因为等电点偏离增加了蛋白质溶解性。同时,碱液可以破坏纤维素[15],使得藜麦的细胞壁结构疏松,进一步提高藜麦碱溶性物质的析出率。碱液浓度升高不仅会造成蛋白变性,而且会导致后续产品含盐量过高。因此选择1 g/L的碱液质量浓度进行浸提。
工业生产过程中总是希望提取时间能够保持在一个合适的范围,提取时间过短时蛋白浸出率不足,过长则会导致资源浪费和微生物污染等问题。从图3-c可知,藜麦蛋白的浸出率在3 h已经达到了最大。
温度对蛋白浸出率的影响如图3-d所示,在35 ℃时,藜麦蛋白浸出率最大。先前已有研究表明藜麦蛋白在温度较高时溶解度会下降[6],这可能是因为藜麦蛋白自身特性和藜麦淀粉糊化使体系黏度增大导致的。碱性条件下,藜麦淀粉受热更容易发生溶胀和糊化现象,阻碍蛋白析出。综合考虑,藜麦蛋白的提取条件选择35 ℃下以1∶10(g∶mL)的料液比于1 g/L的NaOH溶液中提取3 h。
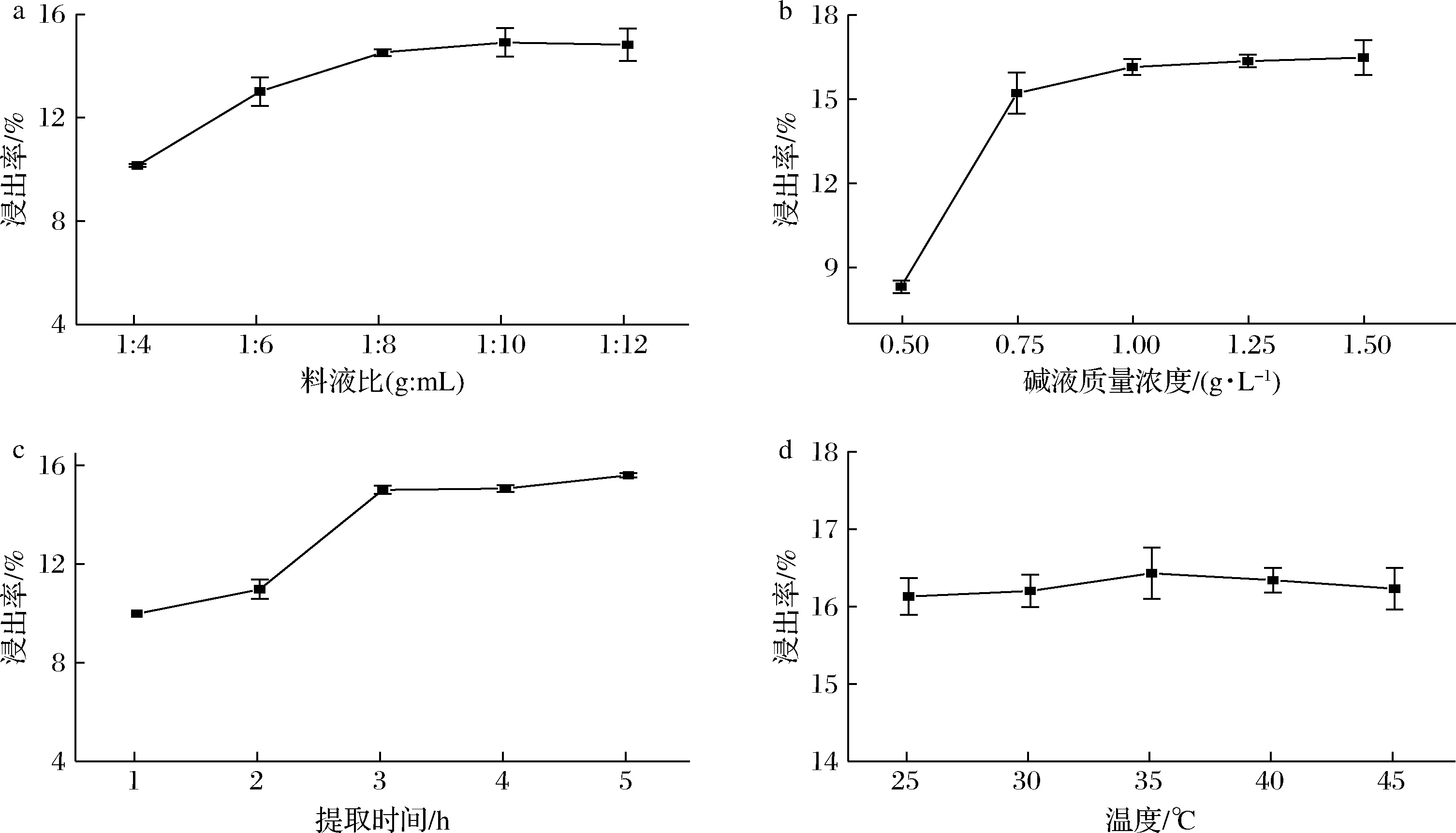
a-料液比;b-碱液质量浓度;c-提取时间;d-温度
2.2 超滤膜的选择
超滤浓缩藜麦蛋白使用膜前压强0.2 MPa进行,温度使用夹套水浴控制于25 ℃下进行,膜表面流速设定为5 L/min。对比PES50与PES5的膜通量变化,结果如图4所示。2种膜的膜通量在超滤前期均下降较快,随后逐渐稳定。PES50超滤膜的膜通量一直高于PES5。膜通量下降可能是由于膜污染和浓差极化现象导致[16-17]。在膜分离过程中,溶液体系中存在的悬浮粒子会在跨膜压强差作用下不断地堆积、吸附于膜的表面,堵塞膜孔降低膜通量;同时一些低于膜的切割分子质量的小分子蛋白也会吸附于膜通道内侧。这种膜通量的下降可以通过膜清洗恢复。

图4 膜通量变化
碱提过程中,会有一些糖类、色素等杂质伴随蛋白一同析出,而大部分这些水溶性杂质可以穿过超滤膜。但膜截留过程是复杂的物理化学过程,既包含了机械截留效应,也存在架桥现象,因此膜截留效果不仅仅取决于膜的孔径。图5对比了PES50型与PES5型超滤膜对蛋白和总糖的截留效果,两者对蛋白质的截留率相近,分别达到了97.41%(PES5)和95.58%(PES50),对总糖截留率分别是20.6%(PES5)与13.2%(PES50),但是由于PES50的膜通量大幅度高于PES5。这和江连洲等[18]利用1 k、3 k和5 kDa的超滤膜浓缩大豆蛋白的结果相似。

图5 不同超滤膜截留率对比
综上,为了降低生产成本、增加产量,综合评估,选择PES50膜进行超滤方式研究。
2.3 超滤方式的选择
张晓平等[19]在利用超滤浓缩燕麦蛋白时发现,单次连续浓缩方式会使得膜通量大幅度下降,浓缩效率低。本实验使用等体积兑水的方式对藜麦蛋白多次浓缩纯化,结果如图6所示,随着兑水次数上升,蛋白占固形物的含量也不断地上升,其中第1次浓缩增长幅度最大,由44.21%提至60.12%,这和周大寨等[20]兑水超滤芸豆蛋白质的研究结果相似。在兑水阶段,截留液固形物含量基本维持不变,而透过液固形物含量则持续下降。在第4次兑水时,透过液固形物含量下降到0.28%,蛋白质占截留液固形物含量的69.99%,可推测此时影响蛋白纯度的杂质多为大分子杂质,已经很难通过膜处理的方式持续提高纯度。
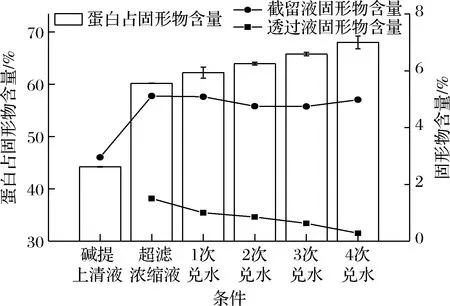
图6 等体积兑水对超滤效果的影响
等体积兑水对膜通量的变化影响如图7所示,可以观察到,每一次浓缩液兑水稀释之后膜通量都会大幅度恢复,在浓缩后期又会下降。这表明了在藜麦蛋白浓缩过程中,最主要的阻碍作用就是浓差极化现象。这种现象产生原因是蛋白浸出液中,溶液在压强差存在下透过膜,而大分子物质无法透过膜,会在膜表面区域形成一个具有明显浓度梯度差的区域。在高浓度区域的溶质会以浓度差为驱动力,持续向低浓度区域扩散,并形成边界层。这个边界层会阻碍压强差驱动的膜传质过程,降低膜通量。
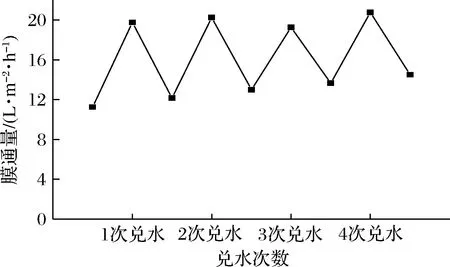
图7 等体积兑水对膜通量的影响
2.4 膜浓缩蛋白分析
使用浓缩2倍的藜麦蛋白进行喷雾干燥后对产品进行分析,成分分析如表1所示。利用碱提膜浓缩方式生产藜麦蛋白得率达到了81.24%,显著高于王棐等[6]利用碱提酸沉法得率为67.13%和田格等[8]利用酶法制备藜麦蛋白的得率为76.82%。同时碱提膜浓缩可以显著提高藜麦蛋白纯度,但仍然低于ALUKO等[21]报道的65.52%。由于藜麦蛋白的超滤制备研究较少,对比其他谷物类蛋白超滤浓缩研究[9],本实验膜法制备藜麦蛋白的脂肪含量较高。这极有可能是因为没有对藜麦原料进行脱脂处理,在浸提阶段,脂肪会与蛋白质乳化形成脂肪球,离心无法使得油相与水相分离。同时这些脂肪球也无法通过超滤膜,最终导致膜制备藜麦蛋白的纯度不高。
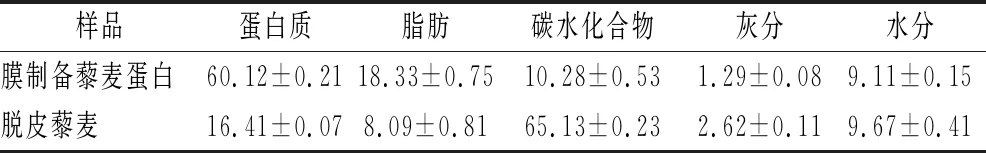
表1 脱皮藜麦和膜制备藜麦蛋白成分组成 单位:%
使用还原性SDS-PAGE分析藜麦超滤浓缩蛋白的结构如图8所示。膜浓缩藜麦蛋白的亚基组成和酸沉蛋白的亚基组成相似。藜麦膜浓缩蛋白的主要组成成分是11S球蛋白、7S球蛋白和2S白蛋白。其中藜麦的11S球蛋白是由6个分子质量在22 k~26 kDa的碱性亚基和6个分子质量在33 k~36 kDa的酸性亚基组成的六聚体结构。11S球蛋白的分子质量大约在320 kDa。60 kDa的条带则对应着7S球蛋白[22]。而藜麦的2S白蛋白主要是由8 k~9 kDa的多肽链构成[23]。
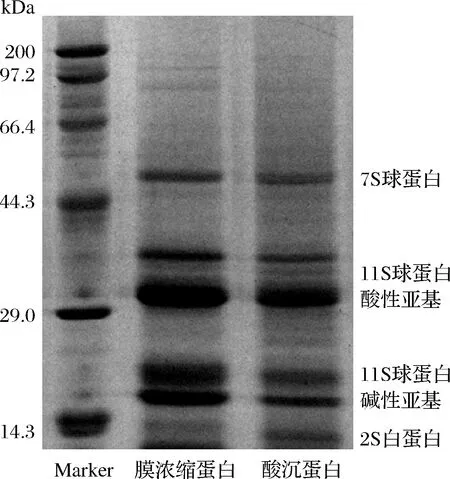
图8 藜麦蛋白电泳图
氨基酸组成分析结果如表2所示,与NAVARRO-LISBOA等[24]研究结果不同,通过PES50型超滤膜制备藜麦蛋白,可以保持氨基酸组成相对稳定。这可能是因为PES50型超滤膜的截留分子量远小于其研究使用的300 kDa陶瓷超滤膜,因此可以截留更多分子量较低的藜麦蛋白成分。

表2 氨基酸组成分析
膜制备藜麦蛋白的营养价值评价如表3所示,1991年FAO/WHO建议食物中蛋白质必需氨基酸含量应当接近40%[25]。而藜麦蛋白的必需氨基酸占比为38.3%,非常接近这一标准。AAS反映了氨基酸所占比例与FAO/WHO推荐模式的接近程度,越接近100则越适合人类。结果显示,尽管赖氨酸作为藜麦蛋白的第一限制性氨基酸,但评分依然达到了95,十分接近100。CS结果表明藜麦蛋白的第一限制性氨基酸为蛋氨酸与半胱氨酸。EAAI作为综合评价食品蛋白质质量的指标,反映了食品蛋白质与理想的全蛋蛋白质之间的接近程度,目前被广泛应用于蛋白质营养评价。藜麦浓缩蛋白的EAAI计算结果为78,这显著高于小麦蛋白的EAAI(60)[26]。综合来看,藜麦浓缩蛋白的氨基酸种类齐全,配比合理,是一种非常优质的蛋白资源。
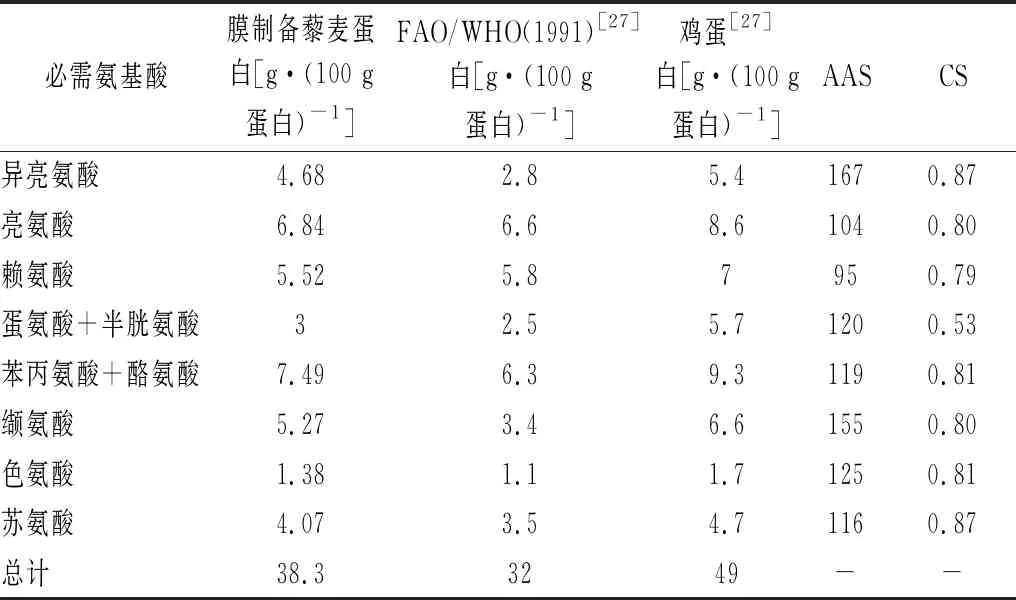
表3 藜麦蛋白的营养价值评价
3 结论
本实验通过利用碱提取工艺浸出藜麦蛋白,使用膜浓缩工艺对蛋白进行提纯。经过工艺优化,选择碱提条件为35 ℃下,以1∶10(g∶mL)的料液比于1 g/L的NaOH溶液中提取3 h,膜浓缩使用PES50膜,在0.2 MPa工作压强下,25 ℃循环浓缩2倍后喷干,最终藜麦蛋白的得率相较于其他研究中使用的碱提酸沉法高23.99%,达到了81.24%,纯度为60.12%。可以使用脱脂工艺和多次兑水工艺继续提高蛋白纯度。电泳结果表明藜麦浓缩蛋白主要是由球蛋白和白蛋白构成。通过氨基酸分析和营养评价,发现利用超滤浓缩藜麦蛋白,可以较大程度保持藜麦蛋白优异的氨基酸组成模式。因此,膜方式生产藜麦蛋白是一种可行的方法。
