亚慢性铝染毒对大鼠海马CPEB3及突触可塑性的影响
2021-08-07纪晶晶王艳妮王国美夏轶徐义荣吴惠文
纪晶晶,王艳妮,王国美,夏轶,徐义荣,吴惠文
1.山西医科大学汾阳学院,山西 汾阳 032200
2.山西医科大学公共卫生学院,山西 太原 030001
铝在地壳元素中含量位居第三,广泛应用于人类的生产生活中,而且铝与阿尔茨海默病等神经退行性疾病有关[1]。铝可以穿透血脑屏障[2-3],是一种明确的神经毒物,易蓄积在海马组织,导致认知功能损害。目前人们认为铝主要引起学习记忆能力下降,而突触可塑性下降是铝致学习记忆受损的主要机制,神经元的突触可塑性包括结构可塑性和功能可塑性,无论是结构还是功能可塑性都需要大量突触可塑性相关蛋白质(synaptic plasticity related proteins,PRPs)的合成。研究发现,铝暴露可以不同程度抑制突触膜上受体蛋白如AMPA 型谷氨酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionicacid receptor,AMPAR)的表达,降低突触传递效能;而且铝可以使突触可塑性相关的下游蛋白分子如环磷腺苷效应元件结合蛋白(cAMP response element binding protein,CREB)等活性下降、表达减少,从而引起突触可塑性下降[4-5]。
多聚腺苷酸化元件结合蛋白3(cytoplasmic polyadenylation element-binding protein 3,CPEB3)是一种高度保守、序列特异的mRNA 结合蛋白。通过与靶mRNA 的多聚腺苷酸序列结合,参与mRNA 的多聚腺苷酸化,来控制靶mRNA 的翻译[6]。研究发现CPEB3是一种新的参与突触可塑性和学习记忆的重要调节因子,通过调控突触局部mRNAs 的翻译来控制多种突触可塑相关蛋白(synaptic plasticity-related protein,PRPs)的合成,从而参与长时程突触可塑性的维持[7-9],在长时程记忆中发挥着分子开关的作用。研究发现,CPEB3 可以与离子型谷氨酸受体1(ionic glutamate receptor 1,GluR1)mRNA 结合通过促进mRNA 多聚腺苷酸化水平,调节GluR1蛋白的合成[7,10]。CPEB3还可以通过同样机制在转录后水平影响离子型谷氨酸受体2(ionic glutamate receptor 2,GluR2)和突触后致密蛋白95(postsynaptic dense protein 95,PSD95)的表达,影响突触可塑性[11]。
那么铝是否可以影响CPEB3 进而影响突触可塑性蛋白的表达,参与铝致学习记忆损害的分子过程呢?本研究通过建立亚慢性染铝动物模型,探讨CPEB3 作为铝的神经毒性潜在治疗靶点可能性,为亚慢性铝暴露患者的治疗提供新的思路。
1 对象与方法
1.1 材料
1.1.1 实验动物清洁级健康2月龄雄性SD大鼠40只,购自中国食品药品检定研究院,许可证号SCXK(京)2017-0005,体重180~200 g。饲养于12 h 光暗循环的洁净动物房,温度为(22±2)℃,自由饮水饮食。本研究经山西医科大学汾阳学院动物伦理委员会审查批准(编号:201801)。
1.1.2 实验试剂和仪器AlCl3·6H2O 和麦芽酚(美国Sigma 公司),GAPDH 抗体(中国北京康为公司),CPEB3、PSD95、GluR1、GluR2、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)抗体(英国Abcam 公司),CREB 抗体(美国Gene Tex 公司),RNAiso Plus、PrimeScriptTMRT reagent Kit 试剂和SYBR Premix Ex Taq Ⅱ(日本TaKaRa 公司)。RT-qPCR 仪(美国赛默飞公司),Morris 水迷宫及视频轨迹跟踪分析系统(中国深圳瑞沃德公司),电泳仪(中国北京六一),Bio-Rad 化学发光成像系统(美国Bio-Rad 公司)。
1.2 方法
1.2.1 动物分组及铝暴露随机数字法将大鼠分为4组,对照组、低剂量组、中剂量组和高剂量麦芽酚铝组,每组10只。麦芽酚铝[Al(mal)3]溶液的配制方法参照Li等[12]制备方法,根据世界卫生组织推荐的人体每周允许铝最低暴露量1 mg·kg-1[13],换算为大鼠的低染毒剂量,并按照2 倍梯度递增,得到中、高染毒剂量组。对照组大鼠给予等体积0.9%氯化钠溶液,实验组分别为低剂量组(10 μmol·kg-1)、中剂量组(20 μmol·kg-1)和高剂量组(40 μmol·kg-1)的Al(mal)3染毒组。腹腔注射染铝,每100 g 体重染毒量为0.1 mL,隔天染铝,持续3 个月。实验期间,每日观察各组大鼠饮水与饲料消耗情况、精神状况及整体状况等。
1.2.2 Morris 水迷宫实验实验装置为一个高45 cm、直径100 cm的圆形水池,平台位于其中一个固定象限水面下1~2 cm。前5 d进行定位航行实验,每天将大鼠随机从4 个象限面向池壁放入水中,记录其找到水面下平台时间,训练时长为120 s,若120 s 未找到平台者,引导大鼠找到平台停留10 s。第6天为空间探索实验,移除平台,随机选一个象限入水,记录大鼠在120 s内目标象限停留时间和穿越平台的次数。
1.2.3 Western blotting 检测PRPs和CPEB3 的表达水平麻醉大鼠,断头处死,冰上分离海马。称量海马,提取总蛋白。BCA 法将各组蛋白定至同一浓度,加入5×上样缓冲液,100℃煮沸变性5 min后,保存在-80℃。8%SDS-PAGE 分离胶和3.9% SDS-PAGE 积层胶,上样量均为60 μg,电泳60 V 120 min,转膜400 mA湿转70 min,将蛋白转移至PVDF 膜。5%脱脂奶粉封闭2 h;一抗CPEB3、PSD95、GluR1、GluR2、CREB、BDNF 和 GAPDH(稀释比为1:500、1:1 000、1:2 000、1:2 000、1:500、1:500 和1:3 000),4℃孵育过夜,次日以TBST 洗10 min,3 次;37℃孵育二抗2 h,TBST 洗10 min,3 次。ECL 试剂显影,凝胶成像仪检测。
1.2.4 免疫组化检测CPEB3 蛋白的表达量将石蜡切片置于二甲苯中脱蜡,梯度酒精脱水;3% H2O2室温孵育30 min;枸橼酸抗原修复液热修复2 min;BSA封闭液37℃孵育30 min;一抗(1:200)4℃孵育过夜;二抗37℃孵育30 min;链霉素生物素复合物37℃孵育30 min;DAB 显色,苏木素浸染1 min,1%盐酸酒精分化3~5 s,自来水冲洗返蓝5 min;再次梯度酒精脱水、二甲苯透明脱蜡,中性树胶封片,显微镜观察。
1.2.5 RT-PCR 检测PRPs mRNA的表达量提取总RNA,测定总RNA 的纯度及浓度,引物序列见表1。使用PrimeScriptTMRT reagent Kit with gDNA去除基因组DNA和反转录得到cDNA 产物,去除基因组DNA 反应条件:42℃ 2 min,4℃;反转录反应条件:37℃ 15 min,85℃ 5 s,4℃;使用TB Green Premix Ex TaqTMII 进行RT-PCR,条件:95℃ 30 s,1 个循环;95℃ 5 s,60℃30 s,40 个循环;95℃ 60 s,65℃ 30 s,95℃ 1 s,1 个循环。每个样品做3个复孔,各样品Ct值经内参基因标化后,根据2-ΔΔCt公式计算各组PRPsmRNA的表达量。
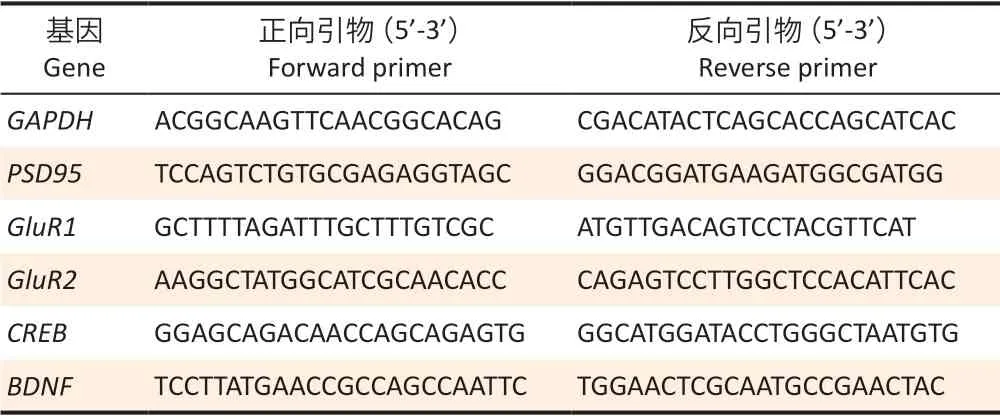
表1 引物序列Table 1 Primer sequence
1.3 统计学分析
采用SPSS 22.0 进行数据处理,数据均用均数±标准差表示,组间比较采用单因素方差分析,若方差齐,采用LSD 检验;若方差不齐,采用Tamhane’s T2检验。检验水准α=0.05。
2 结果
2.1 染毒期间大鼠的基本情况
对照组大鼠,饮食饮水正常,生长状态良好,体重逐渐增加至(475.6±31.5)g。低剂量组大鼠各方面接近对照组,体重逐渐增加至(473.9±29.1)g,未见明显异常。中、高剂量组大鼠活动减少,摄食减少,体重增加缓慢,分别为(468.2±22.7)、(464.4±21.8)g。经统计分析,各组之间体重差异无统计学意义。
2.2 染铝后大鼠学习记忆能力下降
水迷宫结果显示,随着训练时间的增加,各组逃避潜伏期呈下降趋势。与对照组相比,中剂量染铝组大鼠在第3、4、5 天的逃避潜伏期分别延长了4.88、7.24、3.92 s,高剂量染铝组在第3、4、5天的潜伏期分别延长了6.41、9.27、6.08 s(P<0.05)(图1A)。
空间探索实验结果显示,与对照组相比,第6 天中、高剂量染铝组大鼠的目标象限停留时间分别减少了13.21、16.46 s,穿越平台的次数分别减少了0.9、1.6 次,见图1B、1C。各组大鼠的典型路径图显示,各组随着训练天数的增加,大鼠寻找平台的路径逐渐清晰,但染铝组大鼠路径仍表现紊乱(图2)。
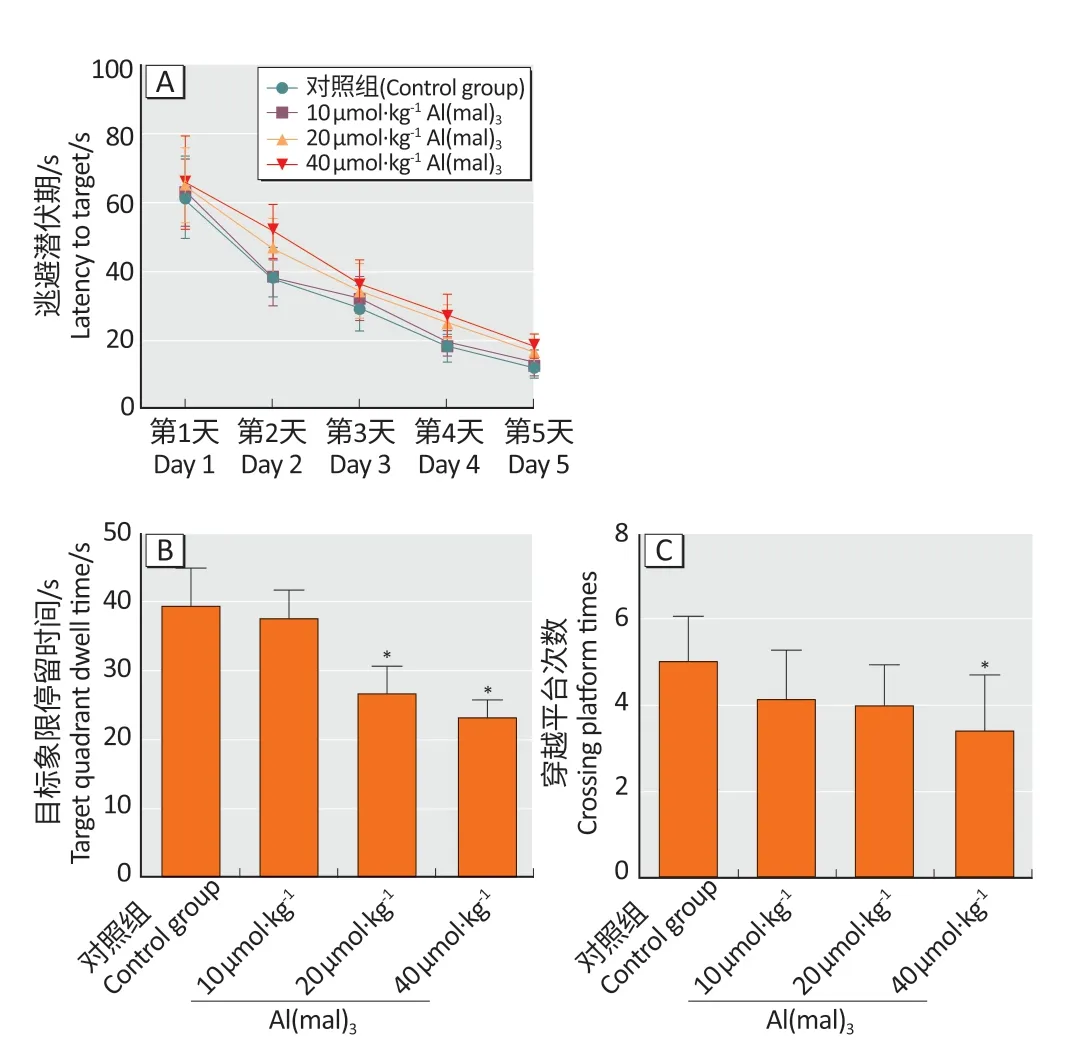
图1 亚慢性染铝对大鼠逃避潜伏期(A)、目标象限停留时间(B)、穿越平台次数(C)的影响(n=10)Figure 1 Escape latency (A),time of staying in target quadrant(B),and times of crossing platform (C) of rats after subchronic aluminum exposure (n=10)
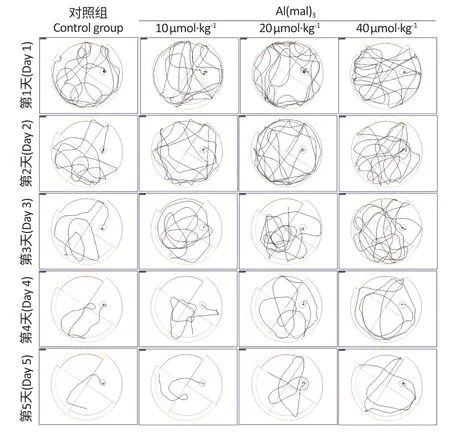
图2 大鼠亚慢性铝染毒后在空间探索实验中的路径图(n=10)Figure 2 Representative path tracks of rats after subchronic aluminum exposure during spatial exploration trails (n=10)
2.3 染铝后大鼠海马PRPs蛋白和mRNA水平下降
图3A、3B 显示,随着染铝剂量的增加,大鼠海马组 织PRPs(PSD95、GluR1、GluR2、CREB 和BDNF)蛋白表达水平逐渐降低。与对照组(1.00±0.00)相比,中和高剂量染铝组海马PRPs(PSD95:0.45±0.08 和0.28±0.06;GluR1:0.38±0.07 和0.31±0.06;GluR2:0.45±0.08和0.33±0.09;CREB:0.58±0.11和0.41±0.07;BDNF:0.49±0.03 和0.33±0.05)蛋白表达水平明显降低(P<0.05)。与中剂量染铝组(0.45±0.08和0.58±0.11)相比,高剂量染铝组海马PSD95和CREB(0.28±0.06和0.41±0.07)蛋白表达水平降低(P<0.05)。
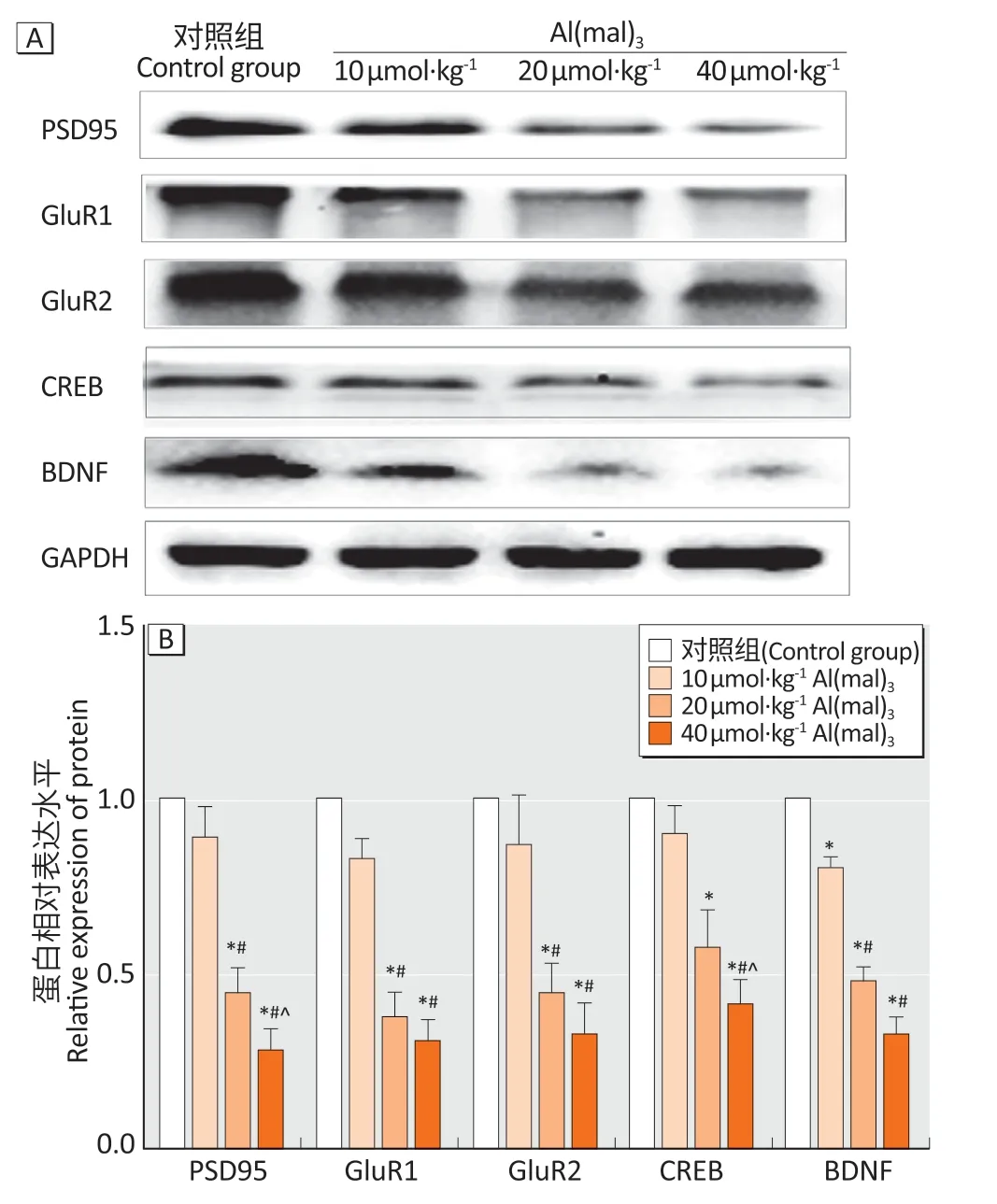
图3 亚慢性铝染毒对大鼠海马组织PSD95、GluR1、GluR2、CREB和BDNF蛋白表达的影响(n=10)Figure 3 Hippocampal PSD95,GluR1,GluR2,CREB,and BDNF protein expression levels of rats after subchronic aluminum exposure (n=10)
图4显示,与蛋白表达结果一致,随着染铝剂量的增加,大鼠海马中PRPsmRNA 表达水平均逐渐降低。其中高剂量染铝组海马PSD95和CREBmRNA与中剂量染铝组相比表达差异不大,但是蛋白表达明显降低(P<0.05)。
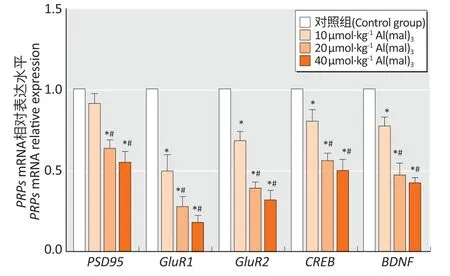
图4 亚慢性铝染毒对大鼠海马组织PRPs mRNA 表达的影响(n=10)Figure 4 Hippocampal PRPs mRNA expression levels of rats after subchronic aluminum exposure (n=10)
2.4 染铝后大鼠海马CPEB3蛋白表达水平降低
图5显示,随着染铝剂量的增加,大鼠海马CPEB3 蛋白表达水平逐渐降低。与对照组和低剂量染铝组(1.00±0.00 和0.85±0.09)相比,中、高剂量染铝组海马CPEB3 蛋白(0.50±0.06 和0.33±0.07)表达水平明显降低,差异有统计学意义(P<0.05)。与中剂量染铝组(0.50±0.06)相比,高剂量染铝组海马CPEB3蛋白(0.33±0.07)的表达降低,差异有统计学意义(P<0.05)。
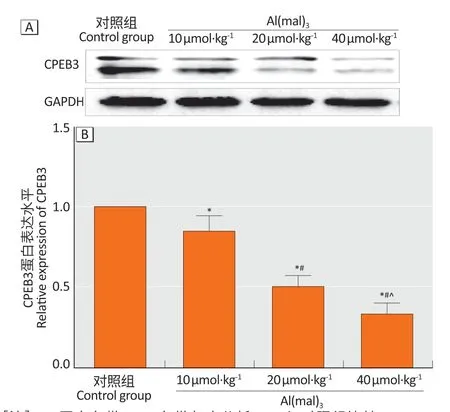
图5 亚慢性铝染毒对大鼠海马组织CPEB3蛋白表达的影响(Western blotting,n=10)Figure 5 Hippocampal CPEB3 protein expression levels of rats after subchronic aluminum exposure (Western blotting,n=10)
免疫组化方法检测大鼠海马组织CPEB3 蛋白表达,如图6所示,CPEB3 主要分布在大鼠海马组织神经元胞质,阳性细胞表现为棕色或褐色着色的细胞(图中红色箭头所示),染色区域增加或着色加深。随着染毒剂量的增加,CPEB3 蛋白的阳性细胞表达逐渐减少,且棕褐色区域逐渐变小,着色逐渐变淡。
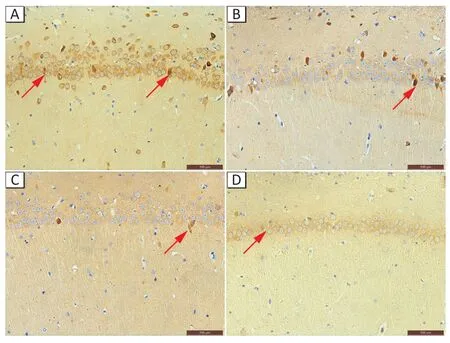
图6 亚慢性铝染毒对大鼠海马组织中CPEB3蛋白表达的影响(免疫组化法)Figure 6 Subchronic aluminum exposure induced changes in hippocampal CPEB3 protein expression levels of rats(Immunohistochemistry)
3 讨论
铝是地壳中含量最丰富的金属元素[14],广泛存在于生产生活的各个方面,通过各种途径进入人体,蓄积于脑组织中,从而对人体产生神经毒性[15]。本研究Morris 水迷宫实验结果显示,亚慢性染铝大鼠逃避潜伏期延长,目标象限停留时间和穿越平台的次数缩短,说明Al(mal)3损害了大鼠的空间学习和空间记忆能力。
铝的神经毒性核心是学习记忆能力下降,学习和记忆的神经生物学基础是突触可塑性。突触可塑性是指突触的形态和功能可发生较为持久改变的特性或现象,包括结构和功能可塑性[16-17]。突触可塑性的维持依赖于大量的突触末端突触可塑性蛋白质的合成。PSD95 是突触后膜上重要的脚手架蛋白,主要存在于成熟的兴奋性谷氨酸能突触内[18],和N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)结合并在突触后膜共聚集,调节兴奋性突触的功能和可塑性[19]。AMPAR 介导了中枢神经系统快速兴奋性突触传递,其在突触后膜的动态表达维持长时程增强(long-term potentiation,LTP),对突触可塑性和学习记忆有重要作用[20-21]。GluR1 和GluR2 是AMPAR 的重要组成部分,对突触传递、LTP、长时程抑制(longterm depression,LTD)和空间学习记忆的维持至关重要[22-23]。CREB 是控制长期突触可塑性和长期记忆的核心成分[24-25],是短期记忆到长期记忆的转换分子,可以介导长时程记忆过程中所需要的新基因转录和蛋白质合成[26]。BDNF 是树突生长的重要因子,调节突触的传递、LTP 和蛋白质的翻译,它的降低会损害突触可塑性[27-28]。以上研究表明这些蛋白均参与突触可塑性的维持,统称为PRPs。研究表明,铝可以降低大鼠海马PSD95 和AMPAR 亚基GluR1 和GluR2,抑制AMPAR外化,损伤突触可塑性和学习记忆能力[29-31]。铝暴露抑制大鼠海马CREB,改变突触结构和功能可塑性,导致长期记忆受损[32-33]。铝降低大鼠海马BNDF蛋白表达,损伤海马的突触可塑性和学习记忆能力[34]。这与本研究结果一致,染铝后大鼠海马组织中突触可塑性相关蛋白(PSD95、GluR1、GluR2、CREB 和BDNF)的表达也明显降低,从而提示铝是通过影响PRPs 蛋白的合成从而降低突触的结构和功能可塑性,导致学习记忆能力受损。
为了更进一步阐述CPEB3 在突触可塑性下调中的分子机制,本研究检测了染铝大鼠海马组织中CPEB3蛋白的表达情况,结果表明随着染毒剂量的增加,海马组织中CPEB3 蛋白表达逐渐下降。而且CPEB3基因敲除小鼠在Morris 水迷宫、物体位置识别等实验中记忆明显受损,损害了空间学习记忆能力[7,35-36]。因此CPEB3 参与了铝致大鼠学习记忆受损的过程。CPEB3蛋白是一种序列特异性的RNA 结合蛋白,可以与靶mRNAs 特异性结合,通过调控其多聚腺苷酸化水平来调控靶mRNA 的翻译过程。研究表明CPEB3 主要出现在突触局部,可以通过调控突触局部的突触可塑性蛋白mRNAs 的翻译来控制PRPs 的合成,作为突触末端的调控突触可塑性蛋白表达的开关分子,参与长时程突触可塑性的维持[7,36]。研究表明AMPAR(GluR1 和GluR2)和PSD95 均为CPEB3 调控的靶mRNAs,可以通过mRNA 转录后调控,影响蛋白翻译水平。而且敲除CPEB3后,相应靶蛋白明显下降,随之带来学习记忆能力下降[36-37]。这与本研究结果一致,本研究表明染铝大鼠的海马组织中CPEB3 蛋白表达受到抑制,而且伴随着PRPs 蛋白和mRNA 表达下调。因此推测,作为突触末端的分子开关,CPEB3 可能通过调控多种突触可塑性蛋白的翻译来参与铝致突触可塑性下降的分子机制。然而CPEB3 的转录后调控和翻译调控非常复杂,在神经系统发挥着重要作用[38],其分子机制有待于以后更深入的研究。
综上所述,本研究证明亚慢性染铝可以导致大鼠学习记忆能力受损以及突触可塑性蛋白下调,提示其可能通过影响突触可塑性开关分子CPEB3 的表达从而抑制海马组织中PRPs 的合成,引起学习记忆能力受损。但由于实验方法的局限,本研究并未进一步研究铝是如何影响CPEB3,以及CPEB3 如何调节PRPs,这将是本课题组日后的研究方向。
