长链非编码RNA BRE-AS1在非小细胞肺癌中的表达及其调控功能
2021-08-07王娴张艳秋申娴尹立红浦跃朴梁戈玉
王娴,张艳秋,申娴,尹立红,浦跃朴,梁戈玉
1.东南大学 a.公共卫生学院 b.环境医学工程教育部重点实验室,江苏 南京 210000
2.江苏省泰州市疾病预防控制中心环境职业卫生科,江苏 泰州 225300
肺癌是中国新发病例和死亡人数最多的癌症[1]。2020年,中国肺癌新发病例数为815 563,占新发癌症数的17.9%;因肺癌死亡714 699人,占癌症总死亡人数的23.8%[2]。除遗传因素外,吸烟、汽车尾气、雾霾等环境因素是肺癌的主要危险因素[3]。肺癌最主要的病理学亚型为非小细胞肺癌(non-small cell lung cancer,NSCLC),占比超过80%[4]。大多数NSCLC 患者发现时已为癌症末期,难以治愈[5]。此外,许多NSCLC患者会在手术后复发[6],这些癌症末期和复发患者的生存率很低[5]。因此,世界卫生组织呼吁进一步探索NSCLC 的发病机制,在NSCLC 的诊断和治疗中应重视分子生物标志物,以便早期筛查,监测疾病进展,提供治疗靶标,改善患者预后。
长链非编码RNA(long non-coding RNAs,lncRNAs)是一类不编码蛋白质的调节性RNA,其异常表达与多种疾病有关,包括恶性肿瘤[7]。研究发现lncRNAs参与了NSCLC 的发生发展,如BRCA1 相邻基因2 通过调控Notch1 信号通路抑制NSCLC 上皮间充质转化进程[8],过渡前相关RNA 可促进NSCLC 细胞增殖、迁移和侵袭[9],叉头蛋白F1 毗连非编码发育调控RNA 通过与miR-761 结合并调节尿金属蛋白酶2 表达来抑制NSCLC 的发展[10]。目前人细胞中鉴定出的lncRNA 超过50 000 种,大多数lncRNA 的表达、作用和机制尚不明确,迫切需要进一步研究。
本课题组前期应用芯片筛选NSCLC 相关lncRNAs,发现脑和生殖器官表达蛋白反义RNA 1(brain and reproductive organ-expressed protein antisense RNA 1,BRE-AS1)在NSCLC 中表达下调[11]。BRE-AS1是长度为1 659 bp的非编码RNA,位于2p23.2染色体[12]。脑和生殖器官表达蛋白(brain and reproductive organ-expressed protein,BRE)是存在各种组织中稳定细胞蛋白,主要功能为DNA 损伤修复和抗细胞凋亡[13]。BRE-AS1可调控多种肿瘤细胞的生物学功能。例如,BRE-AS1可通过与miR-145-5p 相互作用调节前列腺癌细胞的增殖和凋亡[14];过表达BRE-AS1可以通过抑制信号转导和转录激活因子3 的磷酸化抑制膀胱癌细胞增殖[15],但BRE-AS1在NSCLC中的功能尚未明确。因此,本研究从多角度检测BRE-AS1在NSCLC中的表达,并探索BRE-AS1的诊断能力、生物学功能以及调控机制,为进一步了解NSCLC 发病机制提供新的理论依据。
1 对象与方法
1.1 研究对象
本次研究收集91 例原发性NSCLC 患者(无放疗或化疗史)的肿瘤组织及其配对癌旁组织样本,患者来自江苏省南京市胸科医院。采集后立即置于RNA保存液中,4℃过夜后-20℃保存备用,同时记录所有患者临床信息。人支气管样上皮细胞(16HBE)、人肺泡上皮细胞(HpAEpiC)、NSCLC 细胞(A549 和NCI-H1395)均来自环境医学工程教育部重点实验室,均采用含10%胎牛血清、1%双抗的DMEM 培养基于37℃培养箱中培养。本研究已通过东南大学附属中大医院伦理委员会审批(编号:2014ZDSYLL031.0),并获得患者签署的知情同意书。
1.2 试剂与仪器
RNA保存液(Tiandz,中国),TRIzol试剂(Invitrogen,加拿大),RIPA裂解液(汉恒,中国),特异引物(捷瑞,中国),胎牛血清(四季青,中国),SYBR Green试剂盒(Promega,美国),双抗(国药集团,中国),培养基(四季青,中国),A214 试剂盒(GenStar,中国),KGA512周期检测试剂盒(凯基,中国),CCK8试剂(Beyotime,中国),异丙醇(国药集团,中国),KGA107 凋亡检测试剂盒(凯基,中国),BRE-AS1过表达慢病毒及相应的阴性对照慢病毒(汉恒,中国),嘌呤霉素(白鲨易,中国);NanoDrop 2000 光谱仪、酶标仪(Thermo Fisher Scientific,美国),StepOnePlus实时PCR(Applied Biosystems,加拿大)等。
1.3 方法
本研究首先检测了BRE-AS1在NSCLC 组织样本和不同肺癌细胞中的表达,同时分析了BRE-AS1在癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中的表达,和组织及细胞的表达相互印证,并评估了BRE-AS1的诊断能力及与NSCLC 临床特征之间的关系;其次通过慢病毒转染在肺癌A549 细胞中过表达BRE-AS1,检测BRE-AS1对细胞增殖、周期和凋亡的影响;最后通过功能富集分析BRE-AS1的下游通路,并通过Western blotting法检测BRE-AS1对下游磷酸肌醇3-激酶(phosphatidylinositide 3-kinase,PI3K)-蛋白激酶B(protein kinase B,AKT)-哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路关键蛋白的影响。
1.3.1 NSCLC 组织和细胞中BRE-AS1 表达的检测及分析应用实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)技术检测组织或细胞中BRE-AS1的表达。首先用TRIzol 试剂从组织或细胞中提取总RNA,并用NanoDrop 2000光谱仪测量纯度和浓度。再用A214 试剂盒将RNA 逆转录成cDNA。通过StepOnePlus 实时PCR 系统检测目标mRNA 表达。PCR 反应组分包括1 μL cDNA、5 μL SYBR Qpcr Mix、0.1 μL 特异引物和3.8 μL 无酶水。反应条件为预变性95℃ 1 min;变性95℃ 15 s,退火60℃30 s,延伸72℃ 30 s,共40个循环。特异引物序列见表1。BRE-AS1表达水平采用2-ΔΔCt法计算,用差异表达倍数(fold change,FC)表示BRE-AS1在各组织中的差异表达情况,FC=-1/2-ΔΔCt。采用受试者工作特征(receiver operating characteristic,ROC)曲线及其曲线下面积评价BRE-AS1的诊断能力。应用独立样本t检验分析不同临床特征(性别、年龄、肿瘤淋巴结转移分期、病理类型)的NSCLC 患者的BRE-AS1表达水平有无差异。

表1 lncRNA BRE-AS1 和内参基因GAPDH 的引物序列Table 1 Primer sequences of lncRNA BRE-AS1 and GAPDH
1.3.2 TCGA 数据库中BRE-AS1 表达分析从TCGA 数据库(更新于2020年10月)下载1 016 例NSCLC 患者肿瘤组织与110 例正常肺组织测序数据。应用TCGA RNASeqV2 系统提取NSCLC 组织与正常肺组织中lncRNABRE-AS1表达数据。采用受者工作特征曲线及其曲线下面积评价BRE-AS1诊断能力。
1.3.3 构建BRE-AS1 过表达A549 肺癌细胞模型通过慢病毒转染,过表达A549 细胞中的BRE-AS1,并设置三个实验组:LV-BRE-AS1组、阴性组和空白组。将BRE-AS1过表达慢病毒和阴性对照慢病毒用感染增强液稀释至1×108TU·mL-1,感染融合度50%左右的A549细胞,72 h 后用含2 μg·mL-1嘌呤霉素的培养基持续培养两周后得到LV-BRE-AS1组和阴性组,正常培养细胞为空白组。最后利用RT-qPCR 技术检测慢病毒转染效率。
1.3.4 细胞增殖能力检测使用CCK8 法检测过表达BRE-AS1对A549 细胞增殖能力的影响。将LV-BRE-AS1组和阴性组细胞种于96 孔板(每孔3 000 个细胞)中正常培养12、24、36、48 h 后,每孔中加入10 μL CCK8试剂,在37℃下反应2 h 后,在酶标仪中于450 nm 波长处测量光密度值。
1.3.5 细胞周期与凋亡检测使用KGA512 周期检测试剂盒评估过表达BRE-AS1对A549 细胞周期的影响。各实验组收集1×106个细胞,逐步加入0.5 mL乙醇,混匀后4℃过夜。在洗净的细胞沉淀中加入0.1 mL的RNaseA,置于37℃水浴锅中30 min,加0.4 mL RNaseA PI 混匀后4℃避光反应30 min,使用流式细胞仪检测488 nm处与DNA结合的PI红色荧光强度。
使用KGA107凋亡检测试剂盒评估过表达BRE-AS1对A549 细胞凋亡的影响。A549 细胞转染96 h 后,各实验组收集1×106个细胞,洗净的细胞沉淀中加入0.1 mL结合缓冲液、0.005 mL Annexin V-APC 和0.01 mL 7-ADD 混匀后避光放置15 min,加0.38 mL 结合缓冲液后,1 h 内用流式细胞仪检测细胞凋亡情况。
1.3.6 富集分析和蛋白分析通过差异分析TCGA和课题组前期三对NSCLC 及癌旁组织芯片测序的数据[11]获得NSCLC 相关差异mRNA,并取交集。然后,通过R 语言cluster profiler 包进行功能富集分析,包括基因本体论(Gene Ontology,GO)富集和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG),分析寻找受lncRNABRE-AS1影响的信号通路。
应用Western blotting法检测PI3K-AKT-mTOR信号通路中关键蛋白表达水平的变化。收集细胞并用RIPA裂解液提取总蛋白后,电泳分离蛋白条带后转膜,封闭后置于4℃孵育一抗(兔抗人IgG-HRP)过夜。一抗孵育后洗涤,加入二抗(山羊抗兔IgG-HRP)室温孵育1 h。蛋白表达由ECL 化学发光系统测量。
1.4 统计学分析
应用SPSS 22.0 软件和Excel 2016 软件进行统计分析。结果以均数±标准差表示。应用t检验、卡方检验和单因素方差分析各组之间的差异,检验水准α=0.05。
2 结果
2.1 BRE-AS1 在NSCLC中表达
RT-qPCR 结果显示,与癌旁组织相比,BRE-AS1在NSCLC 组织中表达下调(FC=-13.15,P<0.05,图1A)。TCGA 数据库分析结果显示,与正常组织相比,BRE-AS1在NSCLC 组织中表达也下调(FC=-4.85,P<0.05,图1B)。此外,细胞检测结果表明,与16HBE 和HpAEpiC 细胞相比,A549 细胞中BRE-AS1表达下调(FC=-4.87,P<0.05,图1C),而NCI-H1395 中BRE-AS1表达无统计学差异(P>0.05,图1C)。
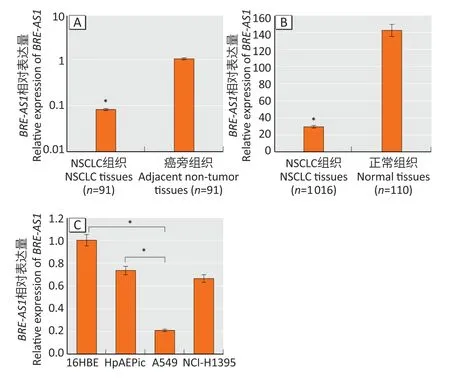
图1 BRE-AS1 在NSCLC组织(A、B)及细胞(C)中的表达水平Figure 1 Expression levels of BRE-AS1 in NSCLC tissues (A and B)and cells (C)
2.2 BRE-AS1 对NSCLC的诊断能力
结果如图2所示,肺癌患者组织BRE-AS1诊断的ROC 曲线下面积为0.916,95%CI为0.872~0.960,灵敏度为85.6%,特异度为85.7%(图2A);TCGA 数据库中BRE-AS1诊断的ROC 曲线下面积为0.853,95%CI为0.809~0.897,灵敏度为84.5%,特异度为66.1%(图2B),提示BRE-AS1对NSCLC 具有较高的诊断能力。
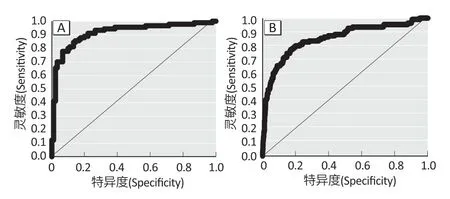
图2 BRE-AS1 诊断NSCLC的ROC曲线Figure 2 ROC curve of BRE-AS1 in predicating NSCLC
2.3 不同临床特征的NSCLC患者的BRE-AS1 表达差异
不同性别和病理类型的NSCLC 患者的BRE-AS1表达水平存在差异(P<0.05),男性患者低于女性,肺鳞状细胞癌患者低于肺腺癌患者(表2)。不同年龄和肿瘤淋巴结转移分期的NSCLC 病人的BRE-AS1表达水平无统计学差异(P≥0.05)。
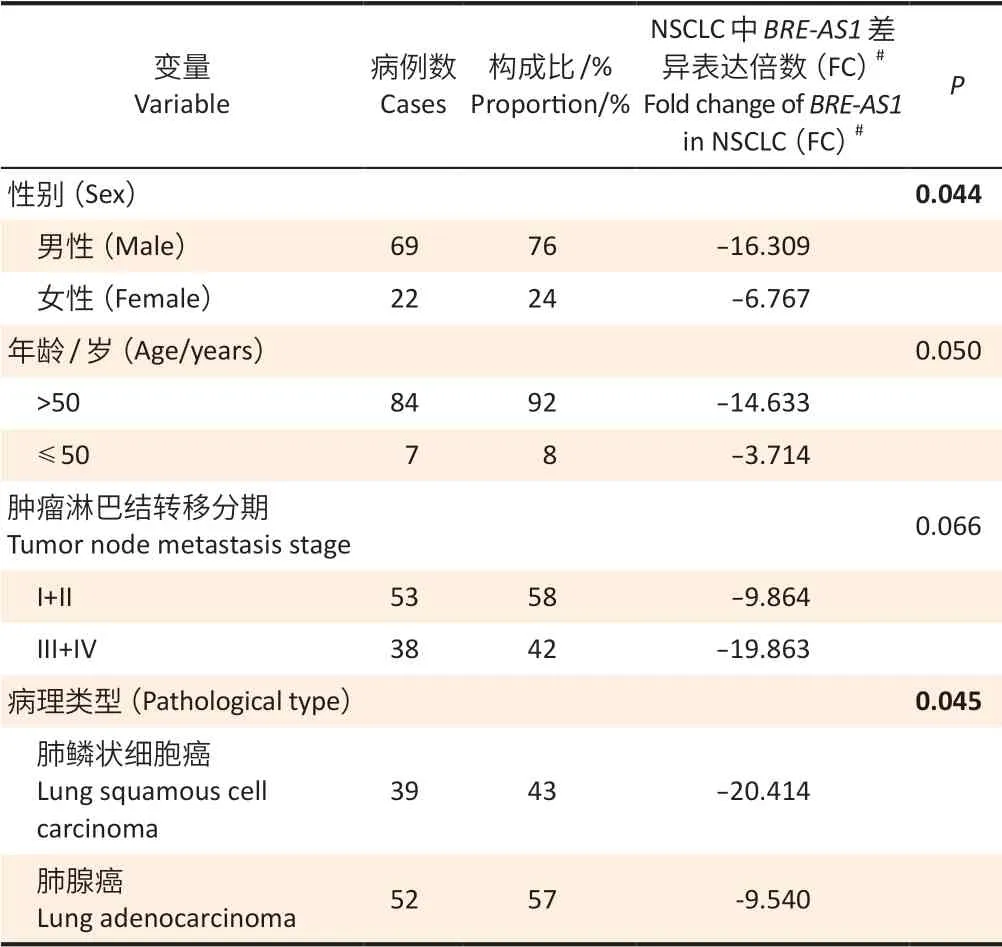
表2 不同临床特征的NSCLC 患者的BRE-AS1 表达差异分析Table 2 Expressions of BRE-AS1 in NSCLC patients with different clinical characteristics
2.4 过表达BRE-AS1 抑制A549细胞增殖
以A549 细胞作为研究对象,并利用慢病毒构建BRE-AS1过表达稳转细胞株(图3A-C)。图3D 结果表明,与阴性组相比,LV-BRE-AS1组的光密度值在24、36、48 h 降低(P<0.01),提示过表达BRE-AS1可抑制A549细胞的增殖。
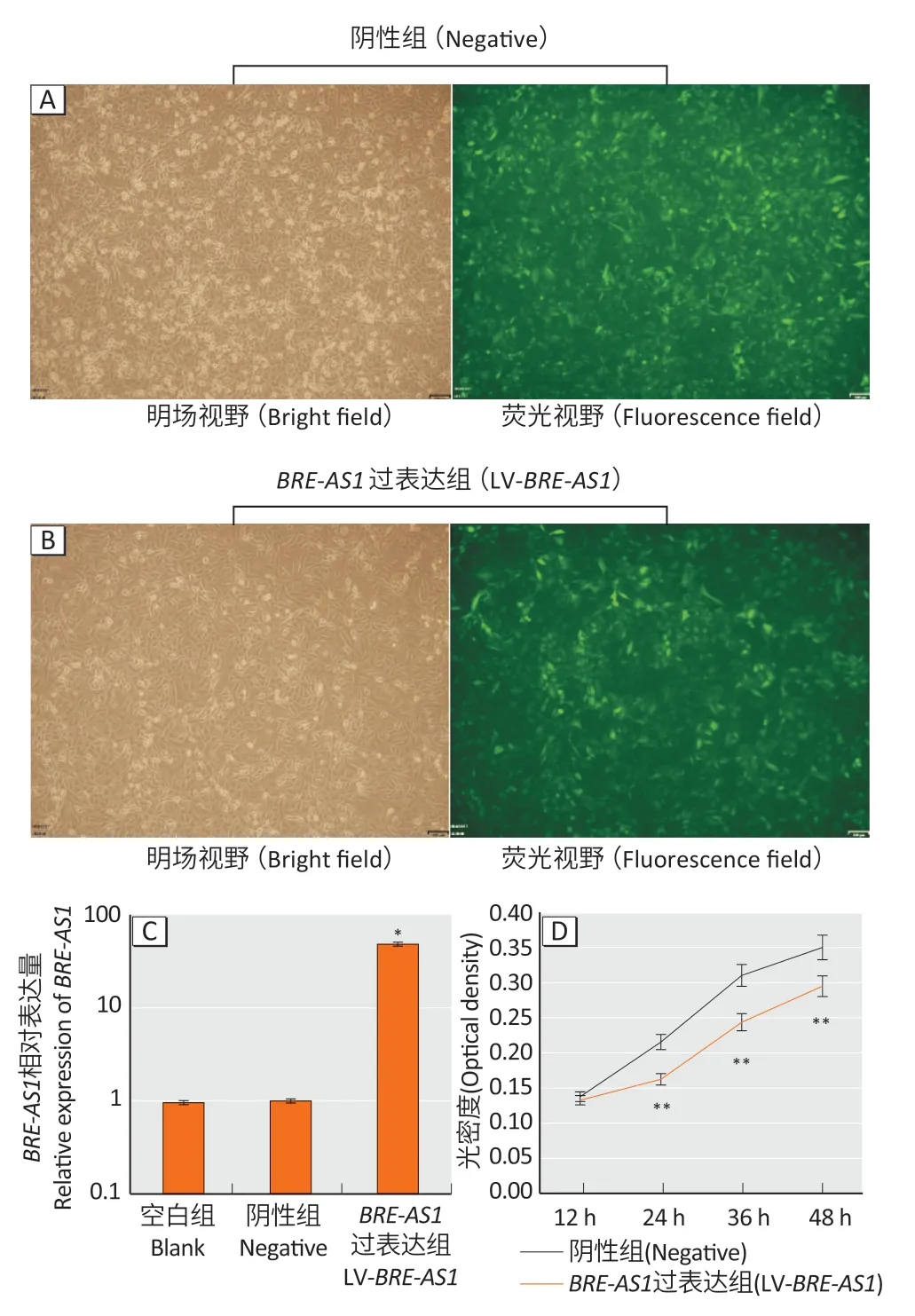
图3 BRE-AS1 过表达稳转细胞株的构建(A、B、C)及BRE-AS1 对A549细胞增殖的影响(D)Figure 3 Building stable BRE-AS1 over-expressed cells (A,B,and C)and effect of BRE-AS1 over-expression on A549 cell viability (D)
2.5 过表达BRE-AS1 影响A549细胞周期与凋亡
细胞周期检测结果显示,与阴性组相比,LVBRE-AS1组中S 期比例降低,G2/M 期中比例升高(P<0.01),提示过表达BRE-AS1可阻滞A549 细胞周期于G2/M 期(图4A)。细胞凋亡检测结果表明,与阴性组相比,LV-BRE-AS1组的晚期凋亡和总凋亡比例增加(P<0.05),提示BRE-AS1过表达可诱导A549 细胞凋亡(图4B)。
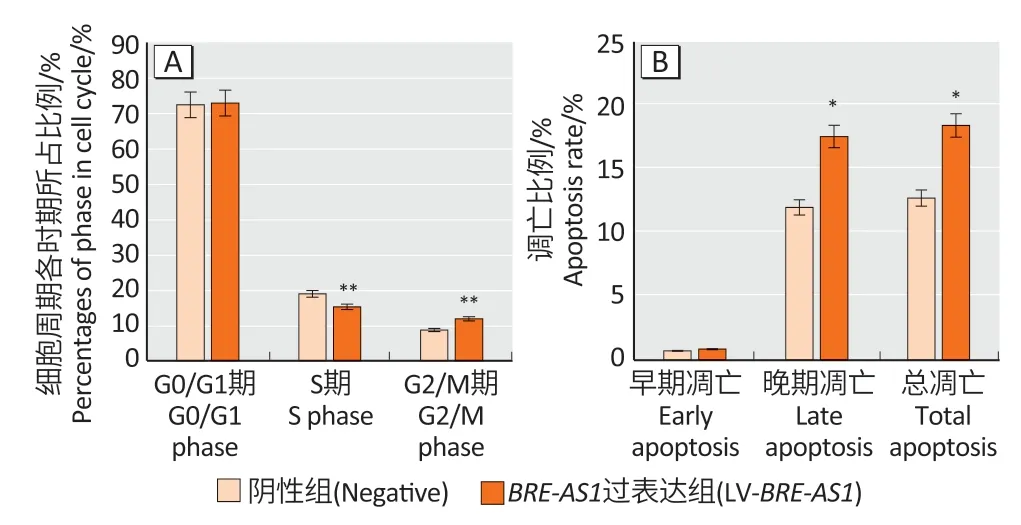
图4 BRE-AS1 过表达对A549细胞周期(A)和细胞凋亡(B)的影响Figure 4 Effect of BRE-AS1 over-expression on cell cycle (A) and cell apoptosis (B) in A549 cells
2.6 过表达BRE-AS1 对PI3K-AKT-mTOR 信号通路的影响
功能富集分析发现,NSCLC 相关差异mRNA 主要富集于133 种基因功能条目以及22 种信号通路(图5A、5B,P<0.05),其中PI3K-AKT信号通路基因富集数量最多,因此,推测BRE-AS1可能通过PI3K-AKT 信号通路介导NSCLC 生物功能。Western blotting 分析结果表明,与阴性组相比,LV-BRE-AS1组中AKT3、p-AKT3、mTOR、p-mTOR 表达降低,PTEN 表达增高(图5C、5D),且p-AKT3/AKT3 及p-mTOR/mTOR 也降低(图5E、5F,P<0.05),提示过表达BRE-AS1可抑制PI3K-AKTmTOR 信号传导途径。
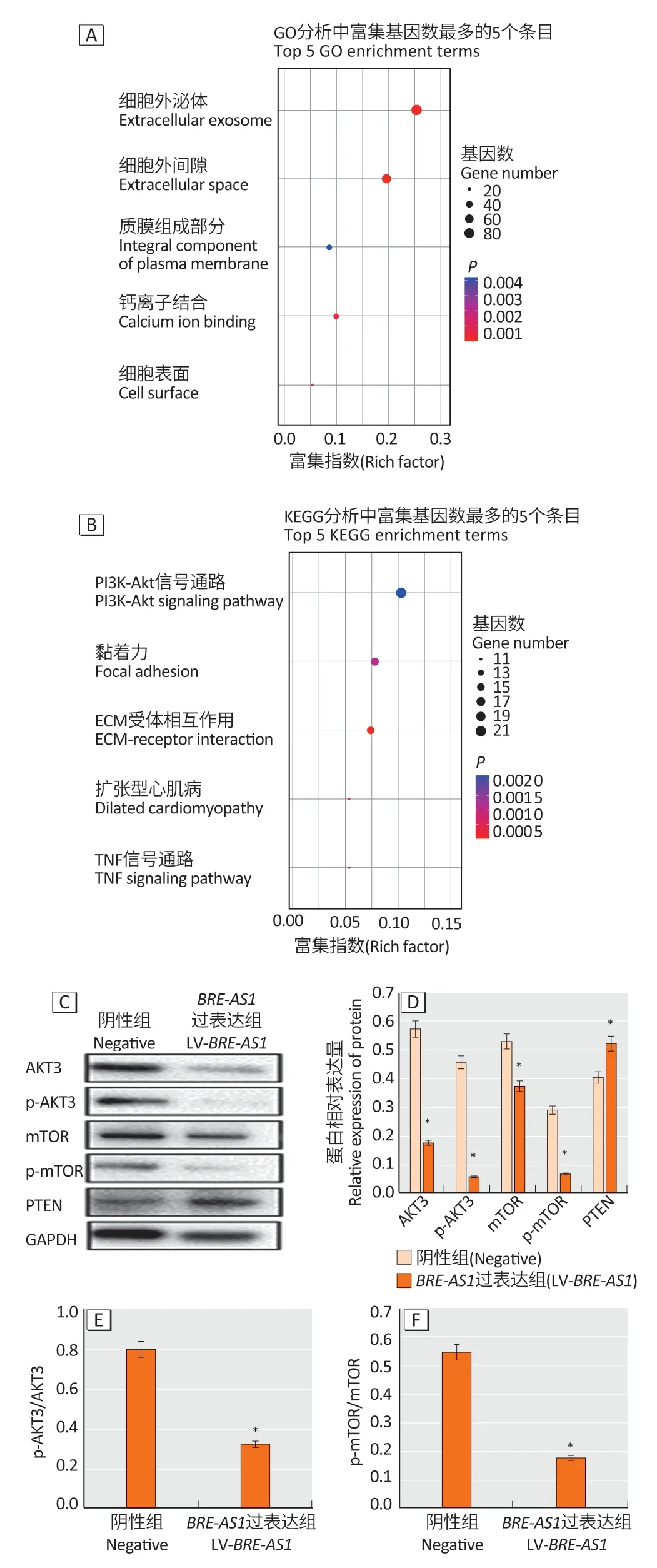
图5 非小细胞肺癌中BRE-AS1 相关的GO(A)和KEGG(B)富集分析及蛋白印迹分析结果(C-F)Figure 5 BRE-AS1 related GO (A) and KEGG (B) enrichment analysis results in NSCLC and Western blotting results (C-F)
3 讨论
近年来,NSCLC 新发和死亡病例逐年增多,疾病负担严重。由于缺乏有效筛查手段,早期NSCLC 难以及时发现,晚期及复发NSCLC 难以治愈[16],因此NSCLC 生存率很低[17],迫切需要进一步探索NSCLC 的发病机制,为寻找更加有效、实用、经济的生物标志物提供理论依据[18]。
随着分子生物学技术的不断成熟[19],越来越多的lncRNA被发现。lncRNA是转录长度超过200 nt 但缺乏蛋白质编码能力的RNA 分子,研究表明其具有调控肿瘤发生发展的能力[20]。例如被转化生长因子β 激活的长链非编码RNA 在肝癌、结直肠癌、胃癌和肺癌等多种肿瘤中异常表达,并且可以通过结合miRNA 诱导上皮间质转化来促进肿瘤发生和进展[21];lncRNA 肺癌相关转录物1 在肺癌、肝癌、乳腺癌等肿瘤中高表达,可通过多种机制调节肿瘤的增殖、侵袭和迁移[22]。这些研究提示lncRNA 也可能在NSCLC 发生发展中发挥重要作用。
课题组前期对原发性NSCLC 组织lncRNA 芯片检测中发现,BRE-AS1在癌组织中表达下调[11]。为进一步探讨BRE-AS1在NSCLC中的作用,本研究首先检测了NSCLC患者组织、TCGA数据库、NSCLC细胞中BRE-AS1表达,发现BRE-AS1在NSCLC 组织及细胞中表达下调,进一步分析发现,BRE-AS1对NSCLC具有较高的诊断价值,且男性患者BRE-AS1的表达水平明显低于女性,肺鳞状细胞癌患者明显低于肺腺癌患者,提示BRE-AS1和男性肺鳞状细胞癌患者的发病关系更加密切。既往研究发现了一些与NSCLC 相关的重要lncRNA,如被转化因子β 激活的长链非编码RNA、lncRNA 肺癌相关转录物1 和烟酰胺核苷酸转氢酶反义RNA1 等在NSCLC中表达上调[21-23],转录超保守区454 等在NSCLC 中表达下调[24]。关于BRE-AS1的报道较少,Zhang 等[12]通过GEO 数据库分析同样发现BRE-AS1在NSCLC 中表达下调,与本研究结果相互印证。
通过细胞实验进一步揭示BRE-AS1在NSCLC 中的功能,结果显示过表达BRE-AS1可抑制NSCLC 细胞增殖,阻滞细胞周期,促进细胞凋亡。既往研究显示不同lncRNAs 对NSCLC 细胞功能的影响不同,如过表达过渡前相关RNA 可促进A549 细胞增殖、迁移和侵袭[9],敲低lncRNA X 染色体失活特异性转录物可抑制细胞增殖并促进细胞凋亡[25],而过表达转录超保守区454 则会抑制A549 细胞迁移和侵袭[24]。既往报道与本研究均显示BRE-AS1对肿瘤(膀胱癌、前列腺癌、肺癌)细胞功能的影响主要体现在抑制细胞增殖和促进细胞凋亡方面[12,14-15],提示BRE-AS1在NSCLC中具有抑癌作用。
lncRNA在肿瘤中存在多种调控机制,如转录、翻译、细胞内信号通路、蛋白质修饰以及RNA-蛋白质或蛋白质-蛋白质复合物形成等,其中通过信号通路来调控肿瘤的发生发展是最普遍的方式之一[26]。Peng等[20]报道lncRNAs可通过影响Notch、PI3K-AKT-mTOR、核因子κB等多种信号通路来调控肿瘤发生发展。为探讨BRE-AS1调控NSCLC 细胞功能的潜在分子机制,本研究首先通过富集分析发现PI3K-AKT 可能是BRE-AS1的重要下游通路。目前已知PI3K-AKT通路的激活可以促进多种癌症包括肺癌的发生[27],其中关键分子AKT活化后可进一步磷酸化mTOR 来介导细胞增殖、周期和糖代谢[28],故常常将PI3K-AKT信号通路与mTOR 信号通路放一起研究。mTOR 主要调节细胞生长、能量代谢及细胞骨架重建[29],另一关键蛋白PTEN 活化后主要抑制细胞生长并诱导细胞凋亡[30]。本研究通过Western blotting实验对上述关键蛋白及其磷酸化水平进行检测,结果发现BRE-AS1可能通过抑制PI3K-AKTmTOR信号传导通路来发挥抑癌作用。
目前关于BRE-AS1在NSCLC 中作用的报道较少。本研究利用RT-qPCR 技术以及TCGA 数据库分析,从多方面检测BRE-AS1的表达并相互验证,结果准确可信。本研究仍然存在一定的局限性,仅采用过表达BRE-AS1进行细胞实验,缺乏体内实验的验证。因此,未来将结合体内实验进一步阐明BRE-AS1在NSCLC 发生发展中的作用。
综上所述,本研究首先检测分析了BRE-AS1在NSCLC 组织样本、TCGA 数据库和不同肺癌细胞中的表达,并评估了BRE-AS1的诊断能力,发现BRE-AS1在NSCLC 中低表达且具有较高的诊断能力;其次通过慢病毒转染在A549 中过表达BRE-AS1,检测BRE-AS1对细胞增殖、周期和凋亡的影响;最后通过功能富集和Western blotting 检测分析BRE-AS1对下游PI3K-AKT-mTOR信号通路关键蛋白的影响,发现BRE-AS1可能通过抑制PI3K-AKT-mTOR 信号通路来抑制NSCLC细胞生长、诱导细胞凋亡并阻滞细胞周期,研究为进一步了解NSCLC 发病机制及筛选新的候选生物标志提供依据。
