长链非编码RNA-GK3P在食管癌中的表达及其对癌细胞生物学功能的影响
2021-08-07周静静顾云张龙张颖赵超陆强张虎浦跃朴尹立红
周静静,顾云,张龙,张颖,赵超,陆强,张虎,浦跃朴,尹立红
1.东南大学公共卫生学院环境医学工程教育部重点实验室,江苏 南京 210009
2.涟水县人民医院胸外科,江苏 涟水 223400
食管癌是一种常见的消化道肿瘤,位居全球癌症死因顺位第六位[1]。近年来,食管癌的发病率仍在迅速攀升,发病机制尚不清楚,尽管多学科治疗取得了一定的进展,但全球范围内,食管癌患者5年生存率仍<20%[2],因此迫切需要探索食管癌新的诊断和治疗靶点。非编码RNA是指不编码蛋白质的RNA,根据长度分为长链非编码RNA(long non-coding RNA,lncRNA)和短链非编码RNA(如microRNA)[3]。其中,lncRNA长度>200个核苷酸,可直接与DNA、RNA和蛋白质相互作用[4-5],影响细胞增殖、凋亡、周期进展、迁移和侵袭,参与包括恶性肿瘤在内的多种疾病的发生发展[6-7]。随着高通量测序技术和生物信息学的发展,越来越多的研究表明lncRNA在食管癌中异常表达,作为促癌因子或抑癌因子参与食管癌的发生发展,被认为是食管癌诊断、治疗及预后相关的潜在生物标志[8-9]。因此,识别与食管癌发生发展有关的lncRNA 并阐明其调控机制对食管癌的防控具有重要意义。
在人类基因组中有大量假基因的存在,它们被认为是没有功能作用的。然而,最近的研究表明,假基因来源的lncRNA 通过DNA、RNA 或蛋白质水平上的调节在包括癌症在内的多种人类疾病中发挥重要作用[10]。甘油激酶3假基因(glycerol kinase 3 pseudogene,GK3P)是位于人类染色体4q32.3 区域的lncRNA,其亲本基因是甘油激酶基因。研究表明,假基因在基因序列与功能上与亲本基因具有相似性[11]。Zhou 等[12]发现,敲低甘油激酶5 基因可通过固醇调节元件结合蛋白1/硬脂酰辅酶A去饱和酶1 信号通路诱导肺腺癌细胞周期停滞和凋亡;Yu 等[13]报道,甘油激酶基因在高级胶质母细胞瘤组织中低表达,并且可以促进胶质母细胞瘤细胞的增殖。这些均提示甘油激酶基因与癌症进展关系密切。课题组前期基于RNA-Seq、TCGA数据库及生物信息学分析发现lncRNA-GK3P与食管癌患者的总生存率有相关性,但lncRNA-GK3P在食管癌进程中的功能特征尚不明确[14]。因此,本研究在分析食管癌组织及癌旁组织、食管癌细胞以及永生化正常食管上皮细胞中lncRNA-GK3P表达水平的基础上,进一步采用质粒转染技术和siRNA 敲低技术分别构建lncRNA-GK3P过表达和敲低的食管癌EC109 细胞株,以探讨lncRNA-GK3P对食管癌细胞生物学功能的影响。
1 材料与方法
1.1 实验材料
1.1.1 人体组织样本在江苏省淮安市涟水县人民医院募集41 例食管癌确诊患者,收集其癌组织及配对癌旁组织样本;本研究经东南大学附属中大医院伦理委员会批准(审批号:2018ZDKYSB023),并获得受试者的知情同意。
1.1.2 细胞人食管鳞癌细胞株(EC109)和永生化食管上皮细胞株(Het-1A)均来自东南大学公共卫生学院环境医学工程教育部重点实验室。
1.1.3 主要仪器与试剂超净工作台(上海净化仪器厂,中国),二氧化碳培养箱(Heraeus,德国),生物图像导航仪(Olympus,日本),细胞组织研磨仪(上海净信,中国),高速离心机(Eppendorf,德国),Tanon凝胶成像及分析系统(上海天能,中国),酶标仪(BioTek,美国)等。
RPMI1640 细胞培养基(Gibco,美国),DMEM 细胞培养基(Gibco,美国),OptiMEM 培养基(Gibco,美国),胎牛血清(Gibco,美国),LipofectamineTM2000转染试剂(Thermo,美国),CCK-8 检测试剂盒(上海碧云天,中国),EdU多重荧光染色试剂盒(广州锐博,中国),qRT-PCR 试剂盒(Takara,日本),lncRNA-GK3P过表达质粒及空载对照、lncRNA-GK3P敲低siRNA 及空载对照、细胞周期检测试剂盒、细胞凋亡试剂盒(南京凯基,中国),一抗Bax、Bcl2、Cyclin B1、Cyclin E1、β-actin(CST,美国),羊抗鼠二抗、羊抗兔二抗(武汉爱博泰克,中国)等。
1.2 实验分组设计
将EC109分为4组:si-GK3P组(siRNAGK3P转染),si-NC组(siRNAGK3P的空载体对照),plasmid-GK3P 组(GK3P过表达质粒转染),plasmid-NC 组(GK3P空载质粒对照)。
1.3 方法
1.3.1 细胞培养及转染EC109 采用含10%胎牛血清和1%青霉素/链霉素的RPMI1640 培养基,Het-1A 采用含10%胎牛血清和1%青霉素/链霉素的DMEM 培养基,置于37℃、5%CO2培养箱中培养。EC109细胞以3×105个·孔-1接种于6孔板中,继续常规培养24 h,用siRNA 转染构建lncRNA-GK3P敲低EC109 细胞株,用质粒转染构建lncRNA-GK3P过表达EC109 细胞株,分别设置空载对照组,转染6 h 后换液,继续培养至48 h,qRT-PCR 验证转染效率。
1.3.2 RNA 提取细胞RNA 提取:收集细胞后,加入1 mL Trizol,吹打混匀,60 Hz研磨30 s,室温静置5 min;再加入200 μL 三氯甲烷,颠倒混匀,于4℃、12 000×g离心10 min;取上层水相与异丙醇体积比为1∶1 至新EP 管中,颠倒混匀,4℃、12 000×g离心10 min,弃上清;加入体积分数为75%乙醇洗涤,4℃、8 000×g离心5 min,弃上清;重复洗涤一次;置室温干燥10 min后用无酶水溶解使RNA含量在500 ng·μL-1左右。组织RNA 提取:组织剪碎体积约为0.5 cm3左右,加1 mL Trizol,60 Hz 研磨5 min;后续操作同细胞RNA提取。
1.3.3 RNA逆转录及qRT-PCR 分析以β-actin为内参,lncRNA-GK3P基因及内参基因引物序列设计见表1。PCR 小管中依次加入5×逆转录酶混合物4 μL,总RNA 1 μL,补无酶水至总体积10 μL。反应条件:37℃、15 min,85℃、5 s,4℃保存。
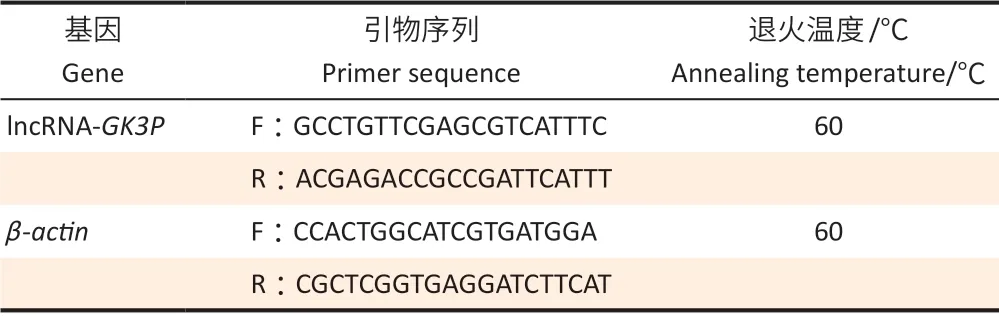
表1 qRT-PCR分析的引物序列Table 1 The primer sequence for qRT-PCR analysis
qRT-PCR反应体系:SYBR Premix Ex Taq II 5 μL,前、后引物各0.4 μL,Rox Reference Dye 0.2 μL,cDNA 1 μL,补无酶水至总体积10 μL。反应条件:预变性阶段(95℃、30 s),PCR 反应阶段(95℃、5 s,60℃、30 s),40 个循环,每个样本重复3 次。采用2-ΔΔCt法计算癌组织相对于癌旁组织中lncRNA-GK3P的相对表达量。
1.3.4 细胞活性测定96 孔板每孔接种8×103个细胞,每组6 个平行,实验组(si-GK3P 组或plasmid-GK3P组),空载对照组(si-NC 组或plasmid-NC 组),同时设置空白对照组,转染48 h 后,每孔加入100 μL 细胞培养液和10 μL CCK-8 溶液,孵育约2 h,酶标仪测定450 nm 波长处的光密度值(D)。细胞活性计算:细胞活性=(D实验组-D空白组)/(D对照组-D空白组)×100%。
1.3.5 细胞增殖检测细胞以密度8×103个·孔-1接种于96 孔板,每组各设3 个平行孔,转染48 h 后,按照EdU 多重荧光染色试剂盒说明书进行EdU 标记、细胞固定、染色,然后用生物图像导航仪拍照分析。红色标记增殖期细胞,蓝色标记活细胞。细胞增殖率计算:细胞增殖率=增殖期细胞数/细胞总数×100%。
1.3.6 细胞周期检测收集转染后的细胞,PBS 洗涤1次,400×g离心5 min,调整细胞密度为1×106个·mL-1,取1 mL 单细胞悬液,离心后弃上清,加入预冷体积分数为70%乙醇500 μL 固定过夜。染色前,用PBS 洗去固定液,加入染色工作液(PI∶RnaseA=9∶1),室温避光30~60 min,流式细胞仪检测。
1.3.7 细胞凋亡检测细胞转染后,采用无EDTA的胰酶消化细胞,PBS 洗涤2 次,400×g离心5 min,收集5×105个细胞。加入500 μL 细胞结合缓冲液(binding buffer)悬浮细胞,加入5 μL Annexin V-APC 和5 μL PI(或5 μL Annexin V-FITC 和5 μL PI)进行标记,避光室温5~15 min,流式细胞仪分析细胞凋亡。凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.3.8 蛋白表达测定采用Western blotting 法检测细胞周期蛋白E1(cyclin E1 protein,Cyclin E1)、细胞周期蛋白B1(cyclin B1 protein,Cyclin B1)、B 淋巴细胞瘤-2 蛋白(B cell lymphoma 2 protein,Bcl2 蛋白)和Bcl2 家族蛋白(Bcl2 associated X protein,Bax蛋白)的表达。用细胞刮板刮取各组细胞,PBS 洗涤两次,于4℃,400×g离心5 min,每1×107个细胞加入含1 mmol·L-1蛋白酶抑制剂(PMSF)的RIPA 裂解液300 μL,60 Hz 研磨2 min,冰上放置30 min。离心后取上清液,BCA 法测定总蛋白浓度,用5×SDS 上样缓冲液和无酶水将蛋白浓度稀释至2 μg·mL-1,于100℃,煮沸5 min使蛋白变性。Western blotting条件为:浓缩胶电压为70 V,30 min;分离胶电压为90 V,60 min;在200 mA 条件下转膜2 h;转移至PVDF 膜后,TBST 洗涤两次,质量分数为5%脱脂奶粉室温封闭2 h,TBST 稀释一抗至适当浓度,4℃孵育过夜;TBST 洗6 次后加入稀释好的二抗,室温孵育2 h;TBST 洗涤6 次,最后进行化学发光检测。Image J v1.8.0 软件对蛋白条带进行灰度值分析。
1.4 统计学分析
数据分析使用SPSS 22.0,计量资料采用Shapiro-Wilk(S-W)方法进行正态性检验,符合正态分布的资料以均数±标准差表示;经方差齐性检验数据具有方差齐性。两组间均数比较采用t检验;采用χ2检验分析lncRNA-GK3P相对表达水平与临床特征的相关性;检验水准α=0.05。采用GraphPad Prism 8.0、Adobe Photoshop CS6 软件进行绘图。
2 结果
2.1 lncRNA-GK3P 在食管癌组织与食管癌细胞中的表达水平
qRT-PCR 结果显示,lncRNA-GK3P在食管癌组织中表达水平为癌旁组织的(2.91±0.61)倍,差异具有统计学意义(图1A,t=19.38,P<0.05)。且相对于食管上皮细胞Het-1A,lncRNA-GK3P在食管癌EC109 细胞中的表达水平明显升高,表达水平为前者的(3.15±0.27)倍(图1B,t=13.06,P<0.05)。根据lncRNA-GK3P在食管癌患者组织中相对表达水平的均数(2.91),将表达水平高于2.91 的患者归为高表达组,共23 例;将表达水平低于2.91的患者归为低表达组,共18例。对lncRNA-GK3P相对表达水平与临床特征之间的关系进行分析,结果显示lncRNA-GK3P表达水平与性别、年龄、有无淋巴结转移、吸烟以及饮酒均无相关性(表2)。
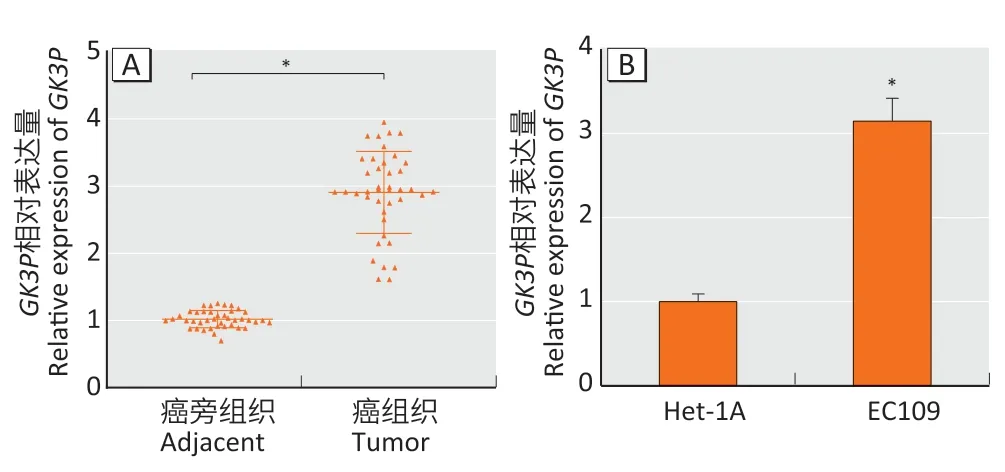
图1 lncRNA-GK3P 在组织(A)和细胞(B)中的相对表达水平Figure 1 Relative expression levels of lncRNA-GK3P in selectedtissues (A) and cells (B)
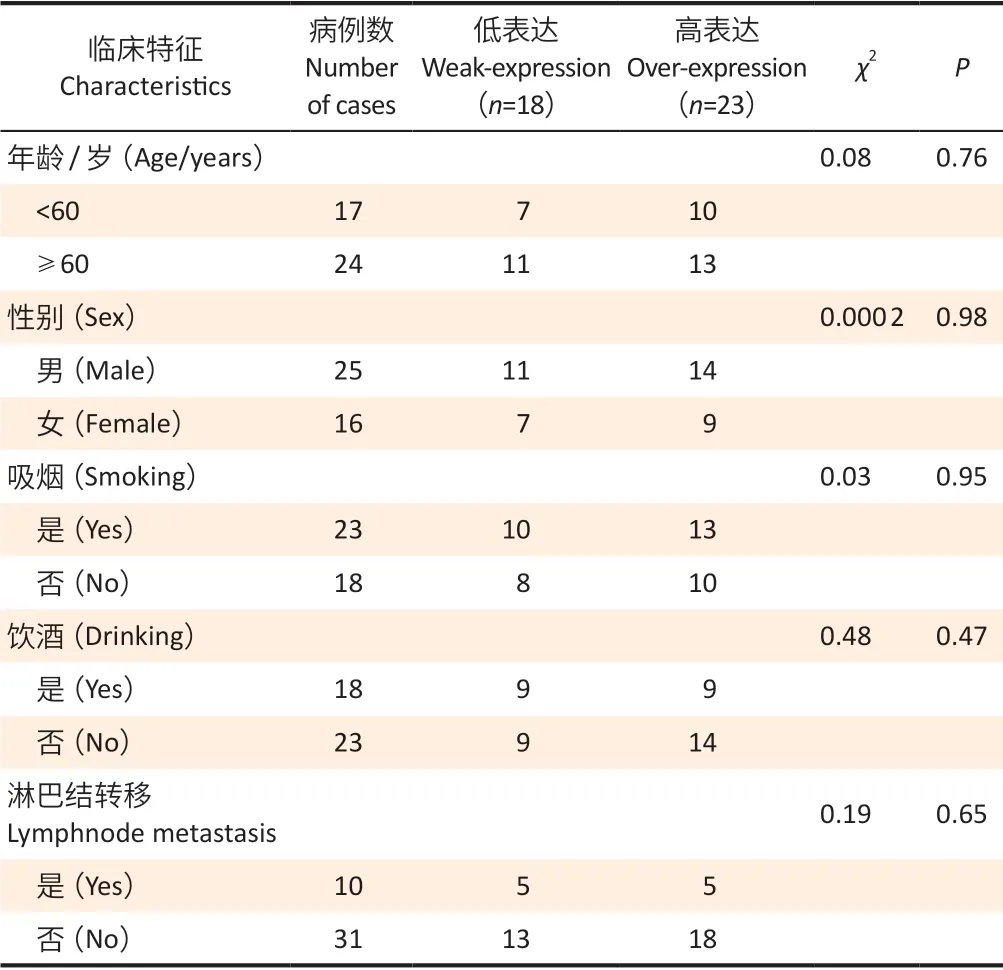
表2 lncRNA-GK3P 表达水平与临床特征的关系分析Table 2 Relationship between the expression level of lncRNA-GK3P and clinical characteristics
2.2 转染效率
qRT-PCR检测lncRNA-GK3P敲低和过表达后mRNA的表达水平,结果显示,si-GK3P 组细胞中lncRNAGK3P的mRNA 相对表达量是si-NC 组 的42%(图2A,t=3.46,P<0.05);plasmid-GK3P组细胞中lncRNA-GK3P的mRNA相对表达量是plasmid-NC组的328倍(图2B,t=4.20,P<0.05)。
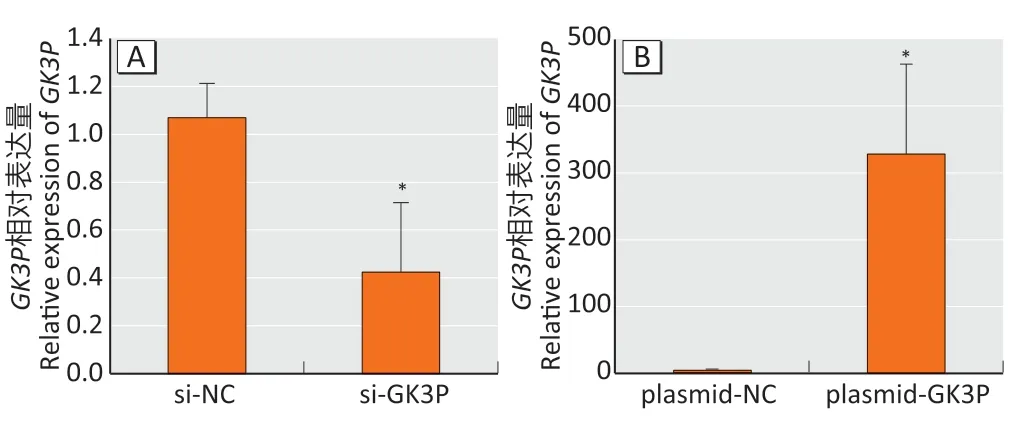
图2 qRT-PCR 检测转染效率Figure 2 Transfection efficiency by qRT-PCR
2.3 lncRNA-GK3P 对食管癌细胞活性和增殖能力的影响
CCK-8实验显示(图3A、3B),与si-NC组相比,si-GK3P组细胞活性降低(t=17.00,P<0.05),与plasmid-NC 相比,plasmid-GK3P组细胞活性增强(t=11.61,P<0.05)。EdU 结果显示(图3C、3D),si-GK3P 组和si-NC 组增殖率分别为(27.21±1.11)%、(37.95±0.93)%,敲低lncRNA-GK3P抑制食管癌细胞增殖(t=15.91,P<0.05);plasmid-GK3P 组和plasmid-NC 组增殖率为(37.00±1.71)%、(29.63±1.45)%,过表达lncRNA-GK3P促进食管癌细胞增殖(t=7.37,P<0.05)。
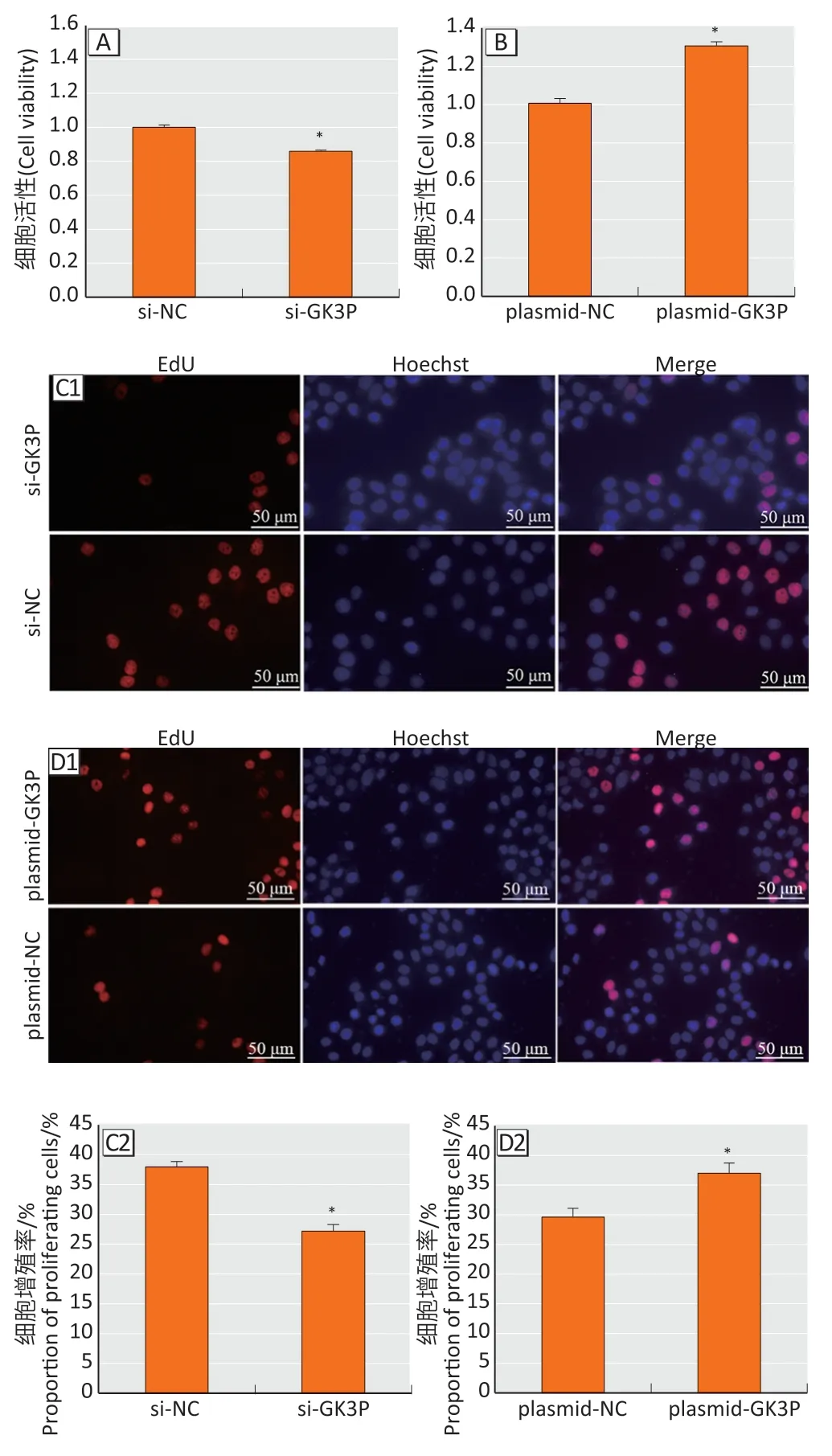
图3 lncRNA-GK3P 对EC109 细胞活性和增殖能力的影响Figure 3 The effect of lncRNA-GK3P on cell viability and proliferation ability of EC109 cells
2.4 lncRNA-GK3P 对食管癌细胞周期的影响
流式细胞术检测结果显示(图4),si-GK3P 组与si-NC 组G0/G1 期比例分别为(60.29±0.71)%、(57.91±0.77)%(t=3.91,P<0.05);S 期比例分别为(26.27±0.75)%、(24.51±0.45)%(t=3.49,P<0.05);G2/M 期比例分别为(13.45±0.03)%、(17.57±0.41)%(t=15.53,P<0.05)。plasmid-GK3P 组与plasmid-NC 组G0/G1 期比例分别为(53.65±0.23)%、(65.65±0.05)%(t=87.71,P<0.05);S 期比例分别为(39.39±0.65)%、(25.47±0.23)%(t=34.72,P<0.05);G2/M期比例分别为(7.23±0.70)%、(8.91±0.18)%(t=4.03,P<0.05)。
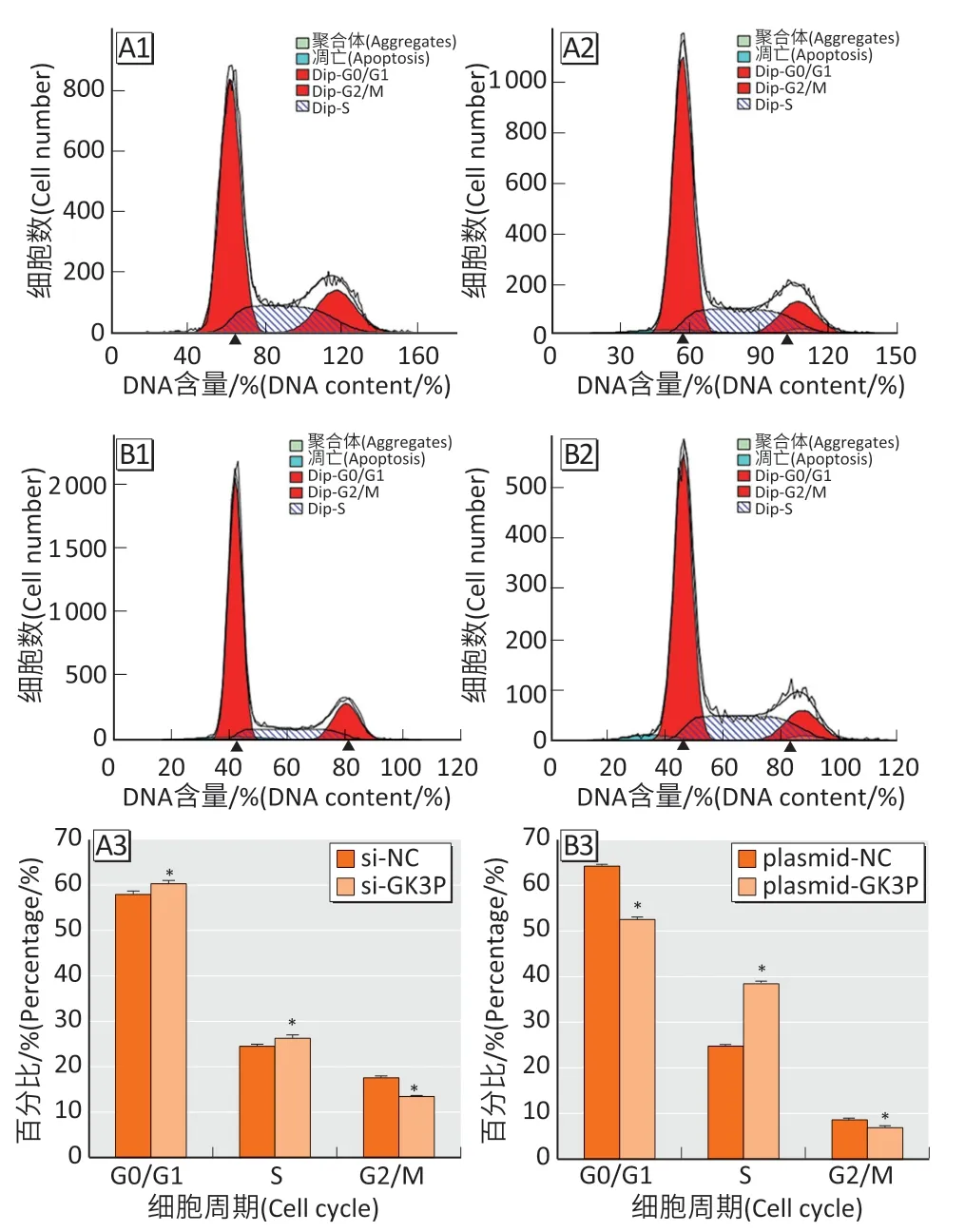
图4 流式细胞术检测lncRNA-GK3P 对EC109 细胞周期分布的影响Figure 4 Effect of lncRNA-GK3P on cell cycle distribution of EC109 cells by flow cytometry
2.5 lncRNA-GK3P 对食管癌细胞凋亡影响
流式细胞术检测结果显示(图5),si-GK3P 组与si-NC 组凋亡率分别为(10.19±0.91)%、(7.46±0.18)%(t=5.12,P<0.05),提示lncRNA-GK3P敲低促进食管癌细胞凋亡。plasmid-GK3P 组与plasmid-NC 组凋亡率分别为(5.27±0.07)%、(9.71±0.19)%(t=27.71,P<0.05),提示lncRNA-GK3P过表达抑制食管癌细胞凋亡。
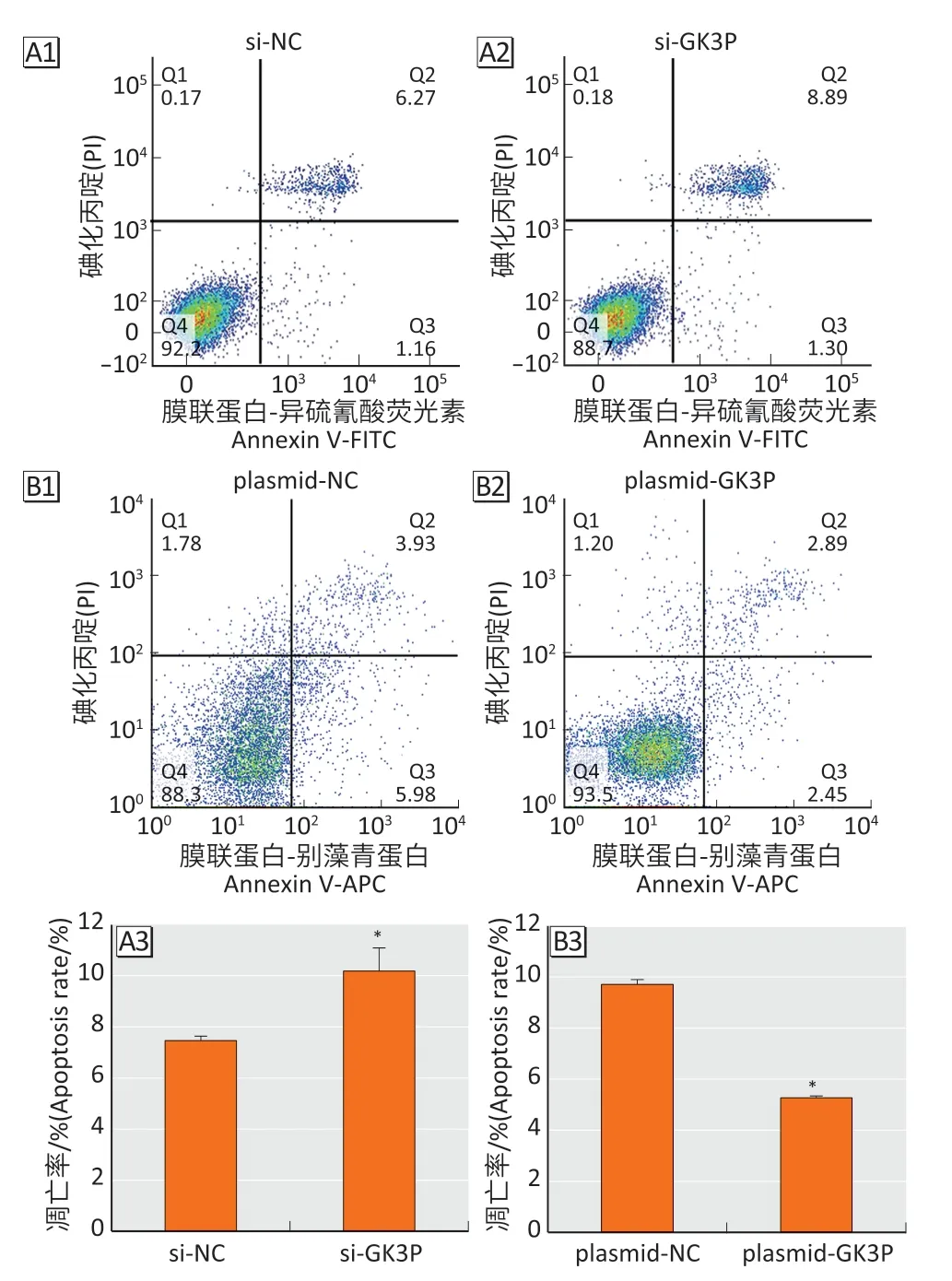
图5 lncRNA-GK3P 敲低及过表达后细胞凋亡统计分析Figure 5 Apoptosis after lncRNA-GK3P knockdown and overexpression
2.6 lncRNA-GK3P 敲低及过表达后Cyclin E1/Cyclin B1/Bcl2/Bax蛋白的表达情况
Western blotting结果显示(见图6),与si-NC组相比,si-GK3P 组细胞中Bax 表达上调(t=8.07,P<0.05),Bcl2 表达下调(t=10.09,P<0.05),Cyclin E1 表达下调(t=21.92,P<0.05),Cyclin B1 表达下调(t=6.16,P<0.05)。与plasmid-NC 组相比,plasmid-GK3P 组细胞中Bax表达下调(t=7.99,P<0.05),Bcl2表达上调(t=4.74,P<0.05),Cyclin E1 表达上调(t=8.03,P<0.05),Cyclin B1表达上调(t=6.03,P<0.05)。
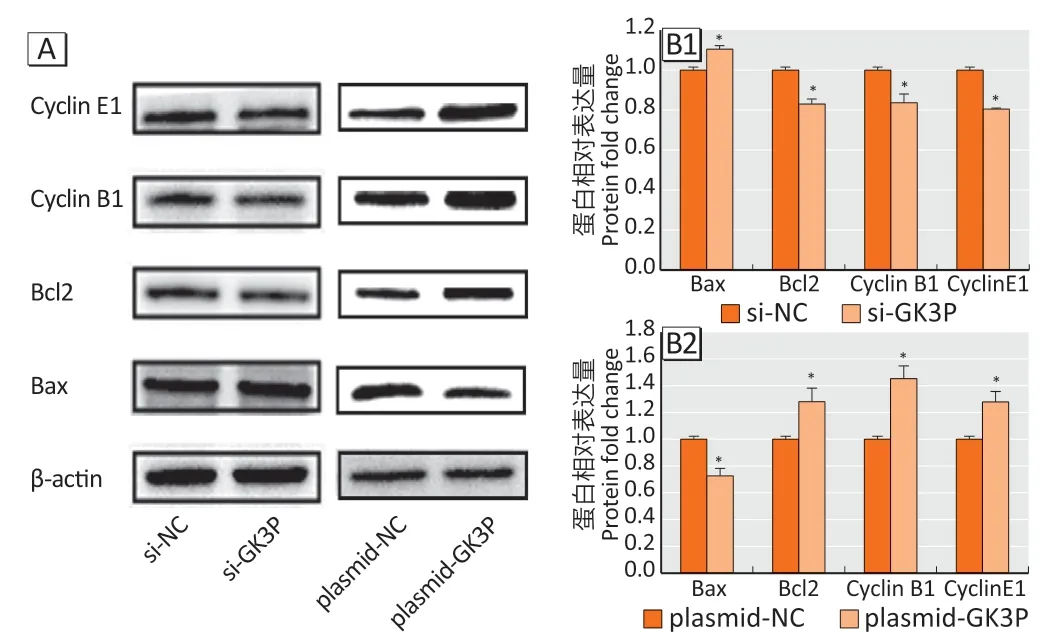
图6 lncRNA-GK3P 敲低及过表达后Cyclin E1/Cyclin B1/Bcl2/Bax的相对表达量Figure 6 Relative expressions of Cyclin E1,Cyclin B1,Bcl2,and Bax after lncRNA-GK3P knockdown and overexpression
3 讨论
本研究通过对41 例食管癌患者的癌组织及癌旁组织中lncRNA-GK3P的表达水平进行检测发现,与癌旁组织相比,癌组织中lncRNA-GK3P表达水平显著上调;这一结果同课题组前期生物信息分析结果一致[14],表明高表达的lncRNA-GK3P可能通过某种调控机制影响食管癌进程,值得深入分析和研究。根据lncRNA-GK3P的检测结果将41 例食管癌患者分为高表达组与低表达组,并分析其与食管癌患者临床特征之间的关系,结果显示lncRNA-GK3P表达的上调与性别、年龄、是否吸烟、饮酒及有无淋巴结转移等因素无关。功能实验结果显示,lncRNA-GK3P敲低抑制细胞活性,抑制细胞周期从G0/G1 期进入S 期和G2/M期,诱导细胞周期阻滞在G0/G1 期,下调食管癌细胞Cyclin B1、Cyclin E1 蛋白表达,分裂活动受阻,细胞增殖能力降低,Bax 表达上调、Bcl2 表达下调,细胞凋亡率增加;lncRNA-GK3P过表达后,细胞活性增强,细胞周期G0/G1 期比例减少、S 期比例增多,上调食管癌细胞Cyclin B1、Cyclin E1 蛋白表达,分裂活动增强,细胞增殖能力增强,Bax 表达下调、Bcl2 表达上调,细胞凋亡率降低。
一些与肿瘤进展关系密切的lncRNA,其表达水平往往会与肿瘤大小、淋巴结转移、TNM分期和浸润深度等临床特征相关[15]。而本研究结果显示lncRNA-GK3P表达的上调与性别、年龄、是否吸烟、饮酒及有无淋巴结转移等因素无关。说明lncRNA-GK3P的表达可能不受这些因素的影响。另外,有限的样本量也有可能致使分析结果产生一定的偏差。
增殖、凋亡等生物学功能可以反映肿瘤细胞恶性程度,本研究针对lncRNA-GK3P对食管癌细胞生物学功能的影响进行了初步探索。结果显示,lncRNA-GK3P促进食管癌细胞增殖,抑制凋亡。细胞周期紊乱是肿瘤细胞异常增殖的重要前提,细胞周期蛋白(Cyclin)是一类通过周期蛋白依赖性激酶调控细胞周期,控制细胞增殖的蛋白家族[16],其中,Cyclin E1 是参与调控细胞G1/S 期限制性检测点的主要蛋白[17]。Cyclin B1是调控细胞周期由G2 期进入M 期的关键因子,只有Cyclin B1 蛋白表达量足够时才能结合并激活周期蛋白依赖性激酶1 进而发挥调控作用[18]。肿瘤的发展过程中常常出现细胞周期蛋白的异常表达,lncRNA 亦可通过影响细胞周期蛋白表达在肿瘤进程中发挥作用,如lncRNA-00312可下调Cyclin B1 的表达,诱导肝癌细胞中G2/M 细胞周期停滞,抑制肝癌细胞增殖[19];敲低lncRNA-00857可下调CyclinE1 的表达,导致细胞周期阻滞,进而抑制胃癌细胞增殖[20]。本研究发现,lncRNA-GK3P敲低抑制细胞周期从G0/G1 期进入S 期和G2/M 期,诱导细胞周期阻滞在G0/G1 期,下调食管癌细胞Cyclin B1、Cyclin E1 蛋白表达,分裂活动受阻,细胞增殖能力降低。lncRNA-GK3P过表达后,细胞周期G0/G1 期比例减少,S 期比例增多,上调食管癌细胞Cyclin B1、Cyclin E1 蛋白表达,分裂活动增强,细胞增殖能力增强。这一结果说明lncRNA-GK3P可能通过影响Cyclin B1、E1 蛋白表达调控细胞周期,进而促进食管癌细胞增殖。除了细胞增殖失衡外,细胞凋亡异常也是肿瘤发生发展的重要机制。Bcl2基因家族在细胞凋亡过程中发挥着重要的调控作用,其中Bcl2 蛋白能抑制细胞色素C 释放,降低细胞内钙浓度,抑制细胞凋亡[21];Bax 也是Bcl2 家族成员,通过破坏线粒体渗透性、激活Caspase-3 促进细胞凋亡。此外,Bcl2与Bax 蛋白能够形成聚合体,在细胞凋亡过程中发挥调控作用[22]。有研究表明lncRNA-SNHG5影响Bax、Bcl2表达促进黑色素瘤细胞凋亡[23],lncRNA-CCHE1通过上调Bcl2、下调Bax 表达抑制胃癌细胞凋亡[24]。本研究发现lncRNA-GK3P能上调Bcl2、下调Bax 表达,说明lncRNA-GK3P调控Bax、Bcl2的表达可能是其抑制食管癌细胞凋亡的重要机制之一。
综上所述,本研究初步证实lncRNA-GK3P在食管癌中高表达。通过敲低和过表达lncRNA-GK3P证实,lncRNA-GK3P通过调控细胞周期相关蛋白的表达促进EC109 细胞增殖,通过调控Bax、Bcl2 蛋白抑制EC109细胞凋亡,为lncRNA-GK3P在食管癌中作用机制的研究奠定了基础。当然,本研究也存在一定的局限性。首先,本研究中纳入的食管癌病例数有限,得到的结论仍需在更大的样本量中进行验证;其次,本研究只采用了EC109一株食管癌细胞进行实验,关于lncRNAGK3P对食管癌细胞功能影响的机制研究还不够深入,需要进一步探索。
