两地牛蒡根总黄酮的体外和体内抗氧化活性研究
2021-08-07刘群群李飞艳邱艳明毛群芳
刘群群,王 燕,李飞艳,邱艳明,毛群芳
(1.湖南中医药高等专科学校药学系,湖南株洲 412000;2.湖南农业大学食品科技学院,湖南长沙 410128)
牛蒡(Arctium lappa L.),又名恶实、大力子、东洋参等。主要分布在中国、欧洲等地区,我国牛蒡的种植产地主要分布于山东省和江苏省,山东省的苍山,江苏省的徐州丰县、沛县,种植历史悠久,面积规模较大[1]。牛蒡根营养丰富且含有许多活性成分,如小分子的挥发油、醛类、多酚类、黄酮类化合物[2]等。牛蒡根具有保护心脑血管[3-5]、保护肝肾胃肠损伤、治疗糖尿病[6]、降脂、抗衰老、抗氧化[7]、抗疲劳、治疗便秘[8]、抗菌及抗病毒、免疫调节、抗肿瘤、抗突变等功效[9]。
牛蒡根的抗氧化研究目前集中在4 个方面,一是不同溶剂下总提取物的抗氧化性活性研究;二是牛蒡根中多糖的提取纯化及其抗氧化活性研究,Jiang Yuanyuan 等人[10]研究发现,牛蒡根多糖(ALP60-1) 对DPPH 自由基、羟自由基和超氧阴离子自由基具有很强的清除活性,是一种潜在的新型天然抗氧化剂;三是牛蒡根中多酚类化合物的提取纯化及其抗氧化活性研究,蔡茜彤[11]对牛蒡根多酚和黄酮的提取方法进行了研究,并对牛蒡根粗提液进行了体外抗氧化研究,发现其多酚粗提液有很好的体外抗氧化作用;四是牛蒡根中黄酮类物质的抗氧化活性研究,曹旭等人[12]从体外和细胞层面研究了牛蒡根总黄酮的抗氧化活性。目前,牛蒡根总黄酮的抗氧化活性多基于粗提液,纯化较少,且其抗氧化性研究多是基于体外研究,体内层面的抗氧化未见报道。试验从体内体外2 个方面研究纯化后的牛蒡根总黄酮的抗氧化活性,并比较2 个不同产地的牛蒡根总黄酮的抗氧化活性是否存在差异,为牛蒡在医药及食品工业中的应用提供科学依据与数据支持。
1 材料与方法
1.1 动物、材料与试剂
1.1.1 动物
SPF 级KM 小鼠40 只,雌雄各半,体重(20±2 g),湖南斯莱克景达实验动物有限公司提供(许可证号 SCXK(湘)2016-0002)。
1.1.2 材料
牛蒡根A,徐州绿姿农产品专业合作社提供,柳川理想品种;牛蒡根B,特色中国苍山馆官方店提供,柳川理想品种。
1.1.3 试剂
D101 型大孔吸附树脂,东鹏化工有限公司提供;1,1-二苯基-2-三硝基苯肼、菲洛嗪,合肥巴斯夫生物科技有限公司提供;磷酸盐缓冲液(pH 值7.4)、Tris-盐酸缓冲液pH 值8.2,厦门海标科技有限公司提供;总抗氧化能力(T-AOC) 检测试剂盒、超氧化物歧化酶 (SOD) 测定试剂盒、丙二醛(MDA) 测定试剂盒、过氧化氢酶(CAT) 测定试剂盒、蛋白定量(TP) 测定试剂盒,南京建成生物工程研究所提供;抗坏血酸(维C)、无水乙醇、NaOH、四水合钼酸铵、铁氰化钾、磷酸钠、三氧化二铁、四水合氯化亚铁、七水合硫酸化亚铁、1,10-菲咯啉(邻二氮菲)、邻苯三酚、聚酰胺树脂、D-半乳糖,均为分析纯。
1.2 仪器与设备
QE-5A 型高速中药粉粹机,武义县屹立工具有限公司产品;101A-4 型电热鼓风恒温干燥箱,上海康路仪器设备有限公司产品;KQ-100B 型超声波清洗器,巩义市予华仪器有限责任公司产品;L5S 型紫外可见分光光度计,上海仪电科学仪器股份有限公司产品;HL-2B 型数显恒流泵,驰唐精密仪器有限公司产品;RE-52AA 型旋转蒸发仪,上海亚荣生化仪器厂产品;DZF-6020B 型电热真空干燥箱,河北科尔美仪器设备有限公司产品;CPA225D 型电子分析天平,赛多利斯科学仪器(北京) 有限公司产品;TG 1850-WS 型台式高速离心机,上海卢湘离心机仪器有限公司产品;HH-S2 型二孔智能水浴锅,巩义市予华仪器有限责任公司产品。
1.3 试验方法
1.3.1 牛蒡根总黄酮的制备
(1) 牛蒡根的预处理。将新鲜的牛蒡根清洗干净、切片,并用质量分数0.75%的维C 溶液浸泡30 min,沥水后于40 ℃下鼓风干燥至恒质量,粉粹,过60 目筛后,低温冷冻储存,备用。
(2) 牛蒡根总黄酮的提取。按照料液比1∶23(g∶mL),乙醇体积分数61%,超声温度 60 ℃,超声功率100 W,超声时间59 min,对牛蒡根总黄酮进行提取,取上清液[13],真空干燥,低温储存,备用。
(3) 牛蒡根总黄酮的纯化。用D101 型大孔树脂柱(内径30 mm,径长比1∶7),在上样液质量浓度为10 mg/mL,上样体积为400 mL,上样流速为0.5 BV/h,洗脱液为30%的乙醇,洗脱流速为1.5 BV/h 的条件下进行初次纯化,再用聚酰胺树脂柱(内径15 mm,60~90 目,径长比1∶8) 在上样液质量浓度为1.5 mg/mL,pH 值为2,上样体积为20 mL,上样流速为0.5 BV/h,洗脱液为70%的乙醇,洗脱流速为4 BV/h 的条件下进行二次纯化[14],并将纯化后牛蒡根总黄酮溶液进行减压蒸馏浓缩并真空干燥,低温冷冻储存,备用。
1.3.2 体外抗氧化活性研究
(1) DPPH 自由基的清除能力评价方法。参照蔡茜彤等人[15]的方法,略作修改。称取3.94 mg DPPH,用无水乙醇溶解并定容至100 mL 作为DPPH 工作液。将纯化后的牛蒡根总黄酮A 和B 分别用体积分数70%的乙醇配制成系列质量浓度的溶液(0.25,0.50,0.75,1.00 mg/mL)。取9 支洁净的10 mL 比色管,编号 (A1,A2,A3,A4,B1,B2,B3,B4,0) 分别加入200 μL 不同质量浓度的牛蒡根总黄酮溶液,0 号管加入70%乙醇200 μL 代替牛蒡根总黄酮溶液作为空白对照,再加入DPPH 工作液2 mL,振荡摇匀后于室温下避光静置30 min,于波长517 nm 处测定吸光度。维 C 溶液 (25,50,75,100 g/mL) 以同样的方法测定。以样品质量浓度为自变量,DPPH 自由基清除率为因变量作图并进行线性拟合,计算IC50值(清除率为50%时所需样品溶液的质量浓度),所需质量浓度越低,样品的自由基清除能力越强。
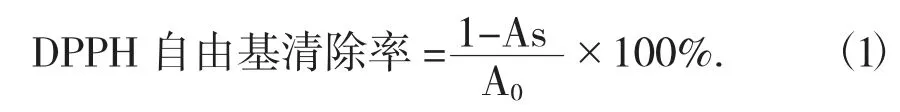
式中:As——样品管的吸光度;
A0——对照管的吸光度。
(2) 羟自由基清除能力评价方法。按照娄在祥等人[16]的方法,按下表加入相应试剂后,避光静置60 min,于波长536 nm 处测定吸光度,并以样品质量浓度为自变量,羟自由基清除率为因变量作图并进行线性拟合,计算IC50值。
羟自由基试验加样见表1。

表1 羟自由基试验加样 / mL

式中:A样——样品管的吸光度;
A样参——样品参比管的吸光度;
A损伤——损伤管的吸光度;
A空参——空白参比管的吸光度;
A未损——未损伤管的吸光度。
(3) 超氧阴离子自由基清除能力评价方法。取0.05 mol/L Tris-HCl 缓冲液 (pH 值 8.2) 4.5 mL 于试管中,于25 ℃下水浴20 min,再分别加入不同浓度的试样溶液1 mL 和25 mmol/L 邻苯三酚溶液0.4 mL,于25 ℃下反应5 min,加入8 mol/L 盐酸1 mL 终止反应,于波长325 nm 处测定吸光度。以相同体积的蒸馏水代替样品为空白对照。以样品质量浓度为自变量,超氧阴离子自由基清除率为因变量作图并进行线性拟合,计算IC50值[17]。

式中:As——样品管的吸光度;
A0——对照管的吸光度。
(4) 总抗氧化能力的测定方法。钼酸铵反应体系的制备:将0.99 g 四水合钼酸铵、2.13 g 磷酸钠溶于200 mL 水中,再加入6.67 mL 浓硫酸,混匀。将0.3 mL 不同质量浓度的试样溶液和3 mL 的钼酸铵反应体系混匀后于95 ℃水浴加热90 min,冷却后,于波长695 nm 处测定吸光度。吸光度越大,说明其还原能力越强,总抗氧化能力越强。空白试验以相同体积的蒸馏水代替样品。以样品质量浓度为自变量,总抗氧化能力为因变量作图并进行线性拟合[18]。
(5) 金属离子螯合能力的测定方法。在不同浓度 (0,0.5,1.0,1.5,2.0,2.5 mg/mL) 的试样溶液2.4 mL 中加入现配的 2 mmo1/L 的 FeCl2溶液 30 μL和5 mmol/L 的菲咯嗪溶液60 μL,混匀后,室温静置10 min,于波长562 nm 处测定吸光度,空白试验以相同体积的70%乙醇溶液代替样品。以样品浓度为自变量,金属离子螯合能力为因变量作图并进行线性拟合,计算IC50值[19]。
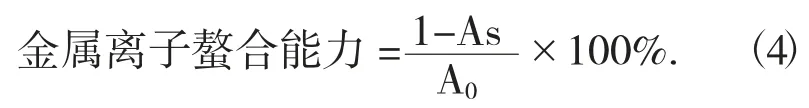
式中:As——样品管的吸光度;
A0——对照管的吸光度。
(6) 铁离子还原能力的测定方法。在 10 mL 比色管中分别加入1 mL 不同质量浓度的试样溶液和1%(质量分数) 铁氰化钾溶液1 mL,混匀后于50 ℃水浴反应20 min,急速冷却后,加入蒸馏水1 mL 及0.2 mL 0.1%(质量浓度) 的氧化铁溶液(3.5%的盐酸溶液)。混匀后,室温下静置10 min,于波长700 nm处测定吸光度,吸光度越高表示还原能力越强[18]。
1.3.3 体内抗氧化活性研究
(1) 动物分组和给药方式。40 只KM 小鼠(雌雄各半),适应性饲养5 d 后,按体质量随机分为4 组(每组10 只,雌雄各半):空白组、模型组、试验A 组、试验B 组。构建衰老小鼠模型[20]:除空白组外,其余每组小鼠颈背部皮下注射D -半乳糖,每天200 mg/kg(以体重计,下同),注射量为0.02 mL/g。空白组注射等体积的生理盐水,连续注射28 d。造模同时,试验A 组和试验B 组按每天400 mg/kg 的剂量分别灌胃牛蒡根总黄酮A 和牛蒡根总黄酮B,灌胃体积为20 mL/kg、空白组和模型组灌胃等体积生理盐水,连续灌胃28 d。每7 d 称体重1 次,观察记录各组小鼠的生长活动状况和体重变化情况,并按体重变化调整注射及灌胃剂量。试验期间,所有小鼠自由摄食和饮水,温度为20±3 ℃,相对湿度为50%±10%[21]。
(2) 动物血清和肝组织样品的制备。第28 天,最后一次灌胃后,所有小鼠禁食不禁水过夜(12 h),称重后摘眼球取血,以转速3 000 r/min 离心10 min,分离血清。取血后,颈椎脱臼处死小鼠,迅速解剖,取出小鼠肝脏,棉签吸去浮血并称重,随后用预冷的生理盐水清洗并用滤纸吸干,用预冷生理盐水制备10%组织匀浆(组织质量∶生理盐水体积=1∶9),以转速 4 000 r/min 离心 10 min 后取上清液[22]。将血清和组织匀浆上清液放于-20 ℃冰箱中保存,备用。
(3) 体内抗氧化指标测定。小鼠血清、肝脏的总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活性、丙二醛(MDA) 含量、过氧化氢酶(CAT)活性的测定按照试剂盒说明操作。
1.3.4 数据统计处理
数据处理及统计学分析采用Excel 2007 和SPSS V 17.0 软件,试验数据以表示,组间用单因素方差分析进行差异显著性检验,其中p<0.05 具有显著性差异,p<0.01 具有极显著性差异。
2 结果与分析
2.1 牛蒡根总黄酮提取与纯化结果
试验中,牛蒡根A 和牛蒡根B 的总黄酮粗提物得率分别为27.96±0.30 mg/g,25.74±0.23 mg/g。纯化后的牛蒡根总黄酮含量为783.05±6.26 mg/g(A),765.22±5.06 mg/g(B)。
2.2 体外抗氧化结果
2.2.1 DPPH 自由基的清除能力
各试样的DPPH 自由基清除能力见图1。

图1 各试样的DPPH 自由基清除能力
由图1(a) 可知,在所测质量浓度范围内,随着牛蒡根总黄酮的质量浓度增加,其DPPH 自由基清除能力都呈线性关系增加,进行线性拟合,得R2=0.987 6(A),R2=0.994 6(B),结果表明 2 个的线性关系都较好,将Y=50%分别代入方程Y=0.919X-0.002(A),Y=0.775 8X+0.002 3(B),得到牛蒡根总黄酮清除 DPPH 自由基的IC50值分别为0.542±0.049 mg/mL(A),0.642±0.058 mg/mL(B),同样由图 1(b)可知,维 C 的 IC50值为 0.075±0.008 mg/mL。可见两地牛蒡根总黄酮的DPPH 自由基清除能力是维C 的1/8,说明其均具有较强的DPPH 自由基清除能力,且牛蒡根A 总黄酮略强于牛蒡根B 总黄酮。
2.2.2 自由基的清除能力
各试样的羟自由基清除能力见图2。
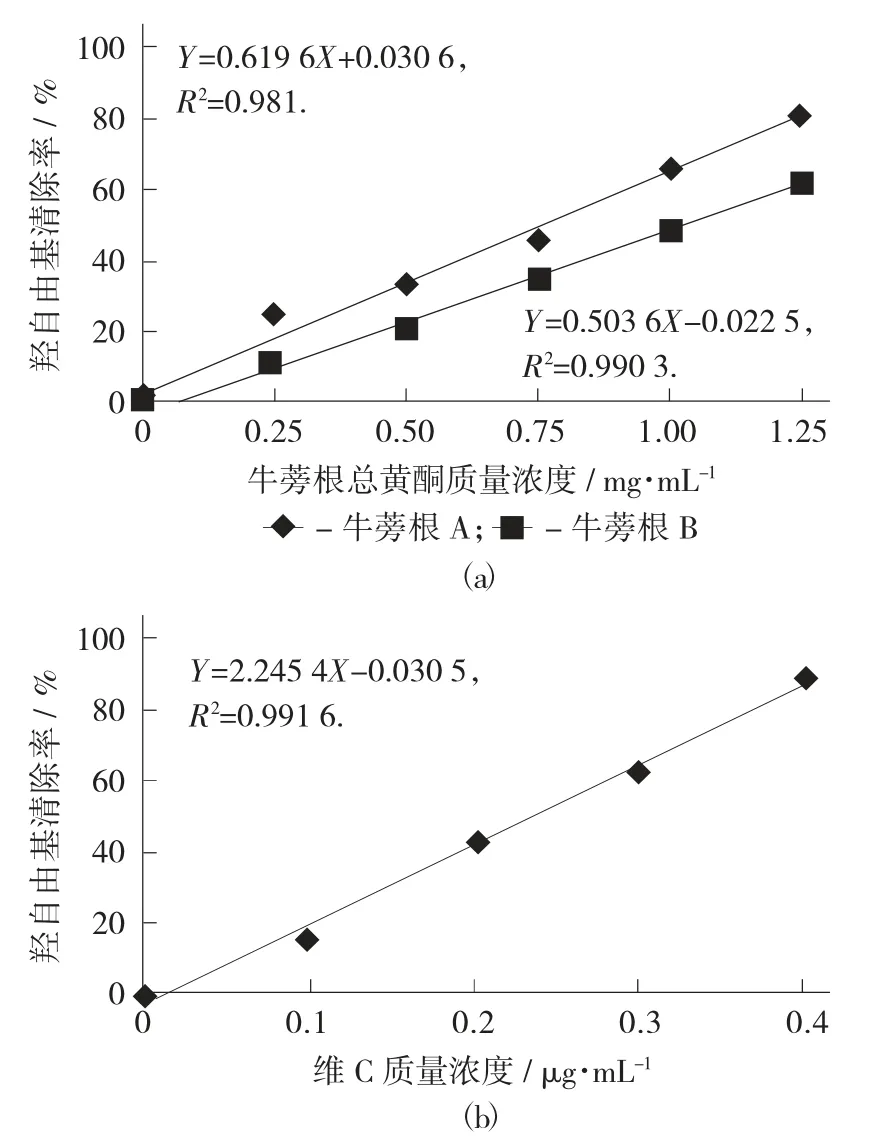
图2 各试样的羟自由基清除能力
由图2(a) 可知,在所测质量浓度范围内,随着牛蒡根总黄酮的质量浓度增加,其羟自由基清除能力都增加,对其进行线性拟合,得R2=0.981 0(A),R2=0.990 3(B),结果表明2 个的线性关系都较好,将Y=50%分别代入方程Y=0.619 6X+0.030 6(A),Y=0.503 6X-0.022 5(B),得到牛蒡根总黄酮清除羟自由基的IC50值分别为0.761±0.068 mg/mL(A),1.04±0.098 mg/mL(B),同样由图 2(b) 可知,维C 的IC50值为0.236±0.027 mg/mL。可见两地牛蒡根总黄酮的羟自由基清除能力是维C 的1/4,说明其均具有较强的羟自由基清除能力,且牛蒡根A总黄酮略强于牛蒡根B 总黄酮。
2.2.3 超氧阴离子自由基的清除能力
各试样的超氧阴离子自由基清除能力见图3。
由图3(a) 可知,在所测质量浓度范围内,随着牛蒡根总黄酮的质量浓度增加,其超氧阴离子自由基清除能力都增加,对其进行线性拟合,得R2=0.983 9(A),R2=0.980 2(B),结果表明 2 个的线性关系都较好,将Y=50%分别代入方程Y=0.597 7X+0.026 3(A),Y=0.479 9X-0.006 5(B),得到牛蒡根总黄酮清除超氧阴离子自由基的IC50值分别为0.793±0.084 mg/mL(A),1.06±0.12 mg/mL(B),同样由图 3(b) 可知,维 C 的 IC50值为 0.319±0.037 mg/mL。可见两地牛蒡根总黄酮的超氧阴离子自由基清除能力是维C 的1/3,说明其均具有很强的超氧阴离子自由基清除能力,且牛蒡根A 总黄酮的超氧阴离子自由基清除能力强于牛蒡根B总黄酮。
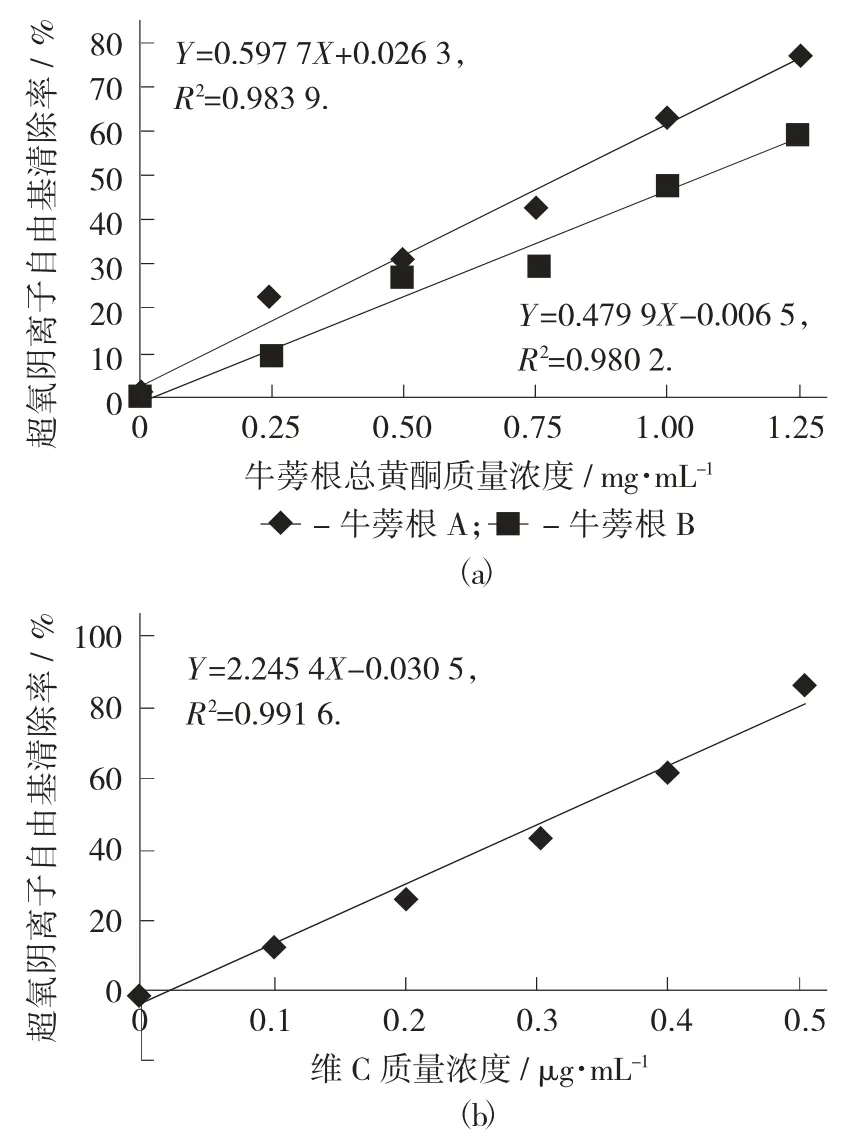
图3 各试样的超氧阴离子自由基清除能力
2.2.4 总抗氧化能力
各试样的总抗氧化能力见图4。
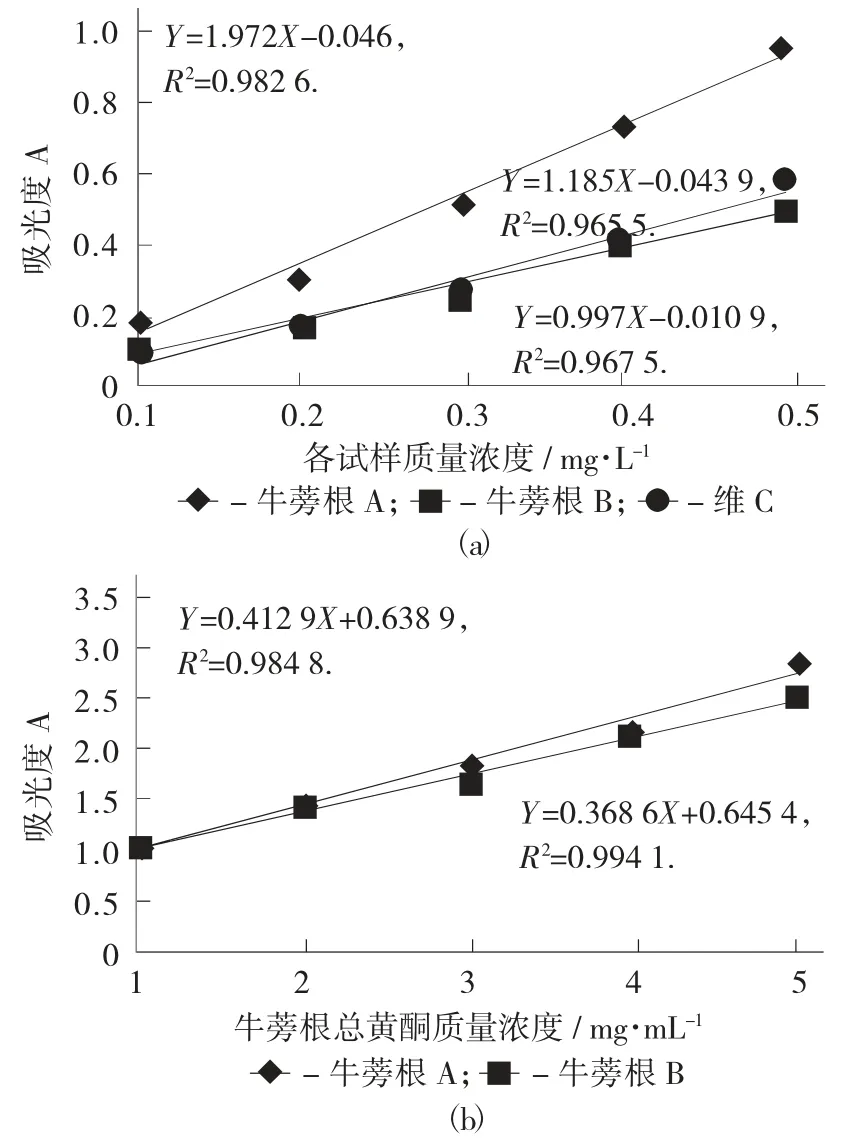
图4 各试样的总抗氧化能力
由图4(a) 可知,在质量浓度小于0.5 mg/mL时,总抗氧化能力随牛蒡根总黄酮的质量浓度呈线性关系增加,对其进行线性拟合,得R2=0.973 8(A),R2=0.980 3(B),结果表明2 个的线性关系都较好,且相同质量浓度下的牛蒡根A 和牛蒡根B 的总黄酮的总抗氧化能力比维C 弱。当质量浓度为原来的10 倍时,由图4(b) 可知,总抗氧化能力与牛蒡根总黄酮的质量浓度仍然呈线性关系增加,对其进行线性拟合,得 R2=0.984 8(A),R2=0.994 1(B),表明线性关系仍然较好。由此可以推断,在所测质量浓度氛围内(5 mg/mL),牛蒡根总黄酮的总抗氧化能力与其质量浓度呈线性正相关,由图4 还可知,B 的斜率比徐州A 的斜率小,也就是说相同质量浓度下的A 的吸光度大于B 的吸光度,由此说明徐州的总抗氧化能力略强于苍山的。
2.2.5 金属离子螯合能力
各试样的金属离子螯合能力见图5。
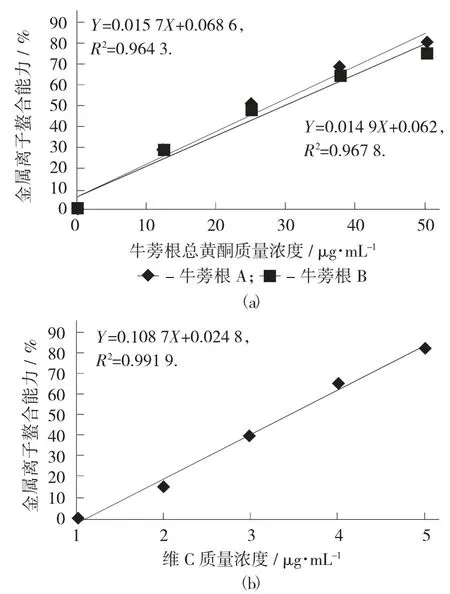
图5 各试样的金属离子螯合能力
由图5(a) 可知,在所测质量浓度范围内,随着牛蒡根总黄酮的质量浓度增加,其金属离子螯合能力都增加,对其进行线性拟合,得R2=0.964 3(A),R2=0.967 8(B),结果表明2 个的线性关系都较好,将Y=50%分别代入方程Y=0.015 7X+0.068 6(A),Y=0.014 9X+0.062(B),得到牛蒡根总黄酮金属离子螯合能力的IC50值分别为27.48±0.24 μg/mL(A),29.40±0.32 μg/mL(B),同样由图 5(b) 可知,维 C 的 IC50值为 4.83±0.054 μg/mL,可见两地牛蒡根总黄酮的金属离子螯合能力是维C 的1/6,说明其均具有较强的金属离子螯合能力,且牛蒡根A总黄酮的金属离子螯合能力强于牛蒡根B 总黄酮。
2.2.6 铁离子还原能力
各试样的铁离子还原能力见图6。
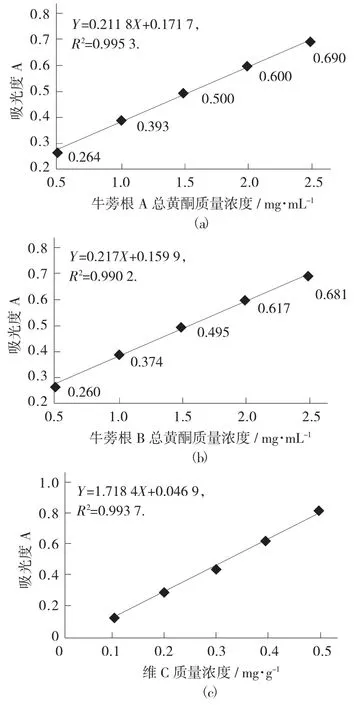
图6 各试样的铁离子还原能力
由图6(a) 和(b) 可知,在所测质量浓度范围内,随着牛蒡根总黄酮的质量浓度增加,其铁离子还原能力都增加,对其进行线性拟合,得R2=0.995 3(A),R2=0.990 2(B),结果表明2 个的线性关系都较好,又由图中数据可以看出,相同质量浓度下的牛蒡根A 和牛蒡根B 的总黄酮的吸光度相差较小,由于吸光度值与还原力强度成正比,吸光度越大,表明其还原能力越强,由此说明两地牛蒡根总黄酮的铁离子还原能力几乎没有差别。与维C 比较,相同吸光度下的牛蒡根A 和牛蒡根B 的总黄酮质量浓度约为维C 质量浓度的3 倍,可见牛蒡根总黄酮有较强的铁离子还原能力。
2.3 体内抗氧化结果
2.3.1 不同给药方式对小鼠体重的影响
不同给药方式下的小鼠体重变化见表2。
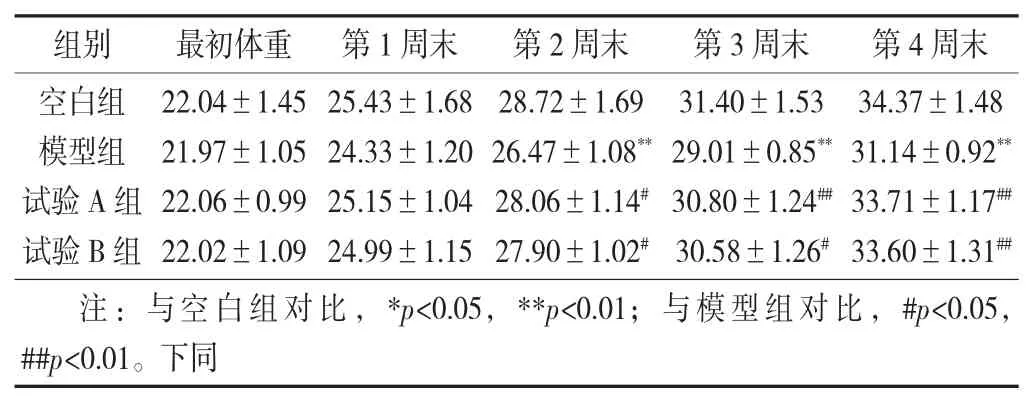
表2 不同给药方式下的小鼠体重变化 / g
由表2 可知,适应性喂养5 d 后,随机分组,各组的体重无显著差异。从第2 周末开始,模型组与空白组呈现极显著差异(p<0.01),说明空白组增重幅度比模型组大很多,呈现极显著差异。随着给药天数的增加,模型组小鼠逐渐呈现衰老状态,主要表现为食量减小、进食不积极、毛色暗淡无光泽、眼球暗红无神、体力差、容易抓取,说明注射D -半乳糖致小鼠衰老模型造模成功。第2 周末,试验A 组和B 组均与模型组呈现显著差异(p<0.05);第3 周末,试验A 组与模型组呈现极显著差异(p<0.01),试验B 组与模型组呈现显著差异(p<0.05);第4 周末,试验A 组和B 组均与模型组呈现极显著差异(p<0.01)。说明牛蒡根总黄酮有延缓衰老的作用,随着时间的增加作用越明显。试验A 组和B 组无显著差异,不具有统计学意义。
2.3.2 牛蒡根总黄酮对小鼠血清、肝脏的T-AOC、SOD、MDA 和 CAT 的影响
小鼠血清、肝脏的T-AOC、SOD、MDA 和CAT见表3。
由表3 可知,模型组小鼠的血清和肝脏中的T-AOC、SOD、和CAT 与空白组相比,都极显著(p<0.01) 地降低,MDA 极显著增加,表明模型构建是成功的。试验A 组能极显著(p<0.01) 地提升小鼠血清和肝脏的T-AOC、CAT 活性,显著(p<0.05)提升小鼠血清和肝脏的SOD 活性,同时极显著(p<0.01) 地降低小鼠血清和肝脏的MDA 含量、试验B 组能极显著(p<0.01) 地提升小鼠血清与肝脏的T-AOC 和小鼠肝脏中的CAT 活性,显著(p<0.05) 提升小鼠血清中的CAT 活性和小鼠血清与肝脏的SOD 活性,同时极显著(p<0.01) 地降低小鼠血清和肝脏的MDA 含量。也就是说,牛蒡根A 总黄酮和牛蒡根B 总黄酮都能较好地提升D -半乳糖致衰老模型小鼠的总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD) 活性、过氧化氢酶(CAT) 活性和降低其丙二醛(MDA) 含量,说明两地牛蒡根总黄酮都具有很好的体内抗氧化活性,可以作为天然抗氧化剂加以开发利用,为其后续的研究开发提供基础。
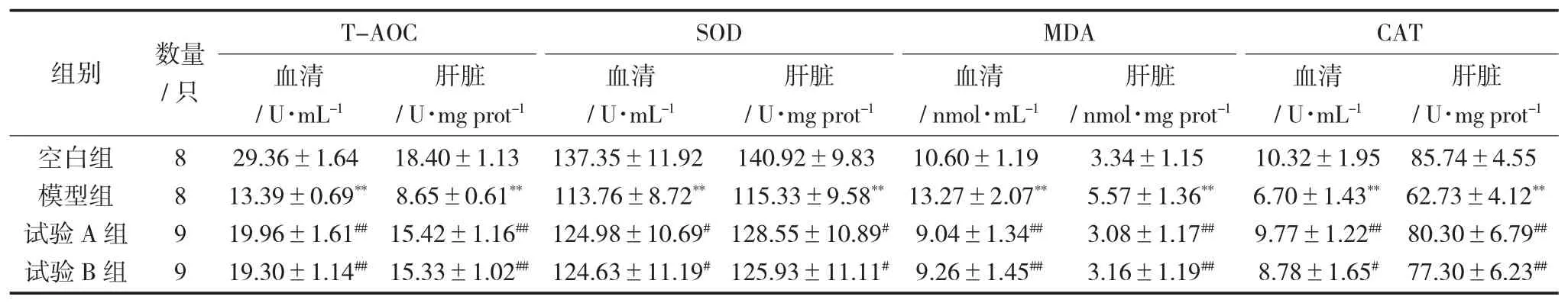
表3 小鼠血清、肝脏的T-AOC、SOD、MDA 和CAT
3 结论
自由基是客观存在的,其能对机体造成损伤,引起多种疾病,如肝硬化、动脉粥样硬化、关节炎、老年性痴呆、提前衰老等[23],且与自由基有关的疾病发病率逐年上升。在抗氧化剂的作用下,自由基能不断地被清除。清除自由基能力越强,则抗氧化性越强。生物体内存在某些过渡金属离子如铁、铜等,他们能够通过催化某些物质(如过氧化氢) 产生自由基,对机体造成危害,当具有抗氧化活性的物质存在时,其能够鏊合金属离子、阻止自由基的形成。物质的还原能力反映出其提供电子和氢自由基的能力,还原能力与抗氧化活性之间有显著的相关性,还原能力越强,抗氧化能力越强。试验从DPPH 自由基清除能力、羟自由基清除能力、超氧阴离子自由基清除能力、金属离子螯合能力、总抗氧化能力和铁离子还原能力6 个方面考查了纯化后牛蒡根A和牛蒡根B 总黄酮的体外抗氧化活性。结果表明,徐州和苍山两地的牛蒡根多酚总黄酮都具有很强的总抗氧化能力和铁离子还原力、DPPH 自由基清除能力 (IC50:0.542±0.049 mg/mL(A),0.642±0.058 mg/mL(B))、羟自由基清除能力(IC50:0.761±0.068 mg/mL(A),1.04±0.098 mg/mL(B))、超氧阴离子自由基清除能力(IC50:0.793±0.084 mg/mL(A),1.06±0.12 mg/mL(B))、金属离子螯合能力(IC50:27.48±0.24 μg/mL (A),29.40±0.32 μg/mL(B)),且没有明显差异,也就是说牛蒡根总黄酮可以很好地清除自由基并螯合金属离子以阻止自由基的产生,体现其具有良好的体外抗氧化活性,因此牛蒡根可以作为天然抗氧化剂加以开发利用。
机体的防御体系抗氧化能力与健康存在着密切的联系,当机体的总抗氧化能力降低时,则易引起各种疾病。SOD 几乎存在于所有生物细胞中,是生物体内中药的抗氧化酶,SOD 能清除超氧阴离子自由基,保护细胞免受损伤[24-25]。SOD 活力的高低间接地反映了机体清除自由基的能力。MDA 含量的高低反映了机体内脂质过氧化的程度,间接反映了细胞的受损程度[26]。MDA 的测定常常与SOD 的测定互相配合。CAT 普遍存在于生物机体内,它可以催化过氧化氢分解为水和氧气,使得过氧化氢不至于与氧在铁螯合物作用下反应生成非常有害的羟自由基,从而保护机体免受有害物质损伤。从小鼠血清和肝脏的 T-AOC、SOD 活性、MDA 含量、CAT 活性 4 个方面考查了2 个不同地方(徐州和苍山) 牛蒡根总黄酮对D - 半乳糖致衰老小鼠的体内抗氧化活性。结果表明,两地牛蒡根总黄酮都能显著地提升小鼠血清和肝脏的T-AOC、CAT 活性、SOD 活性,同时能显著降低小鼠血清和肝脏的MDA 含量,且两地牛蒡根总黄酮体内抗氧化活性没有显著差异。由此可见,两地牛蒡根总黄酮都具有较好的体内抗氧化活性,进一步说明,牛蒡根在抗氧化性方面极具开发价值。
