鲅鱼加工副产物水解液中ACE 抑制肽分离纯化研究
2021-08-07章禹航韩颖张唯嘉黄光荣
章禹航,翟 雨,韩颖,张唯嘉,冯 涛,黄光荣
(中国计量大学生命科学学院,浙江杭州 310018)
血管紧张素转化酶(Angiotensin converting enzyme,ACE) 抑制肽,可以阻止血管紧张素II 的生成,从而起到降低血压的作用,是近年来研究比较多的一种生物活性肽,最早于1970 年由Ferreira S H等人[1]从毒蛇毒液中分离得到。如今,已有大量报道从动植物组织中获得并鉴定的ACE 抑制肽,且有部分已商业化应用。从动植物组织中获得ACE 抑制肽通常有2 种手段:直接分离纯化天然ACE 肽,或者是以组织蛋白质为原料进行酶解获得ACE 肽。海洋鱼类种类众多,是制备ACE 抑制肽的良好来源之一[2-4]。鲅鱼,学名“蓝点马鲛”(Scomberomorus niphonius),作为一种低价值的海洋鱼类,以鲜食和初级加工为主,精深加工利用的报道相对较少。目前,在鲅鱼加工副产物制备生物活性肽方面,主要有抗氧化肽[5-7]、抗菌肽[8]、矿物质结合肽[9]等。以鲅鱼加工副产物为原料,先经脱脂后得到鱼粉蛋白,再经碱性蛋白酶酶解,最后经超滤、层析分离和高效液相色分离得到纯度较高的具有较强ACE 抑制活性的小肽,为下一步氨基酸序列鉴定提供基础。
1 材料与方法
1.1 材料与试剂
鲅鱼加工副产物,浙江舟山某企业提供,实验室冷冻保存;碱性蛋白酶,酶活力为200 U/mg;DEAE-Sepharodse FF、Sephacryl S-100 等,美国GE公司提供;HHL,生化纯;乙腈、甲醇、三氟乙酸等为色谱纯,乙酸乙酯、无水硫酸铜、福林酚、石油醚、乙醇、三羟甲基氨基甲烷(Tris) 等,均为分析纯。
1.2 仪器与设备
Allegra X-30 型高速冷冻离心机,美国Beckman公司产品;DGG-9140B 型鼓风干燥箱,上海森信实验仪器有限公司产品;RV-10 型数显型旋转蒸发仪,德国IKA 公司产品;SHZ-A 型水浴恒温振荡器,常州人和仪器厂产品;UV1000 型分光光度计,上海元析仪器有限公司产品;ATKA Pure 20 型蛋白纯化系统,美国GE 公司产品;LC-6AD 型半制备高效液相色谱,日本岛津公司产品;Masterflex L/S 型超滤系统,美国Cole-Pharmer 公司产品;8010S 型组织捣碎机,美国Waring 公司产品;Scientz-30 型冷冻干燥机,宁波新芝生物科技股份有限公司产品。
1.3 试验方法
1.3.1 鲅鱼酶解液的制备
鲅鱼加工副产物用流水解冻后,剔除骨头和杂质,经组织捣碎机打成浆,以1∶5(W∶V) 比例的异丙醇于75 ℃下脱脂回流3h,然后过滤,得到的滤渣在55 ℃下鼓风干燥1~2 h,再经粉碎,过100 目筛,于玻璃瓶中密封,备用。
称取30 g 脱脂鱼粉,分散到浓度为20 mmol/L,pH 值8.67 的Tris-HCl 缓冲液2 L 中,搅拌混匀,并在55 ℃下恒温10 min 后加入75 mg 碱性蛋白酶,搅拌混匀,开始计时,水解4.45 h。然后于沸水浴中加热10 min,使酶失活,再经流水冷却到室温后进行离心(以转速12 000 r/min 离心20 min),收集上清液,4 ℃下保存,备用。
1.3.2 超滤分离
水解液先经0.45 μm 微孔滤膜过滤,再依次通过10,5,3 kDa 的膜包进行超滤,收集到4 个组分:组分 I(>10 kDa)、组分 II(5~10 kDa)、组分III(3~5 kDa)、组分IV(<3 kDa)。组分经冷冻干燥后,密封保存,备用。
1.3.3 离子交换层析分离
将超滤组分以蒸馏水溶解(20 mg/mL),在ATKA Pure 20 型蛋白纯化系统中进行DEAESepaherose FF 阴离子交换层析(1.0 cm×40 cm)。梯度洗脱缓冲液为:A 液,50 mmol/L,pH 值7.0 Tris-HCl 溶液;B 液,1.0 mol/L NaCl 溶液的 A 液;洗脱流速为1.0 mL/min,进样体积为5.0 mL。洗脱程序:①A 液洗脱30 min;②120 min 内B 液升到100%;③B 液洗脱60 min;④A 液洗脱60 min。重复以上操作,收集A220nm组分,冷冻干燥保存。
1.3.4 凝胶过滤层析
将离子交换层析组分以蒸馏水溶解(20 mg/mL),在ATKA Pure 20 蛋白纯化系统中进行Sephacryl S-100 HR 凝胶过滤层析(1.6 cm×60 cm),以蒸馏水为流动相进行等度洗脱,流速1.0 mL/min,进样量0.5 mL。重复以上操作,收集A220nm组分,冷冻干燥保存。
1.3.5 反相高效液相色谱
将凝胶过滤层析组分以蒸馏水溶解(1.0 mg/mL),在LC-6AD 型半制备高效液相色谱中进行分离,色谱条件:进样量10 μL,色谱柱为C18柱(Waters Sunfire,4.6 cm×250 mm,5.0 μm),检测波长220 nm,流速为0.6 mL/min,梯度洗脱(60 min 内流动相乙腈由5%线性增加到40%)。重复以上操作,收集A220nm组分,并经旋转蒸发浓缩后进行蛋白质和活性测定。
1.4 测定方法
1.4.1 水解度测定
采用茚三酮比色法测定游离氨基含量[10],总蛋白质采用凯氏定氮法测定[11],用已水解的氨基数占原料总氨基百分数表示水解度。
1.4.2 蛋白质含量测定
可溶性蛋白质含量测定采用福林酚法[12]。
1.4.3 ACE 抑制率测定
样品根据测定的蛋白质浓度以蒸馏水稀释到0.5 mg/mL 后,采用液相色谱法测定[13],高效液相色谱样品稀释到0.1 mg/mL 后测定。
1.5 数据处理
数据3 次平行测定,以平均值±SD 表示。
2 结果与分析
2.1 超滤
鲅鱼脱脂粉以碱性蛋白酶水解,得到酶解液,测得其水解度为32.84%。将酶解液超滤分离,获得4 个超滤组分:组分 I(>10 kDa)、组分 II(5~10 kDa)、组分 III(3~5 kDa) 和组分 IV (<3 kDa)。
超滤各组分的ACE 抑制率见图1。

图1 超滤各组分的ACE 抑制率
由图1 可知,组分Ⅳ(分子量小于3 kDa) 的ACE 抑制活性最高,抑制率达45.6%,这与朱国萍等人[14]对虾头自溶释放出的肽类产物进行超滤分离出的结果相类似,有文献报道很多ACE 抑制肽由15 个以下氨基酸组成[15]。因此,选择组分Ⅳ进一步分离纯化。
2.2 离子交换层析
将超滤得到的分子量小于3 kDa 组分IV,进一步经DEAE-Seopharose FF 阴离子交换层析分离。
DEAE-Sepharose FF 阴离子交换层析分离图见图2,离子交换层析分离各组分ACE 抑制活性见表1。

图2 DEAE-Sepharose FF 阴离子交换层析分离图

表1 离子交换层析分离各组分ACE 抑制活性/%
由图2 可知,经DEAE-Seopharose FF 分离可得到3 个组分,大量重复收集组分,测定ACE 抑制率。结果表明,组分A2 的ACE 抑制率最高,达50.3%,组分A3 则最低,仅12.4%。将A2 组分进行冻干,作为凝胶过滤层析用样品。
2.3 凝胶过滤层析
Sephacryl S-100 HR 凝胶过滤层析分离图见图3,凝胶过滤层析分离各组分ACE 抑制活性见表2。
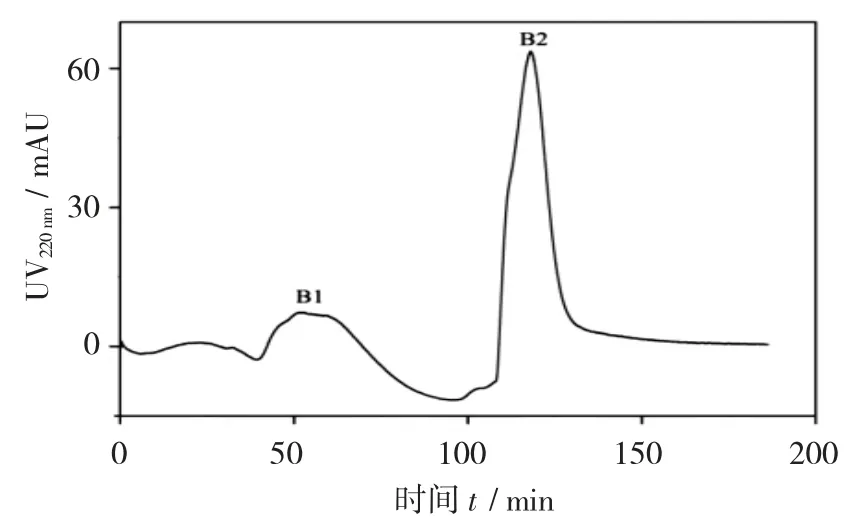
图3 Sephacryl S-100 HR 凝胶过滤层析分离图

表2 凝胶过滤层析分离各组分ACE 抑制活性/%
将组分A2 溶解于蒸馏水后,置于凝胶过滤柱层析分离,并收集组分,测定ACE 抑制率。由图3 可知,经Sephacryl S-100 HR 层析分离后得到2 个主要峰组分B1 和B2,测定其ACE 抑制活性。由表2可知,B1 和B2 组分的ACE 抑制率分别为31.1%和83.4%,显然,分子量更小的B2 组分的ACE 抑制活性高于B1 组分。收集B2 组分,冷冻干燥后供反相高效液相色谱分离。
2.4 反相高效液相色谱
将凝胶过滤层析收集的具有最高ACE 抑制活性的组分B2,进一步进行半制备液相色谱分离纯化。结果表明,在5 min 与7 min 处有2 个峰,分别标记为组分C1 和C2,经ACE 抑制活性测定,发现C2组分ACE 抑制率接近于0,C1 组分ACE 抑制率为87.6%(蛋白质质量浓度0.1 mg/mL)。
反相高效液相色谱分离图见图4。

图4 反相高效液相色谱分离图
3 结论
以鲅鱼加工副产物为原料,经碱性蛋白酶水解,以期获得ACE 抑制肽。酶解液经超滤、离子交换层析、凝胶过滤层析和反相高效液相色谱等分离纯化步骤,获得具有较高纯度的ACE 抑制活性组分,ACE 抑制率达87.6%(0.1 mg/mL)。研究结果为鲅鱼加工副产物高附加值利用和预防高血压的功能性食品开发提供了参考,后续将进一步对C1 组分进行氨基酸序列鉴定,并人工合成该小肽,进行活性验证,同时试验其在模型细胞中的ACE 抑制活性及试验动物中的活性,还将进一步研究其在消化道中稳定性与吸收特性等,以期为鲅鱼加工副产物制备降血压肽的商业化应用提供基础数据。
