山奈酚调控AMPK/NOX4通路抑制高糖诱导的肾小球系膜细胞氧化应激和胞外基质积聚
2021-08-07玄露露李彦秋王怀杰赵春贞王荣申李万忠
玄露露,李彦秋,王怀杰,柳 凡,陈 莹,赵春贞,王荣申*,李万忠*
1潍坊医学院药学院,潍坊 261053;2山东大学齐鲁医学院,济南 250012
DN有多种发病机制,其中OS是DN中关键致病因素,系由ROS水平升高引起[2]。烟酰胺腺嘌呤二核苷酸磷酸酯(reduced nicotinamide adenine dinucleotide phosphate,NADPH)家族(NOX 1-5和Duox 1-2)通过质膜将电子转移到氧分子上产生ROS,此为DN中ROS主要来源之一[3]。NADPH氧化酶4(NADPH oxidase 4,NOX4)是DN患者肾脏中高度表达的NADPH亚型,是高糖诱导GMCs中OS产生的主要原因[3]。NOX4水平升高能够直接引起肾小球纤维化[2]。沉默NOX4表达将会减弱肾小球膜扩张、肾小球硬化和ECM积聚,揭示高糖刺激NOX4表达升高的分子机制及其涉及的上下游效应因子具有重要意义。
5′-腺苷单磷酸激活蛋白激酶(5′-adenosine monophosphate-activated protein kinases,AMPK)磷酸化可以阻断高糖诱导的NOX4表达,同时能够抑制肾成纤维细胞的异常增殖和激活[4]。Sestrins是一种重要的应激诱导蛋白家族,在维持细胞内环境稳定中起重要作用,其中Sestrin2是最重要的家族成员之一,可通过激活AMPK磷酸化,在保护细胞免受氧化损伤中起关键作用[5]。此外,AMPK可能是NOX激活的负调节剂,因为Sestrin2和AMPK激活可以抑制ROS,保护GMCs免受OS侵害[6],表明激活Sestrin2和AMPK磷酸化可能具有预防DN作用。
基于OS和ECM积累已被证明在DN发病机理中起到重要作用,所以寻找具有抗氧化作用和减弱DN效应的中药及天然产物显得尤为迫切。黄酮类成分因其出色功效而引起越来越多的学者研究。山奈酚(kaempferol,KAE)是一种黄酮类化合物,已被证明具有多种药理活性。KAE通过抑制炎症反应和OS,减轻高血糖所致心脏损伤[7];通过抑制RhoA/Rho激酶介导的炎症信号,从而改善DN[8]。目前,关于KAE通过调节AMPK/NOX4途径干预高糖诱导的GMCs OS和ECM积累的研究相对较少。本研究运用GMCs体外高糖模型,探讨KAE对高糖诱导的GMCs中OS和ECM积累的影响及其对DN的保护作用机制。
1 材料与方法
1.1 实验材料
山奈酚(纯度≥98%,HPLC分析,成都曼斯特生物科技有限公司);GMCs细胞(南京KeyGen生物技术公司);DMEM培养基(南京KeyGen生物技术公司);DMSO、DCFH-DA荧光探针、青链霉素、MTT、RIPA裂解液和PMSF蛋白酶抑制剂(索莱宝生物技术公司);BCA蛋白测定试剂盒和Trizol(江苏康为世纪有限公司);Diphenylene iodonium(DPI,纯度:99.90%,HY-100965,上海MCE公司);高灵敏度NADPH荧光定量试剂盒和Lipofectamine 2000(美国Sigma公司);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)(南京建成生物技术有限公司);Compound C(纯度:99.65%,HY-13418A,上海MCE公司);Anti-Sestrin2(ab236025,Abcam);anti-phospho-AMPK(ab133448,Abcam);anti-AMPK(ab80039,Abcam);anti-NADPH oxidase 4(ab133303,Abcam);anti-p22phox(ab75941,Abcam);TGF-β1(ab92486,Abcam);Collagen IV(ab6586,Abcam);β-actin(ab8227);GAPDH(ab8245);cDNA逆转录试剂盒、SYBR荧光(日本Toyobo公司)。
1.2 实验仪器
荧光倒置显微镜(日本Nikon公司);实时荧光定量PCR仪(美国罗氏公司);梯度PCR仪(德国Eppendorf公司);凝胶成像分析系统(美国Bio-Rad公司);蛋白电泳仪(美国Bio-Rad公司);M5多功能酶标仪(美国Molecular Devices公司)。
1.3 细胞培养
GMCs细胞用含有10%胎牛血清的DMEM培养基在37 ℃、5% CO2细胞培养箱中常规培养,待细胞融合度达到80%,接种于96孔板,进行如下分组:正常组(normal glucose group,NG,5.6 mM葡萄糖);高糖组(high glucose group,HG,30 mM葡萄糖);渗透压组(mannitol group,MA,30 mM甘露醇);DPI(阳性药物组,10 μM DPI + 30 mM葡萄糖);山奈酚药物组(5、10、20、40、80 μg/mL KAE + 30 mM葡萄糖)[9]。为了抑制AMPK/NOX4通路,使用compound C(10 μM)抑制AMPK表达。使用100 pmol的siNOX4、sip22phox瞬时转染GMCs,48 h后,Western blot检测沉默效率。
1.4 细胞毒性试验
将GMCs(5×103个/mL)接种于96孔板内,每孔加入100 μL含有不同浓度的KAE溶液(5、10、20、40、80 μg/mL)以及10 μM的DPI溶液,继续培养48 h。每孔加入100 μL MTT(0.5 mg/mL)避光培养4 h,弃去上清液,每孔加入100 μL的DMSO,脱色摇床振荡10 min,使底部甲瓒完全被DMSO溶解,用酶标仪在490 nm波长下测定各孔吸光度值。
二是在县农产品质量安全监督管理站建成农产品质量安全监管平台,重点生产基地、农产品批发市场设立检测室,对农产品质量、产地、用药情况等追踪溯源,实现从产前、产中、上市前全程受控,确保了全县产销农产品质量安全。
1.5 细胞增殖
将GMCs(5×103个/mL)接种于96孔板内,按照“1.3”进行细胞分组处理48 h,MTT法检测细胞增殖。
1.6 细胞内ROS测定
使用荧光探针DCFH-DA检测细胞内ROS水平。将细胞接种于96孔或6孔板内,按照1.3进行细胞分组处理48 h,每孔加入10 μM DCFH-DA,避光培养30 min。PBS洗涤3次,在倒置荧光显微镜下观察荧光,酶标仪(λex= 488 nm,λem= 525 nm)测定荧光强度。
1.7 细胞内NOX、MDA、SOD活性测定
使用高灵敏度NADPH荧光定量测定试剂盒测定细胞内NOX活性。收集GMCs,1 000×g离心3 min。弃去上清,PBS洗涤2次。用200 μL预冷的NADPH提取缓冲液破碎细胞。冰上静置10 min,10 000×g离心5 min,以去除杂质。吸取上清与NADPH工作液混合,室温孵育60 min。用酶标仪(λex= 535 nm,λem= 587 nm)测定荧光强度。MDA和SOD抗氧化指标按相应说明书进行测定。每个实验重复三次。
1.8 RNA提取和实时定量PCR(qRT-PCR)分析
Trizol提取细胞总RNA,Toyobo高容量逆转录试剂盒反转录成cDNA。采用实时荧光定量PCR仪进行qRT-PCR分析,检测相关mRNA的表达。2-ΔΔCt方法计算并进行数据分析。GAPDH作为内参对照。引物序列如下:GAPDH,正向GTTACCAGGGC TGCCTTCTC和反向ACCAGCTTCCCATTCTCAG;NOX4,正向TGCATGGTGGTGGTATTGTTCCTC和反向AGCAGCAGCAGCATGTAGAAGAC;p22phox,正向CATGGAGCGGTGTGGACAGAAG和反向GCAGGCACGG ACAGCAGTAAG;TGF-β1,正向GCAACAATTCCTGGCGTTACCTTG和反向TGTATTCCGTCTCCTTGGTTCAGC;Col IV,正向GATTGTGGTGGCT CTGGCTGTG和反向TCGTTCCAGGAAGTCCAGGTTCTC;Sestrin2,正向GACAACCTGGCGGTGGTGATG和反向CGTGTGCAGCAGCAGGTAGTG;AMPK,正向GACAACCTGGCGGTGGTGATG和反向CGTGTGCAGCAG CAGGTAGTG。
1.9 Western blot
收集GMCs,用含10% PMSF的RIPA裂解液进行裂解并提取蛋白。使用BCA蛋白试剂盒测定蛋白浓度。吸取样品30 μg加入到8%或12% SDS-PAGE凝胶中电泳,并用湿转法转移到PVDF膜上。用5%脱脂奶粉封闭膜1.5 h,TBST洗涤三次,在Sestrin2、AMPK、P-AMPK、NOX4、p22phox、TGF-β1、Col IV、β-Actin或GAPDH的特异性一抗中4 ℃孵育过夜。TBST洗涤三次,二抗室温孵育1 h,凝胶成像分析系统进行检测,Image J软件定量分析蛋白条带灰度值。β-Actin或GAPDH作为内参。
1.10 分子对接
Sestrin2(PDB ID:6N0M)和AMPK(PDB ID:4CFF)晶体结构从RCSB蛋白数据库下载,运用MOE软件进行对接研究。
1.11 统计分析
所有数据以Mean±SEM表示,采用单因素方差分析(ANOVA)分析多组间的显著性差异。数据统计分析使用GraphPad Prism软件进行。每个实验至少独立重复三次,P< 0.05为差异有统计学意义。
2 实验结果
2.1 山奈酚抑制HG诱导的GMCs细胞增殖
为了研究KAE对GMCs的作用,通过MTT法测定细胞增殖。如图1a所示,运用不同剂量的KAE(5、10、20和40 μg/mL)作用细胞48 h后,细胞活力没有明显变化,表明该剂量下KAE没有细胞毒性。基于此,我们选取浓度为5、10、20 μg/mL的KAE进行后续实验。在此基础上,研究KAE对HG诱导的GMCs增殖影响,结果如图1b显示。与低糖(NG)组相比,HG显著刺激细胞生长;KAE以浓度依赖性方式抑制细胞增殖;MA组中细胞增殖与低糖组相似,表明HG刺激细胞异常增殖,而不是由于渗透压升高所致。
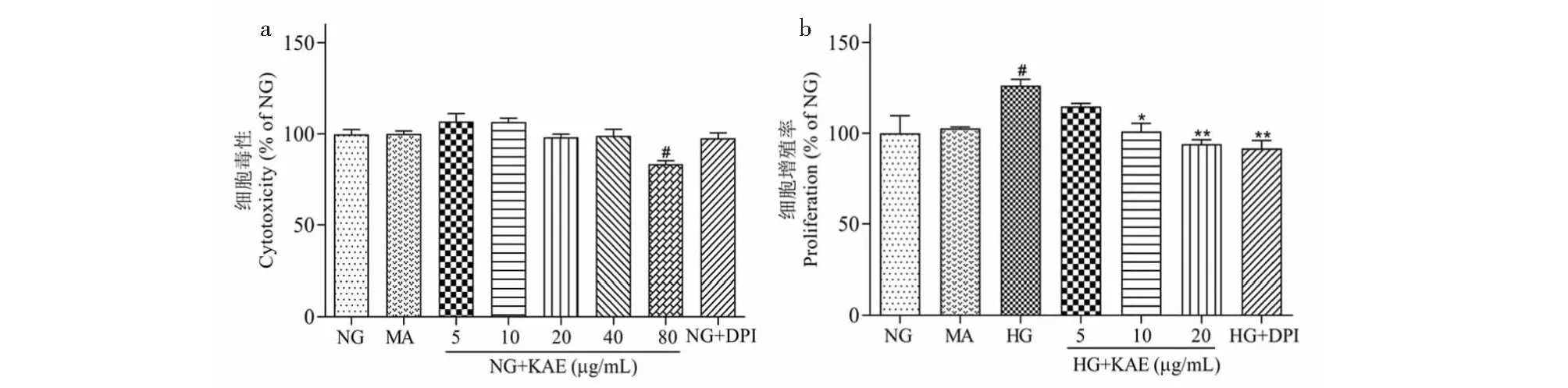
图1 山奈酚(KAE)抑制高糖(HG)诱导的GMCs细胞增殖Fig.1 Kaempferol (KAE) attenuated high glucose (HG)-stimulated cell proliferation in GMCs注:(a)MTT法测定山奈酚对GMCs细胞毒性的影响;(b)MTT法测定山奈酚对高糖诱导的GMCs增殖的影响。与NG比较,#P < 0.05;与HG比较,*P < 0.05,**P < 0.01。Note:(a) The effects of KAE on the cytotoxicity of GMCs were assessed by MTT assay;(b) The effects of KAE on HG-induced GMCs proliferation were assessed by MTT assay.#P < 0.05 vs NG;*P < 0.05,**P < 0.01 vs HG.
2.2 山奈酚抑制HG诱导的GMCs细胞内ROS的产生
为了研究HG刺激GMCs后细胞内ROS水平变化,使用DCFH-DA荧光探针作用细胞,荧光倒置显微镜下拍照观察,在λex = 488 nm,λem = 525 nm下用酶标仪测定荧光强度,结果如图2所示。与NG组相比,HG组内细胞绿色荧光更多更强,ROS产生明显增加(见图2a);KAE作用24 h后ROS产生降低(图2a、b),说明KAE能够清除细胞内ROS,具有一定抗氧化作用。
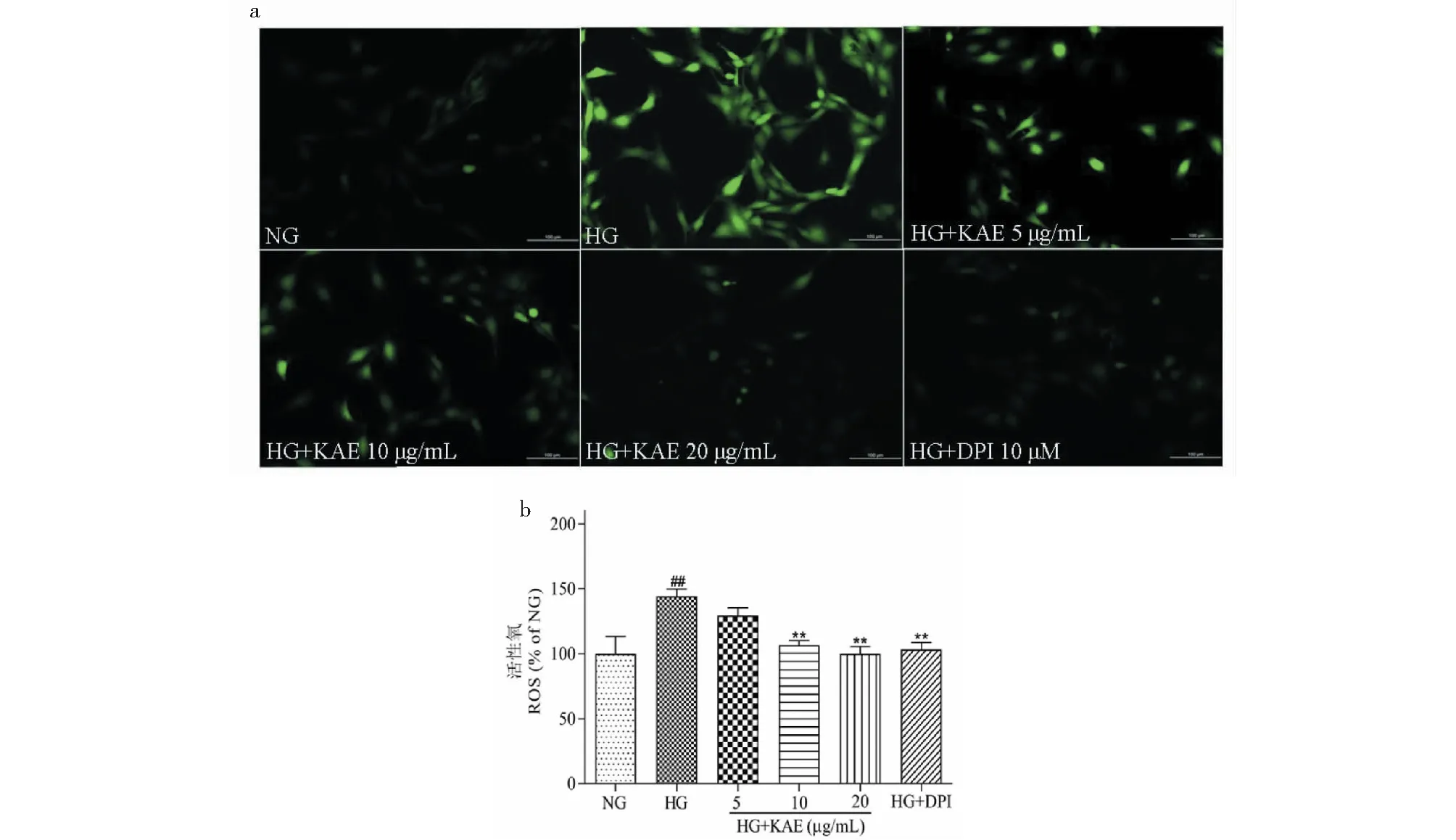
图2 山奈酚(KAE)抑制高糖(HG)诱导的GMCs细胞内ROS的生成Fig.2 KAE attenuated high glucose (HG)-stimulated ROS generation in GMCs注:(a)DCFH-DA荧光探针作用细胞,倒置荧光显微镜记录山奈酚对细胞内ROS产生的影响;(b)用酶标仪定量ROS水平。与NG比较,##P < 0.01;与HG比较,**P < 0.01。Note:(a) GMCs were treated with DCFH-DA fluorescent probe,and the effects of KAE on intracellular ROS production were recorded by inverted fluorescence microscopy;(b) The ROS level was quantified by microplate reader.##P < 0.01 vs NG;**P < 0.01 vs HG.
2.3 山奈酚对HG诱导的GMCs细胞内NOX、MDA、SOD影响
为了研究KAE抗氧化能力,使用试剂盒检测细胞内NOX、MDA、SOD水平变化,如图3a、b所示。与NG组相比,HG刺激细胞后,细胞内NOX活性、MDA含量明显增高;经过KAE处理后,显著抑制NOX和MDA活性。如图3c可知,在HG刺激下,细胞内SOD活性显著下降,KAE可以剂量依赖性方式增加SOD活性,表明KAE通过去除自由基而保护细胞免受氧化应激损害。

图3 山奈酚(KAE)对高糖(HG)诱导的GMCs细胞内NOX、MDA、SOD的影响Fig.3 Effects of kaempferol (KAE) on NOX,MDA and SOD in high glucose (HG)-stimulated GMCs注:山奈酚对高糖诱导的GMCs细胞内NOX(a)、MDA(b)、SOD(c)的影响。与NG比较,##P < 0.01;与HG比较,**P < 0.01。Note:Effects of KAE on NOX (a),MDA (b),SOD (c) in HG-induced GMCs.##P < 0.01 vs NG;**P < 0.01 vs HG.
2.4 山奈酚对HG诱导的GMCs细胞内ECM积聚影响
DN早期变化是GMCs肥大,这是由于高血糖早期阶段蛋白质合成增加所致。如图4a所示,HG组中细胞总蛋白与细胞数量的比率明显大于NG组;经KAE处理,细胞比率呈剂量依赖性下降。为了阐明KAE对ECM积累影响,利用qRT-PCR评估TGF-β1和Col IV的mRNA表达水平。如图4b、c所示,HG显著刺激GMCs中TGF-β1和Col IV mRNA表达;KAE处理后其表达水平下降。Western blot结果表明,KAE抑制HG刺激的GMCs中TGF-β1和Col IV蛋白水平表达(图4d~f),表明KAE可以抑制HG诱导的细胞内ECM积聚。

图4 山奈酚(KAE)对高糖(HG)刺激的GMCs内ECM的影响Fig.4 Effect of kaempferol (KAE) on ECM accumulation in high glucose (HG)-induced GMCs注:(a)细胞总蛋白与细胞数量的比率表示为μg/105个细胞;(b、c)qRT-PCR分别检测KAE处理对TGF-β1和Col IV mRNA表达的影响;(d~f)Western blot分别检测KAE处理对TGF-β1和Col IV蛋白表达的影响。与NG比较,#P < 0.05,##P < 0.01;与HG比较,*P < 0.05,**P < 0.01。Note:(a) The ratio of total protein to cell number is expressed as μg/105 cells;(b,c) The mRNA effects of KAE treatment on TGF-β1,Col IV expression in HG-treated GMCs using qRT-PCR,respectively;(d-f) The protein effects of KAE treatment on TGF-β1,Col IV expression in HG-treated GMCs using Western blot,respectively.#P < 0.05,##P < 0.01 vs NG;*P < 0.05,**P < 0.01 vs HG.
2.5 山奈酚对HG诱导的GMCs细胞内NOX4和p22phox影响
NOX是一种酶复合物,可以促进ROS产生。由于NOX家族的蛋白亚型只有结合跨膜亚基(p22phox)形成活性复合物,才能发挥其生物学功能,所以我们通过qRT-PCR和Western blot分析检测KAE对NOX4和p22phox表达影响。结果表明:HG刺激GMCs中NOX4和p22phox的mRNA和蛋白水平表达,而KAE能够抑制NOX4和p22phox表达(图5a~d)。基于此,KAE可以通过抑制NOX家族蛋白亚型,发挥其抗氧化作用。
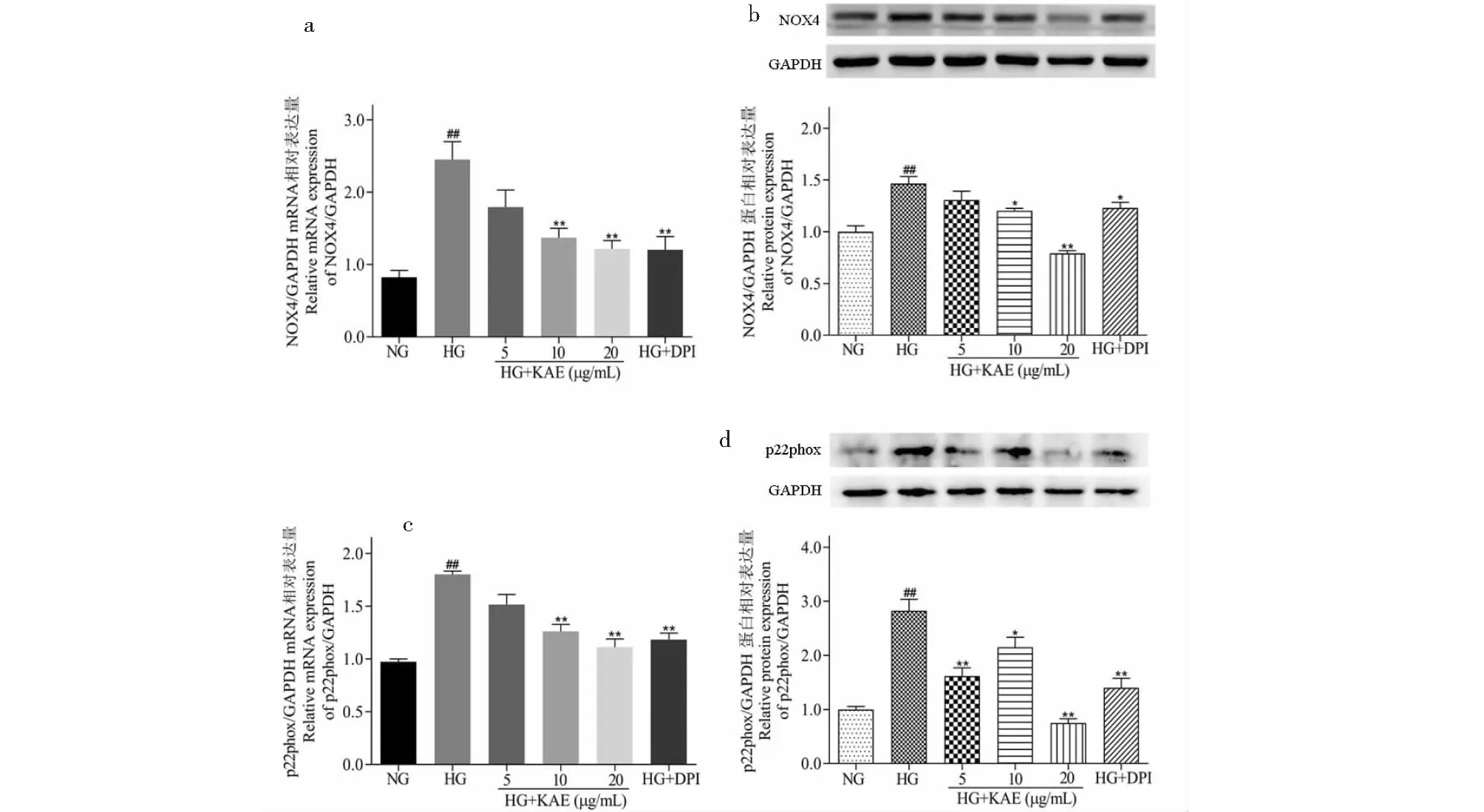
图5 山奈酚(KAE)对高糖(HG)诱导的GMCs内NOX4和p22phox表达的影响Fig.5 Effects of kaempferol (KAE) on NOX4 and p22phox expression in high glucose (HG)-induced GMCs注:(a、b)qRT-PCR和Western blot分别检测KAE对NOX4 mRNA和蛋白表达的影响;(c、d)qRT-PCR和Western blot分别检测KAE对p22phox mRNA和蛋白表达的影响。与NG比较,##P < 0.01;与HG比较,*P < 0.05,**P < 0.01。Note:(a,b) The mRNA and protein effects of KAE on NOX4 expression in HG-induced GMCs using qRT-PCR and Western blot,respectively;(c,d) The mRNA and protein effects of KAE on p22phox expression in HG-induced GMCs using qRT-PCR and Western blot,respectively.##P < 0.01 vs NG;*P < 0.05,**P < 0.01 vs HG.
2.6 山奈酚对HG诱导的GMCs中Sestrin2/AMPK通路影响
为了进一步探究KAE作用的分子机制,我们使用qRT-PCR和Western blot方法确认Sestrin2/AMPK通路的潜在参与。由图6a~d可知,与NG组相比,HG刺激抑制Sestrin2和P-AMPK表达;加入KAE后,Sestrin2和P-AMPK表达显著升高,表明KAE可以能通过激活Sestrin2/AMPK通路发挥抗氧化作用。
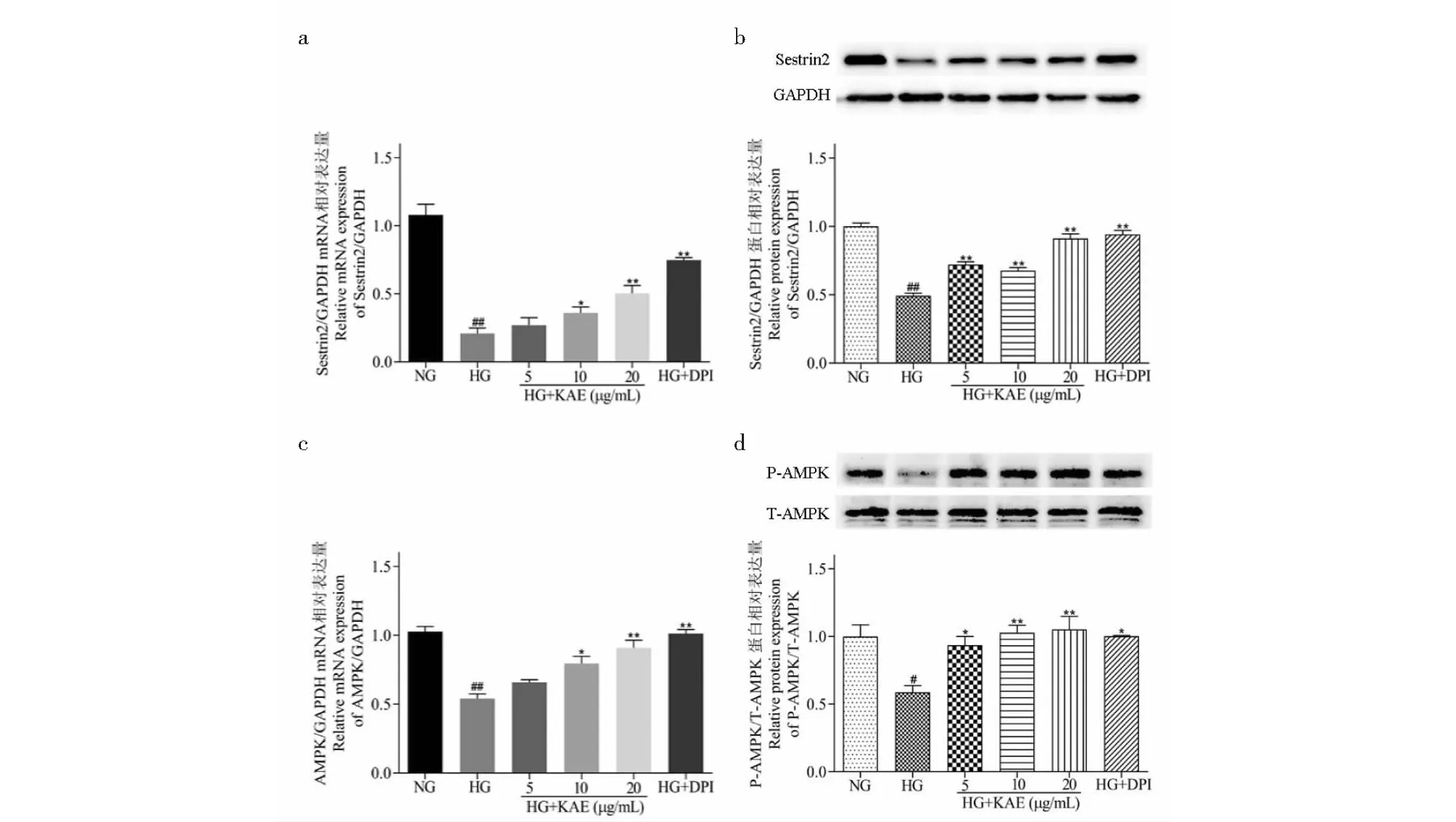
图6 山奈酚(KAE)对高糖(HG)诱导的GMCs细胞内Sestrin2和AMPK表达的影响Fig.6 Effects of kaempferol (KAE) on Sestrin2 and AMPK expression in high glucose (HG)-induced GMCs注:(a、b)qRT-PCR和Western blot分别检测KAE对Sestrin2 mRNA和蛋白表达的影响;(c、d)qRT-PCR和Western blot分别检测KAE对AMPK mRNA和蛋白表达的影响。与NG比较,#P < 0.05,##P < 0.01;与HG比较,*P < 0.05,**P < 0.01。Note:(a,b) The mRNA and protein effects of KAE on Sestrin2 expression in HG-induced GMCs using qRT-PCR and Western blot,respectively;(c,d) The mRNA and protein effects of KAE on AMPK expression in HG-induced GMCs using qRT-PCR and Western blot,respectively.##P < 0.01 vs NG;*P < 0.05,**P < 0.01 vs HG.
2.7 siNOX4和sip22phox抑制HG诱导的GMCs中ROS和ECM积聚
为了探究NOX4/p22phox在分子机制中作用,我们利用siNOX4和sip22phox小干扰RNA,将HG诱导的GMCs中NOX4和p22phox沉默。首先,利用Western blot检测基因沉默效果,与NC、NT相比,siRNA降低NOX4和p22phox表达(见图7a~c)。其次,检测在HG存在下,siNOX4和sip22phox对细胞内ROS水平影响,如图7d、e所示,与HG组相比,siNOX4和sip22phox明显抑制ROS产生。由图7f~i可知,siNOX4和sip22phox降低了TGF-β1和Col IV蛋白表达水平,说明激活HG诱导的ROS和ECM积累,可能由于NOX4/p22phox信号介导引起。
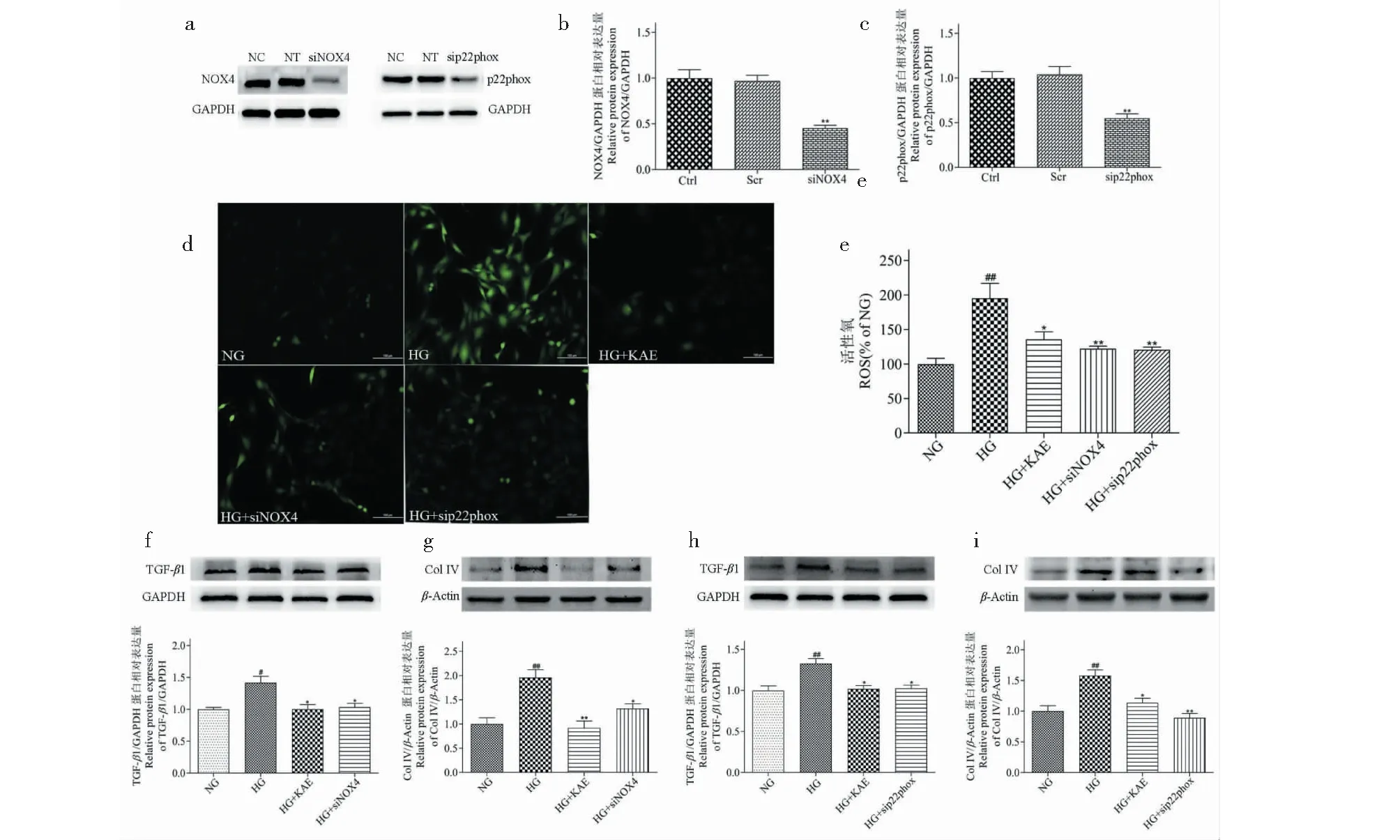
图7 siNOX4和sip22phox对高糖(HG)诱导的GMCs细胞内ROS和ECM积累的影响Fig.7 Effects of siNOX4 and sip22phox on intracellular ROS and ECM accumulation in high glucose (HG)-induced GMCs注:(a~c)用非靶向siRNA(NT)、siNOX4和sip22phox转染GMCs,Western blot检测NOX4和p22phox的蛋白表达水平;(d)DCFH-DA荧光探针作用细胞,倒置荧光显微镜记录山奈酚对细胞内ROS产生的影响;(e)用酶标仪定量ROS水平;(f~i)Western blot检测TGF-β1(f、h)和Col IV(g、i)的蛋白表达水平。与NG比较,#P < 0.05,##P < 0.01;与HG比较,*P < 0.05,**P < 0.01。Note:(a-c) GMCs were transfected with nontargeting siRNA (NT),siNOX4,sip22phox,and then the protein expression levels of NOX4 and p22phox were determined by Western blot;(d) GMCs were treated with DCFH-DA fluorescent probe,and the effects of KAE on intracellular ROS production were recorded by inverted fluorescence microscopy;(e) The ROS level was quantified by microplate reader;(f-i) The factors of TGF-β1 (f,h) and Col IV (g,i) were examined by Western blot.#P < 0.05,##P < 0.01 vs NG;*P < 0.05,**P < 0.01 vs HG.
2.8 Compound C逆转山奈酚对HG诱导的GMCs保护作用
考虑到AMPK参与KAE对HG诱导的GMCs作用,我们使用Compound C抑制AMPK表达。结果表明:Compound C逆转KAE对HG诱导的GMCs细胞增殖、OS和ECM积聚的保护作用 (见图8 a~g)。为了进一步阐明KAE是否能直接结合Sestrin2/AMPK的活性位点,采用分子对接方法研究Sestrin2与AMPK的相互作用。KAE与Sestrin2的Glu-E451、Ser-E450、Thr-E377、Tyr-E375、Thr-E374、Thr-E386形成氢键对接,与His-E454形成苯环对接(见图8h)。KAE可与AMPK的Glu-E274、Pro-A367、Lys-E170、Arg-E299和残基Arg-E269形成5个强氢键,与Arg-E269形成苯环对接(见图8i)。基于以上分析,KAE可能通过激活Sestrin2/AMPK通路发挥抗氧化作用。
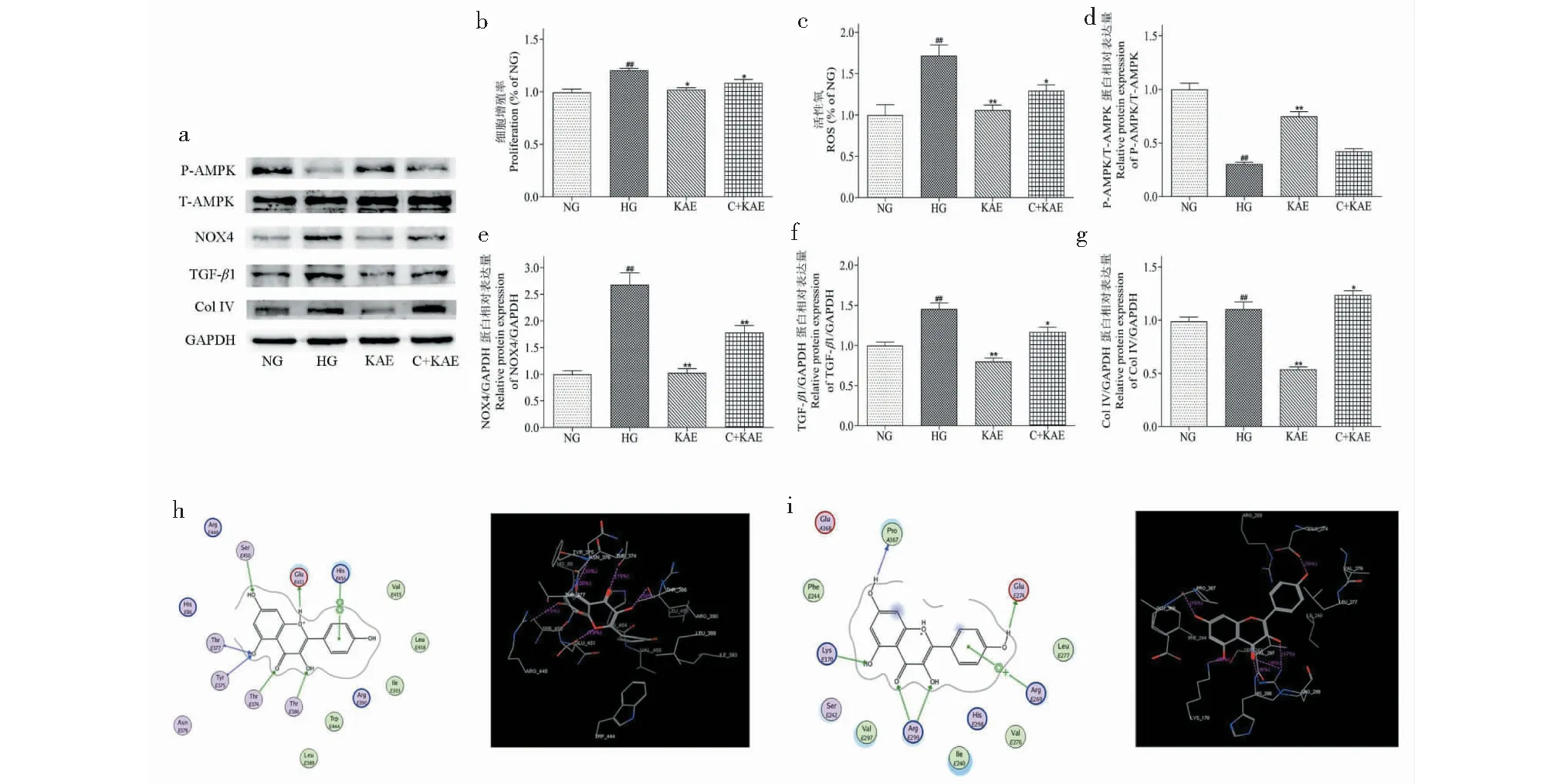
图8 Compound C逆转了山奈酚(KAE)在GMCs中对高糖(HG)诱导的细胞增殖、OS和ECM积累的保护作用Fig.8 Compound C reversed the protective effects of KAE against high glucose (HG)-induced cell proliferation,OS and ECM accumulation in GMCs注:(b)MTT法检测细胞增殖;(c)用酶标仪测定ROS水平;(a、d~g)用Western blot检测AMPK(d)、NOX4(e)、TGF-β1(f)、Col IV(g)蛋白水平;(h、i)采用分子对接方法研究了KAE与Sestrin2/AMPK的相互作用。与NG比较,##P < 0.01;与HG比较,*P < 0.05,**P < 0.01。Note:(b) The cell proliferation was assessed by MTT assay;(c) The ROS level was quantified by microplate reader;(a,d-g) The protein levels of AMPK (d),NOX4 (e),TGF-β1 (f),and Col IV (g) were determined by Western blot;(h,i) Molecular docking methods were used to study the interaction between KAE and Sestrin2/AMPK.##P < 0.01 vs NG;*P < 0.05,**P < 0.01 vs HG.
3 讨论与结论
血糖水平升高被认为是糖尿病肾病肾功能和病理改变的关键因素[10]。由于在HG环境下培养的系膜细胞表型与DN患者相似[11],故在本实验中,我们研究KAE在体外对HG诱导的GMCs损伤保护作用,结果表明KAE通过调节AMPK/NOX4途径抑制HG诱导的GMCs细胞增殖,OS和ECM积累。
DN早期特征是系膜细胞异常增殖和ECM过度沉积,通常导致肾小球系膜增生,肾纤维化和终末期肾损害[3]。胶原蛋白、纤维连接蛋白(FN)和层粘连蛋白是ECM的主要成分,其主要是在高血糖刺激下合成[12]。在DN中,TGF-β1是参与肾脏ECM积累的关键细胞因子[13]。在正常生理状况下,机体多种细胞可以分泌不活跃状态的TGF-β1;在高糖环境下,不活跃状态的TGF-β1可以转化为活跃状态,通过增加ECM基因(如Col IV)表达和减少ECM降解,促进肾小球ECM积累[13]。抑制TGF-β1能够减弱高糖诱导的ECM基因表达变化,从而减少DN中ECM积累[14]。结果表明,在高糖刺激的GMCs细胞中,TGF-β1、Col IV的mRNA和蛋白水平表达明显升高,而KAE处理后可以降低其表达,表明KAE可以通过降低ECM积累和促进其降解来发挥抗糖尿病作用。
DN发病机制与OS发生有关,可以激活细胞内多种信号通路并刺激转录因子,从而导致ECM积累增加并减少基质降解。HG诱导的ROS生成,会破坏氧化剂和抗氧化剂之间平衡,干扰抗氧化剂防御系统,从而导致GMCs受损。基于此,ROS的过量产生在DN发病机理中起到重要作用。在病理条件下,ROS清除需要酶和非酶系统的共同参与,例如SOD和MDA[15]。SOD是一种抗氧化剂金属酶,通过催化超氧阴离子和过氧化氢歧化,在维持氧化和抗氧化之间平衡中发挥重要作用[16]。MDA对抗氧化剂防御系统有影响,因为MDA水平与GMCs中膜脂质过氧化水平直接相关[16]。结果显示,KAE可能增加HG诱导的GMCs中SOD活性并降低MDA含量,表明KAE具有潜在的抗氧化特性。
ROS转导和葡萄糖信号增强被认为是促进DN发展的重要致病因素。肾脏内ROS有多种来源,其中NOX家族的NADPH氧化酶亚型主要与糖尿病肾病有关[3]。迄今为止,研究发现NOX家族有七个亚型,其中NOX4在大鼠和小鼠肾小球、足细胞和肾小管细胞中大量表达。通常情况下,NOX4和跨膜亚基(p22phox)结合形成活性复合物,才会发挥其生物学功能[17]。NOX4上调与暴露于HG的系膜细胞和管状细胞中FN和TGF-β1升高有关[18]。NOX4与成纤维细胞中TGF-β1诱导的ECM积累有关,有助于其分化为纤维化的成纤维细胞表型。NOX4被证明介导血管紧张素Ⅱ治疗下的系膜肥大的增加,以及FN升高[19]。过多OS和ECM积聚可能导致肾损伤,并被认为是DN发生的重要原因。为了探讨OS、ECM积聚和NOX之间关系,使用Western blot和qRT-PCR实验DN中高表达的NOX4亚型的蛋白和mRNA水平。研究表明,消除NOX4活性会导致HG诱导的GMCs中OS和ECM降低[24]。本实验结果与之前研究一致,HG通过上调NOX4和p22phox的mRNA和蛋白表达,刺激GMCs中ROS、TGF-β1和Col IV生成[20]。使用KAE以及沉默NOX4和p22phox,可以抑制OS和ECM积累,表明KAE发挥抗氧化作用是通过NOX4/p22phox途径调控。
Sestrins家庭是由一组参与细胞内稳定性调节的压力诱导蛋白组成,是抗氧化防御机制之一,具有两种不同的生物学活性功能。首先,通过抑制ROS积累发挥抗氧化剂作用[7],可能涉及抗氧化剂转录因子调节。其次,Sestrins通过激活AMPK或抑制Rag GTPases充当mTORC1的反馈抑制剂[5]。AMPK是一种重要的代谢传感器,在几乎所有真核细胞中广泛表达[4]。研究表明,在HG条件下,Sestrin2和AMPK激活抑制GMCs中NOX4诱导的ROS积累[6]。AMPK磷酸化抑制人系膜细胞中ROS产生和ECM积累[14]。此外,AMPK磷酸化可以抑制TGF-β1在尿液中积累,抑制系膜基质扩张,减少DN小鼠模型中胶原沉积[21]。越来越多研究认为AMPK与DN中NOX活性密切相关。在本实验中,我们发现KAE通过上调AMPK显著抑制HG诱导的细胞增殖、ROS产生、NOX4、TGF-β1和Col IV表达。此外,compound C逆转KAE对HG诱导的OS保护作用和ECM在GMCs中沉积。
综上所述,本研究证明KAE通过调节AMPK/NOX4通路,对HG诱导的GMCs OS和ECM积累发挥保护作用,期望KAE可以作为防治DN的潜在候选药物或先导化合物。
