含氨基酸的LCST型离子液体-水混合体系的相行为研究
2021-08-07张莉莉聂芳红
李 艳,张莉莉,聂芳红,高 静,2*
1广东海洋大学食品科技学院,湛江 524088;2广东药科大学食品科学学院,中山 528458
液-液萃取是一种利用溶质在液体各相中的溶解度差异而分离的常用技术,已广泛用于提取有机化合物、药物成分、氨基酸等物质[1-3]。然而,传统萃取体系往往含有乙二醇、n-甲基吡咯烷酮、n-甲酰吗啉等易燃、易挥发、有毒和回收能耗高的有机试剂[1]。因此,构建环境友好的液-液萃取体系替代有机溶剂已成为萃取研究领域的发展趋势。
离子液体(ionic liquid,IL)是一种由有机阳离子和有机或无机阴离子组成的低温液态盐[4]。近年来,离子液体因其高溶解能力、高热稳定和化学稳定、低蒸气压和结构可调性在天然产物提取中显示出广泛的应用前景。Lee等[5]向40 mL丙酮中加入10 mg 1-乙基-3-甲基咪唑溴作提取助剂,使三疣梭子蟹虾青素的提取量增加了近9倍。离子液体作为有机溶剂的助剂能显著提高生物分子的萃取率,但这些研究仍具有局限并依赖于大量使用有机溶剂。另一方面,离子液体自身黏度大,单独使用不利于传质,极大地限制了其在萃取领域中的应用。研究表明,向离子液体中添加少量水分,可有效降低离子液体的黏度,并且发挥离子液体的理化性能[6]。更重要的是,向离子液体中加入一定量的水,可以有效减少离子液体用量,降低成本。
尽管如此,萃取研究中经常使用的离子液体亲水性较强,往往与水形成均相体系,在选择性提取生物分子仍具有局限性。2017年,Shi等[7]用1-乙基-3-甲基咪唑溴/甲醇-正己烷制备的两相体系,实现了磷脂酰丝氨酸和磷脂酰胆碱的有效分离。离子液体-水混合体系在特定条件下产生液-液相分离,不仅能显著提高对生物分子的选择性萃取,且利于保持生物分子的活性[8]。因此,以疏水性较强的离子液体和水为主要成分构建新的液-液相平衡体系,对选择性提取生物分子具有重要的指导意义。研究表明,能够使离子液体-水混合体系成相的离子液体种类有1-丁基-3-甲基咪唑六氟硼酸盐、四丁基膦三氟乙酸盐、四丁基磷翁乙酸盐等[9,10]。这些离子液体多数带有四氟硼酸根离子[BF4]-、六氟膦酸根离子[PF6]-、双三氟甲基磺酰亚胺离子[Tf2N]-、三氟乙酸盐离子[CF3COO]-等疏水性强的阴离子。
从食品、化工再到医药领域,含离子液体的溶剂体系适于萃取的目标物质种类越来越多,涉及的研究领域也越来越广泛,其中温敏型液-液萃取体系备受关注。研究报道,部分离子液体-水混合体系呈现出温敏特性,相转变表现为具有高临界共熔温度(UCST)和低临界共熔温度(LCST)两类[9]。Wang等[11]研究表明1-己基-3-甲基咪唑四氟硼酸盐-水二元液-液萃取体系,能选择性分离菊花中的亲脂和亲水性物质。但是,以往的报道忽略了萃取目标产物作为离子液体体系参与者对相平衡的影响。
本文以氨基酸为生物分子模型,系统考察了甘氨酸、丙氨酸、赖氨酸、精氨酸和脯氨酸对[P4444]CF3COO-水和[P4448]Br-水混合体系相转变温度的影响,研究了氨基酸在两相中的分配特性随温度的变化规律,旨在为含离子液体的液-液体系的设计提供基础数据,也为离子液体在天然产物的提取和分离方面的应用提供新的思路。
1 材料与方法
1.1 材料
四丁基膦三氟乙酸盐([P4444]CF3COO)、三丁基辛基溴化膦([P4448]Br),兰州中科科特工贸有限公司;甲醇(色谱级)、甘氨酸(Gly)、丙氨酸(Ala)、赖氨酸(Lys)、精氨酸(Arg)、脯氨酸(Pro),阿拉丁试剂有限公司;所用试剂纯度均> 99%;离子液体和氨基酸结构如图1所示。

图1 离子液体和氨基酸的化学结构及摩尔质量Fig.1 Chemical structure and molar mass of ILs and amino acids studied
1.2 仪器与设备
LD-20AD凝胶渗透液相色谱仪(日本岛津公司);DNP-9025电热恒温培养箱(上海鸿都电子科技有限公司);KQ-300 超声波清洗器(昆山超声仪器有限公司);AW120电子天平(日本岛津公司)。
1.3 试验方法
1.3.1 温度-组分相图的测定
在分液漏斗中以1∶1质量比制备了一系列[P4444]CF3COO或[P4448]Br和水混合溶液,其中氨基酸的添加量是离子液体质量的0%~10%,在设定温度下于恒温培养箱中放置12 h后将上、下相完全分离后精密称取其质量,测定并计算两相中各组分(离子液体、水、氨基酸)的含量,根据相平衡后上、下相中离子液体的浓度以及相平衡温度绘制温度-组分相图[12,13]。
1.3.2 组分测定
含氨基酸的离子液体-水混合体系在一定温度下静止12 h后会形成离子液体富集相和水富集相。其中各相中水分含量的测定方法参考国家标准G 5009.3-2016。[P4444]CF3COO或[P4448]Br含量采用高效液相色谱法测定,仪器参数:色谱柱:C18、柱温:25 ℃、流动相:5%甲醇和95% 25 mmol/L磷酸盐缓冲溶液(pH=3)、流速:0.8 mL/min、检测波长:198 nm、进样量:20 μL、检测器:UV检测器。[P4444]CF3COO和[P4448]Br标准曲线见图2。氨基酸含量根据物料衡算得出。氨基酸在离子液体-水混合体系中的分配系数KAA按公式(1)计算:
(1)
其中[AA]H2O和[AA]IL分别为氨基酸在水富集相和离子液体富集相中的含量。

图2 离子液体的标准曲线Fig.2 The standard curves for ILs
1.3.3 上、下相密度测定
向质量比为1∶1的[P4444]CF3COO或[P4448]Br和水混合溶液中添加离子液体质量2%~10%的脯氨酸,在设定温度下于恒温培养箱中放置12 h。分别取上、下相溶液于10 mL容量瓶中,定容,在特定温度的恒温水浴锅中放置0.5 h后称重,各相体积对应质量的比值即为各相密度,平行测定3次并计算其相对平均偏差[14]。
1.3.4 数据处理方法
所有试验平行测定3次,计算平均值和相对平均偏差。化学结构式采用Chemdraw 16.0作图,Origin 8.0软件用于回归拟合试验数据。
2 结果与分析
2.1 氨基酸对离子液体-水混合体系相行为的影响
2.1.1 添加氨基酸前后相转变温度的变化
首先绘制[P4444]CF3COO-水和[P4448]Br-水混合体系的温度-组分相图,如图3所示。[P4444]CF3COO和[P4448]Br的水溶液均表现为LCST型相行为特征,即升高温度利于混合体系由均相转变为两相。与[P4444]+比较,[P4448]+具有更长的碳链,且摩尔体积更大,表现出更强的疏水特性。研究表明,同时含较多疏水阳离子和较少疏水阴离子的离子液体与水混溶后,表现出更强的LCST型相行为特征[10]。与CF3COO-比较,Br-的氢键相互作用能小,从水中接收质子的能力强,具有更强的亲水性[15]。所以,[P4448]Br-H2O混合体系的相转变温度比[P4444]CF3COO-H2O的低,其成相能更强。
向[P4444]CF3COO-水和[P4448]Br-水加入5%的脯氨酸,重新测定相图。从图3中可以看出,5%脯氨酸的加入使两个体系的相变温度均有所下降,表现为相图中两相区域面积增加。例如,当[P4444]CF3COOwt%=15%时,加入5%脯氨酸使[P4444]CF3COO-水体系相变温度由38 ℃下降至35 ℃。根据“盐析效应”,水分子与氨基酸中的氨基和羧基形成配合物引起溶液中离子液体疏水性增强和水分子空腔表面张力增大,从而促进两相分离[16]。由此可见,氨基酸作为萃取目标分子,对液-液相平衡的影响不容忽略,应当引起萃取工艺设计的重视。
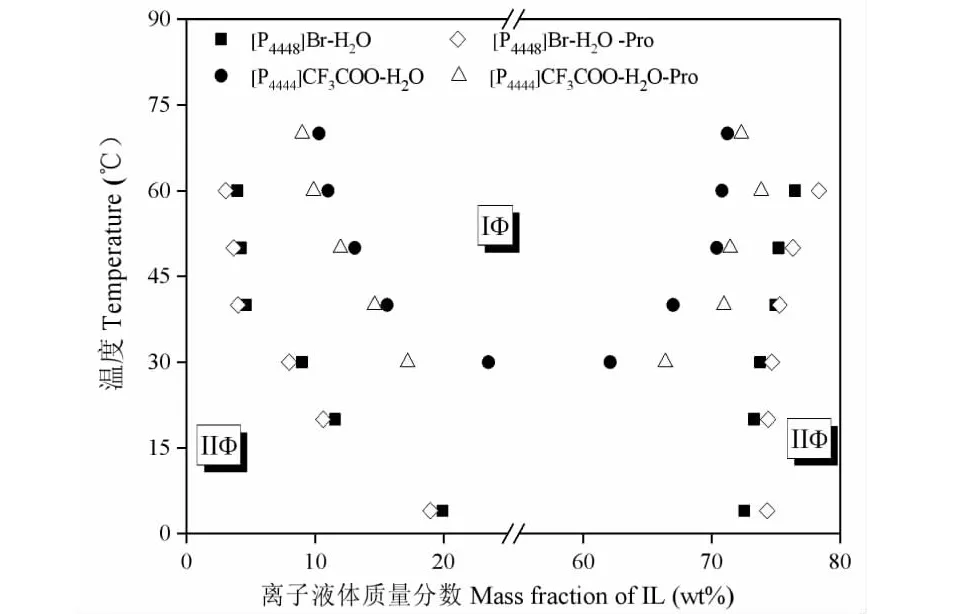
图3 添加5%脯氨酸前后的离子液体-水混合体系的温度-组分相图Fig.3 Temperature-composition phase diagrams of IL-water mixtures before and after adding 5% proline注:IΦ、IIΦ分别代表“单相区”和“多相区”。Note:IΦ and IIΦ represent “one phase” and “two phase”.
2.1.2 氨基酸种类的影响
研究发现,只有疏水性强的离子液体和亲水性好的氨基酸组合才能形成双水相,例如四丁基溴化膦和脯氨酸[17]。本研究中,向[P4444]CF3COO-水和[P4448]Br-水萃取体系逐次加入了亲水性较强的甘氨酸、丙氨酸、赖氨酸、脯氨酸和精氨酸,在一定温度范围内绘制温度-组分相图。如图4所示,5种氨基酸均可显著降低[P4444]CF3COO-水和[P4448]Br-水体系的相转变温度,即添加亲水性氨基酸利于LCST型离子液体-水体系形成两相,促进能力依次是:甘氨酸 > 丙氨酸 > 赖氨酸 > 脯氨酸 > 精氨酸。这与氨基酸对离子液体-盐双水相体系的影响规律十分相近,如氨基酸对1-丁基-3-甲基咪唑四氟硼酸盐/柠檬酸钠双水相的成相促进趋势为:甘氨酸>丙氨酸≈赖氨酸>脯氨酸≈精氨酸[18]。氨基酸侧链越短,亲水性越强,越有利于离子液体从水中“析出”[16]。

图4 含5%氨基酸的离子液体-水混合体系的温度-组分相图Fig.4 Temperature-composition phase diagrams of IL-water mixtures containing 5% amino acids注:A.[P4444]CF3COO-水;B.[P4448]Br-水。Note:A.[P4444]CF3COO-water;B.[P4448]Br-water.
另外,与碱性氨基酸比较,中性氨基酸对相变温度的影响更显著。例如,离子液体质量分数均为11%时,加入5%甘氨酸使[P4444]CF3COO-水体系相变温度降低了近22 ℃,而加入5%精氨酸仅降低了4 ℃。Chen等[19]指出碱性氨基酸带正电,侧链带有可质子化的碱性基团,且精氨酸碱性最强。Capela等[17]研究发现增大pH使色氨酸在离子液体相的分配含量增加。因此,带电的氨基酸与离子液体建立了静电相互作用,且带电荷越多,静电相互作用越强,对相变温度的影响越小。
2.1.3 氨基酸浓度的影响
在一定温度范围内测定了含0%~10%脯氨酸萃取体系的温度-组分相图。根据图5可知,增加脯氨酸的浓度使萃取体系的相变温度大大降低,显著提高了离子液体-水混合体系的成相能力。例如,固定离子液体质量分数为11%,改变萃取体系中脯氨酸浓度,[P4444]CF3COO-水相变温度降低了近20 ℃,而[P4448]Br-水相变温度降低了约6 ℃。根据前面所述可知,增加氨基酸浓度使“盐析作用”加强,促使离子液体与水分离,迅速分成两相。
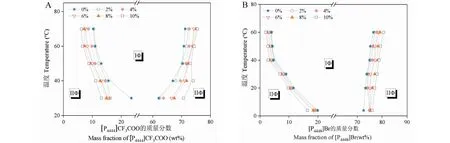
图5 含不同浓度脯氨酸的离子液体-水混合体系的温度-组分相图Fig.5 Temperature-composition phase diagrams of IL-water mixtures with different concentrations of proline注:A.[P4444]CF3COO-水;B.[P4448]Br-水。Note:A.[P4444]CF3COO-water;B.[P4448]Br-water.
为了进一步探究加入不同浓度脯氨酸后[P4444]CF3COO-水混合体系的相变规律,向体系中加入0.001 g/mL油红,于25 ℃下混匀静置12 h后对其相变现象进行了观察(见图6)。结果表明,油红主要富集在离子液体相,随着脯氨酸浓度的增加离子液体富集相由下相逐渐转移至上相,且与氨基酸的迁移方向相反。脯氨酸浓度为6.54%时,体系上、下相密度接近相等,离子液体相开始由下相转移至上相(见图6c),此时进一步增加脯氨酸可促进[P4444]CF3COO-水混合体系中离子液体向上相的迁移。前期关于离子液体-水混合体系的研究中并未发现相转变的现象[10]。为更深入了解离子液体-水混合体系相转变的原因,于25 ℃下测定了含不同浓度脯氨酸的[P4444]CF3COO-H2O混合体系各相的密度。由表1可以看出,当脯氨酸的质量分数大于5.66%,水相的密度逐渐增大并超过离子液体相,因而导致了离子液体-水混合体系上下相的交换。由此可见,选择合适的离子液体-水配制比例对提高生物分子的萃取率显得尤为重要。

图6 25 ℃下含不同浓度脯氨酸的[P4444]CF3COO-H2O混合体系的相变现象Fig.6 Phase transition of the [P4444]CF3COO-H2O mixture with different concentrations of proline at 25 ℃注:油红添加量为0.001 g/mL,集中在离子液体相;a~f分别对应表1中的a~f中混合体系的组成。Note:the added amount of oil red was 0.001 g/mL,which concentrated in ionic liquid phase;a-f corresponds to the composition of the mixtures in a-f in Table 1.
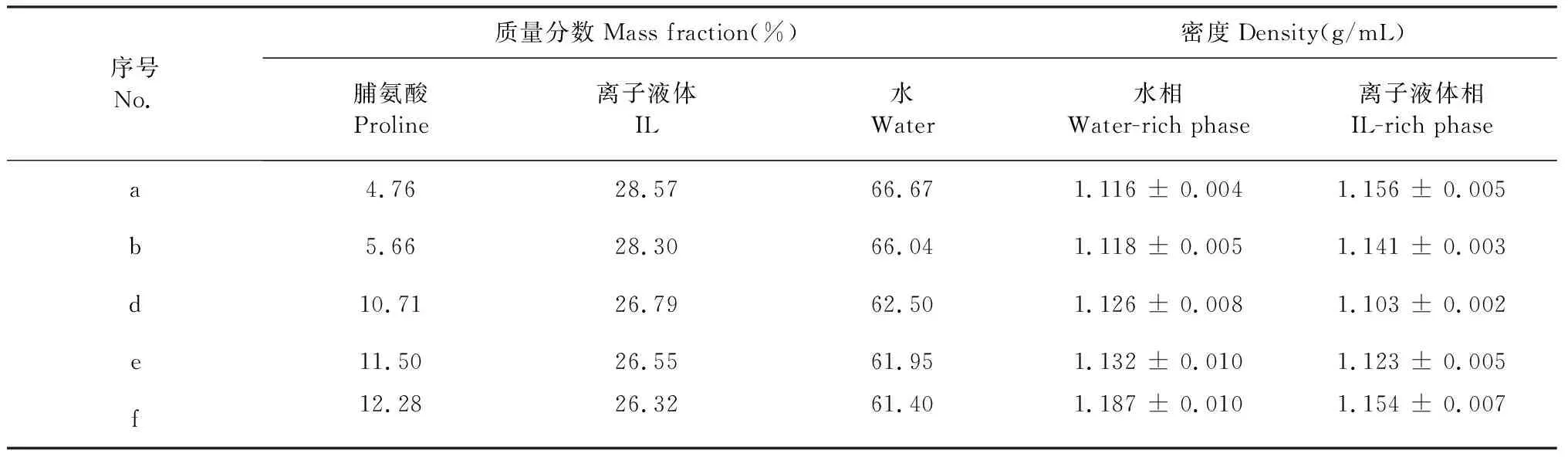
表1 25 ℃下含不同浓度脯氨酸的[P4444]CF3COO-水混合体系的各相密度
2.1.4 温度的影响
研究指出,四丁基膦对甲苯磺酸盐-水([P4444][TsO]-水)体系相变温度约为53 ℃,四丁基膦-5-苯基四唑-水([P4444][Ph-tet]-水)约为37 ℃,四丁基膦水杨酸-水([P4444][Sal]-水)约为26 ℃[10,20]。相对而言,[P4444]CF3COO-水(30 ℃)和[P4448]Br-水(4 ℃)混合体系具有较低相转变温度(见图3)。为研究温度对LCST型离子液体-水混合体系相转变的影响,观察了不同温度下含5%氨基酸的离子液体-水混合体系的相行为。从图7可以看出,温度升至40 ℃后,所有含氨基酸的离子液体-水萃取体系的上、下相均发生了置换。该体系的各相密度随温度变化的结果与宏观现象一致,即升温使[P4444]CF3COO-水体系的水相密度逐渐增大,而离子液体相密度逐渐减小。当温度达到30 ℃后,水相密度大于离子液体相(表2),因此宏观上表现为离子液体相由下相转移至上相。[P4448]Br-水体系也呈现出类似的变化规律。由此可知,向离子液体-水混合体系加入氨基酸后引起各相溶液密度变化,从而导致上、下相物质交换。需要补充说明的是,50 ℃下[P4444]CF3COO-水-脯氨酸体系在静置12 h后并未呈现出理想的相分离状态,而是表现为上、下相交换的过渡状态。以上这些现象都证明,这种由温度引起的各相物质迁移对萃取体系的工艺设计具有十分重要的参考价值。

图7 不同温度下离子液体-水-脯氨酸混合体系的相变现象Fig.7 Phase transition of IL-water-proline mixtures at different temperatures注:A.[P4444]CF3COO-水-脯氨酸;B.[P4448]Br-水-脯氨酸。Note:A.[P4444]CF3COO-water-Pro;B.[P4448]Br-water-Pro.

表2 不同温度下含脯氨酸的离子液体-水混合体系的密度
2.2 氨基酸在LCST型离子液体-水混合体系中的分配规律
2.2.1 氨基酸在两相中的分布
为了考察氨基酸在离子液体-水两相体系中的分配情况,测定了不同温度下5种氨基酸分别在离子液体相和水相中的浓度。如图8所示,[P4444]CF3COO-水体系中水相氨基酸浓度远大于离子液体相,且随温度升高氨基酸浓度逐渐增大,如温度升高,甘氨酸浓度从4.58%增至6.76%。当升温至40 ℃后,[P4444]CF3COO-水混合体系中的各类氨基酸随水逐渐迁移至下相,这是因为,升温使水极性增强,从而提高氨基酸溶解度[3]。[P4448]Br-水体系中,在30 ℃~60 ℃温度范围内,所有富氨基酸的水相均已转移至下层,这种差异源于[P4448]Br(Mw: 339.33)分子量小,而[P4444]CF3COO-水离子液体相密度大。
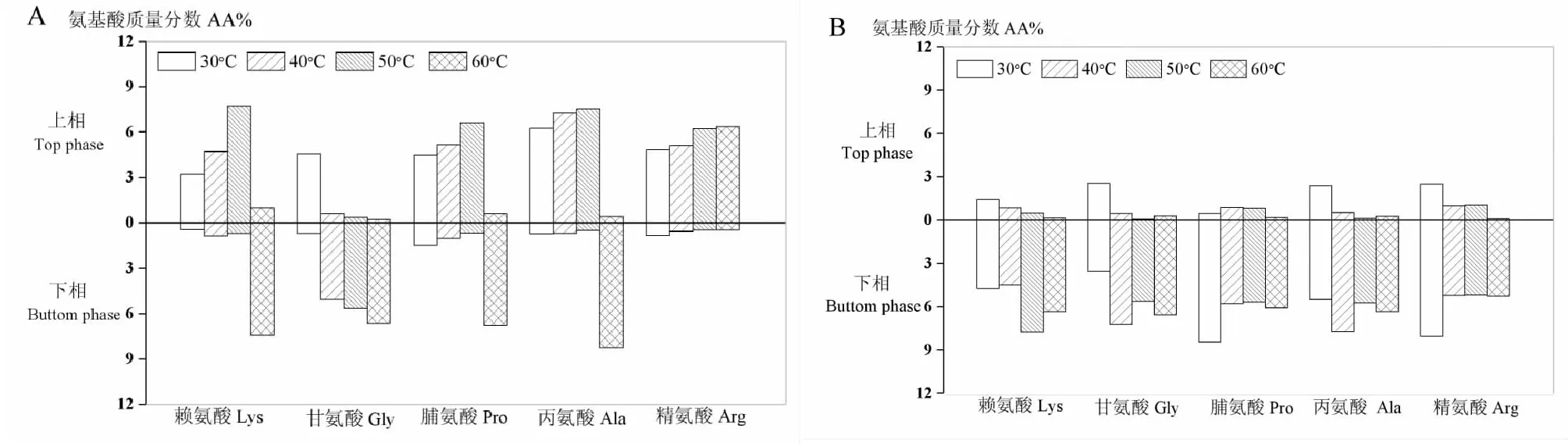
图8 不同温度下氨基酸在离子液体-水混合体系中各相的含量Fig.8 Distribution of amino acids in the IL-water mixtures at different temperatures注:A.[P4444]CF3COO-水;B.[P4448]Br-水。Note:A.[P4444]CF3COO-water;B.[P4448]Br-water.
2.2.2 氨基酸的分配系数
分配系数可用于表示物质对两种溶剂的亲和性的差异,通常分配系数大于1表明两相的疏水性差异利于目标提取物的分离[21]。Nazem等[22]发现在1-丁基-3-甲基咪唑双(三氟甲基磺酰)亚胺-水混合体系中,谷氨酸主要转移到水相,色氨酸主要转移到离子液相。这是因为谷氨酸两个羧基与水的作用比离子液体强得多,而色氨酸的非苯环极性结构与离子液体阴、阳离子间的静电相互作用使其更倾向于离子液体相。如图9所示,氨基酸在离子液体-水萃取体系中的分配系数KAA均大于1,表明5种氨基酸与水的相容性更好。另一方面,5种氨基酸的KAA均随温度升高而增大。升温一方面通过增强水的极性提高了氨基酸在水相的溶解度,另一方面通过增强“盐析效应”削弱离子液体-水间的氢键作用,从而促进离子液体相中的氨基酸向水相迁移[16]。因此,氨基酸在离子液体-水混合体系中分配与其结构密切相关,亲水性强的氨基酸更倾向于溶解在水相中(如脂肪族氨基酸),而含疏水基团较多的氨基酸则更易与离子液体阴、阳离子发生静电相互作用(如色氨酸)。
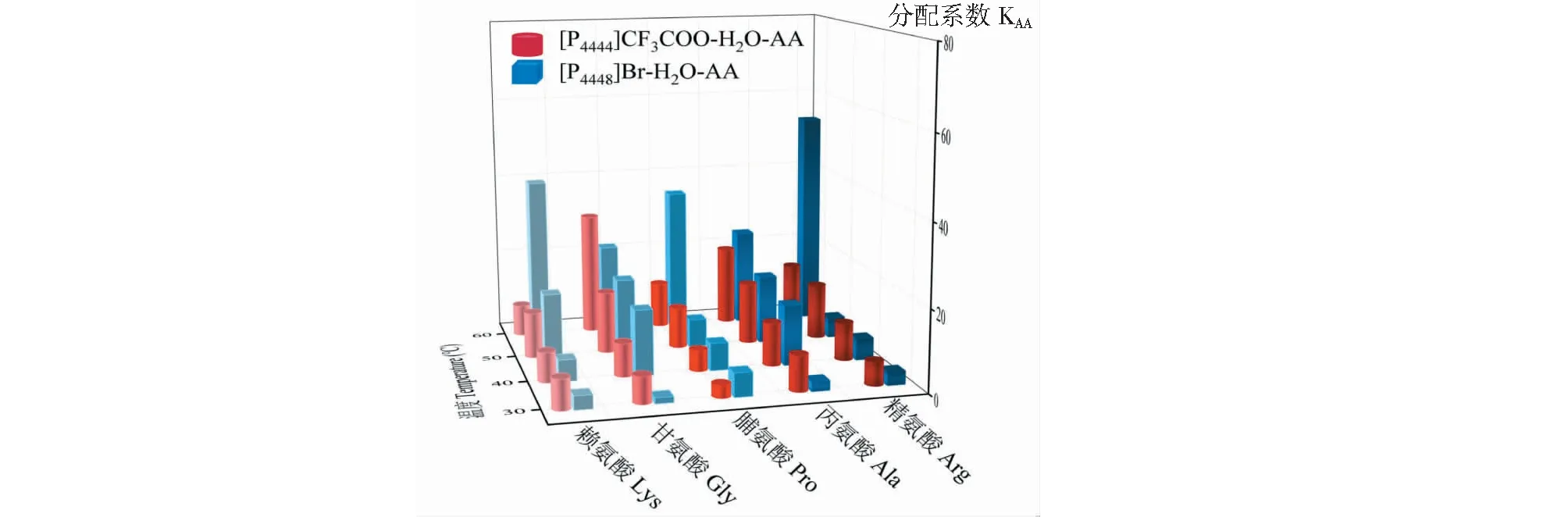
图9 不同温度下氨基酸在离子液体-水混合体系中的分配系数Fig.9 Distribution coefficients of amino acids in ionic liquid-water binary systems at different temperatures
2.2.3 氨基酸转移的标准摩尔热力学参数
温度对氨基酸在离子液体-水混合体系中分配系数具有显著影响。为了解氨基酸在离子液体-水两相间迁移的热力学过程,根据范霍夫方法计算了氨基酸在离子液体-水混合体系间的标准摩尔吉布斯能(△trG0m)、标准摩尔转移焓(△trH0m)和标准摩尔转移熵(△trS0m),根据公式(2)~(4)进行计算[23]:
(2)
(3)
(4)
式中,KAA为氨基酸分配系数,T为温度(K),R是通用气体常数(8.314 J/mol/K),△trG0m为标准摩尔吉布斯能(kJ/mol),△trH0m为标准摩尔转移焓(kJ/mol),△trS0m标准摩尔转移熵(J/mol/K)。
表3中列出了303.15K下氨基酸在离子液体-水混合体系中的△trG0m、△trH0m和△trS0m。所有研究的体系中,△trG0m< 0且KAA> 1,表明氨基酸自发、优先分配于水相[24]。利用公式(2)对303.15 ~343.1 K温度范围内的ln(KAA)和1/T进行了拟合,结果所研究氨基酸的ln(KAA)与1/T呈现较好的线性关系,表明了氨基酸的△trH0m变化与温度无关[23]。另外,焓变△trH0m< 0说明氨基酸从离子液体相向水相转移是一个放热过程,进一步反映了氨基酸与水的相互作用[25]。所有体系中,△trS0m> 0表明升温使体系无序性增强,氨基酸在两相间的迁移过程是一个熵增的过程[19]。由表3可知,△trH0m< 0,△trS0m> 0且△trH0m与T×△trS0m的值接近,所以氨基酸从离子液体相向水相转移过程是由焓和熵共同驱动的[23]。

表3 30 ℃下氨基酸在离子液体-水混合体系中标准摩尔热力学参数
3 结论
本文考察了氨基酸对LCST型[P4444]CF3COO-水和[P4448]Br-水混合体系相行为的影响规律。氨基酸与水的相互作用强烈,形成了与离子液体之间争夺水分子的竞争关系,通过“盐析效应”增强LCST型离子液体-水体系的成相能力,其促进作用趋势为:甘氨酸 > 丙氨酸 > 赖氨酸 > 脯氨酸 > 精氨酸。此外,氨基酸主要分布在水相,随着氨基酸添加量增加或温度的升高,离子液体富集相和水富集相发生空间位置转换,并且这种上、下相成分的置换是可逆的,是由焓和熵共同驱动的自发反应过程。氨基酸是离子液体-水体系良好的成相助剂,未来可以利用氨基酸的亲水性差异,设计理想的液-液萃取体系实现生物分子的选择性萃取。
