外源钙及其抑制剂对蝴蝶兰幼苗耐热性的影响
2021-08-06杨华庚杨毅敏
杨华庚 杨毅敏
摘 要:为探讨Ca2+信号参与调节蝴蝶兰耐热性形成的生理机制,采用适宜浓度的外源Ca2+(CaCl2)、胞外Ca2+螯合剂(EGTA)和质膜Ca2+通道抑制剂(LaCl3)溶液喷施蝴蝶兰幼苗植株,以喷施蒸馏水为对照,测定高温胁迫下蝴蝶兰幼苗植株的抗氧化酶活性、丙二醛、渗透调节物质和光合色素含量的变化。结果表明,与对照相比,CaCl2处理能显著增强超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性,增加脯氨酸、可溶性蛋白、可溶性糖、叶绿素和类胡萝卜素含量,显著降低丙二醛含量,减轻了蝴蝶兰幼苗的高温伤害,而LaCl3和EGTA处理不同程度地降低SOD、POD和CAT活性,降低脯氨酸、可溶性蛋白、可溶性糖、叶绿素和类胡萝卜素含量,显著增加丙二醛含量,使蝴蝶兰幼苗受害加重。由此认为,Ca2+信号可通过参与抗氧化酶活性、脯氨酸和光合色素的代谢过程来调控蝴蝶兰幼苗耐热性的形成。
关键词:蝴蝶兰;钙离子信号;耐热性;生理机制
Abstract: The objective of the study is to explore the underlying physiological mechanism of Ca2+ signal participating in the enhancement of Phalaenopsis heat tolerance. The seedlings of Phalaenopsis were sprayed appropriate concentration of exogenous calcium (Ca2+), extracellular Ca2+ chelator (EGTA) and plasma membrane Ca2+ channel inhibitor (LaCl3) respectively, taking distilled water as the control. The effects of antioxidant enzyme activity, malondialdehyde (MDA), osmotic regulators and photosynthetic pigment contents in Phalaenopsis leaves under high temperature stress were investigated. The results showed that SOD, POD and CAT activities, proline, soluble sugar, soluble protein, total chlorophyll and carotenoids contents were significantly increased and MDA content was significantly reduced in the CaCl2 treatment group, stress damages in Phalaenopsis seedlings caused by high temperature were alleviated. while the activities of three antioxidant enzymes and contents of three osmoregulation substances and contents of two photosynthetic pigments mentioned above were decreased to different extents and MDA content was significantly improved in LaCl3 and EGTA treatments group compared with the control group, thereby aggravating the damage of high temperature stress in Phalaenopsis seedlings. The study showed that Ca2+ signaling could improve the resistance of Phalaenopsis seedlings to high temperature stress by participating in antioxidant enzyme activity, proline and photosynthetic pigment metabolism processes.
Keywords: Phalaenopsis; Ca2+ signal; heat tolerance; physiological mechanism
蝴蝶兰(Phalaenopsis ssp.)是具有较高观赏性和商业价值的热带附生兰花。其生长发育对高温敏感,易受高温的抑制和危害,不利于蝴蝶兰植株的正常生长发育。因此,应用外源Ca2+等生长调节物质提高蝴蝶兰耐热性对蝴蝶兰抗热性栽培具有重要的生产意义。Ca2+是植物体生长发育的必需营养元素,不仅可作为细胞壁的結构成分、生物膜的稳定剂和多种酶的活化剂影响植物的生长发育过程,而且还作为偶联胞外信号与胞内生理生化反应的第二信使,参与植物对高温等逆境的信号转导[1]。高温胁迫下,植物细胞内的Ca2+浓度会显著升高[2-3],而形成的胞内外Ca2+浓度差会产生钙信号。Ca2+与其受体蛋白CaM(钙调素蛋白)结合后,能启动相关基因表达,诱导热激蛋白的合成,调节一系列的生理代谢过程来增强植物对高温的适应性[1, 4]。研究发现,外源Ca2+处理能提高菊花[5]、茄子[6]、辣椒[7-8]等植物的抗热性,而Ca2+螯合剂(EGTA)和质膜Ca2+通道阻抑剂(LaCl3)处理能不同程度地降低番茄[9]、辣椒[7]等植物的抗热性。说明Ca2+信号参与植物抗热性的调控,其作用机制可通过稳定质膜结构,维持较高Ca2+-ATP酶活性[8],参与调节热激蛋白的基因表达和热激蛋白合成[2, 10],维持较高的抗氧化酶活性和抗氧化物质含量[7, 11],促进细胞内渗透调节物质的积累[12-13],提高光合作用[12]等生理过程来增强植物的抗热性。虽然外源Ca2+处理能显著提高蝴蝶兰幼苗的耐热性[14],但目前还缺少Ca2+信号是否参与蝴蝶兰耐热性调控的相关证据。本研究采用适宜浓度的CaCl2、EGTA和LaCl3溶液喷施蝴蝶兰幼苗植株,测定高温胁迫下蝴蝶兰幼苗植株的抗氧化酶活性、丙二醛、渗透调节物质和光合色素含量的变化,初步探讨Ca2+信号是否参与蝴蝶兰耐热性的调控,为生产上应用外源Ca2+提高蝴蝶兰耐热性提供理论依据。
1 材料与方法
1.1 材料
为生长健壮,无病虫危害的4叶龄蝴蝶兰品种‘满天红(Dtps. Queen Beer ‘Red Sky)的幼苗植株,购自海南博大兰花有限公司。
1.2 方法
1.2.1 试验设计 选取高度、长势、叶色基本一致的适量幼苗植株放入温度为27 ℃(昼)/22 ℃(夜),相对湿度为65%~75%,光照强度为230 mol/(m2·s)的生物培养箱内进行预处理,期间适当浇水以保持基质湿润,5 d后取出幼苗植株进行试验处理,试验设计高温胁迫+蒸馏水(CK);高温胁迫+20 mmol/L CaCl2;高温胁迫+5 mmol/L EGTA;高温胁迫+5 mmol/L LaCl3 4个处理,每个处理9株苗,3次重复。将含0.1% Tween-80,pH 6.8的各处理溶液于傍晚时分均匀喷施于蝴蝶兰幼苗叶片的正反面,以欲滴为度,连续喷洒3 d,然后将所有处理植株置于温度为(40±1)℃、相对湿度为65%~75%、光照强度为230 mol/(m2·s)的光照培养箱内进行3 d胁迫处理,胁迫结束后立即取出植株,剪下顶端最近充分成熟的叶片,依次用自来水和蒸馏水洗净后,经干净纱布擦干,去掉叶片粗大的主脉,剪取叶样,充分混匀,用于测定相关生理指标。
1.2.2 抗氧化酶活性测定 粗酶液按文献[14]的方法进行提取。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法,参照李合生[15]的方法测定,以抑制NBT光化还原的50%为1个酶活性单位(U),以U/(g·h)表示。过氧化物酶(POD)活性采用愈创木酚法,参照郑炳松[16]的方法测定,以每分钟吸光度增加0.01为1个酶活性单位,以U/(g·min)表示。过氧化氢酶(CAT)活性采用紫外分光法,参照孔祥生等[17]的方法测定,以每分钟吸光度减少0.01为1个酶活性单位,以U/(g·min)表示。
1.2.3 丙二醛含量测定 采用硫代巴比妥酸法,参照孔祥生等[17]的方法测定。
1.2.4 渗透调节物质含量测定 脯氨酸含量采用酸性茚三酮法;可溶性蛋白含量采用考马斯亮蓝G-250染色法;可溶性糖含量采用蒽酮比色法,參照李合生[15]的方法测定。
1.2.5 光合色素含量测定 叶绿素和类胡萝卜素含量采用无水乙醇和丙酮等体积混合提取液法,参照张宪政[18]的方法测定。
1.3 数据处理
应用Excel 2003软件进行数据整理和绘图,采用SPSS 17.0软件的Duncans多重比较法进行数据差异显著性分析。
2 结果与分析
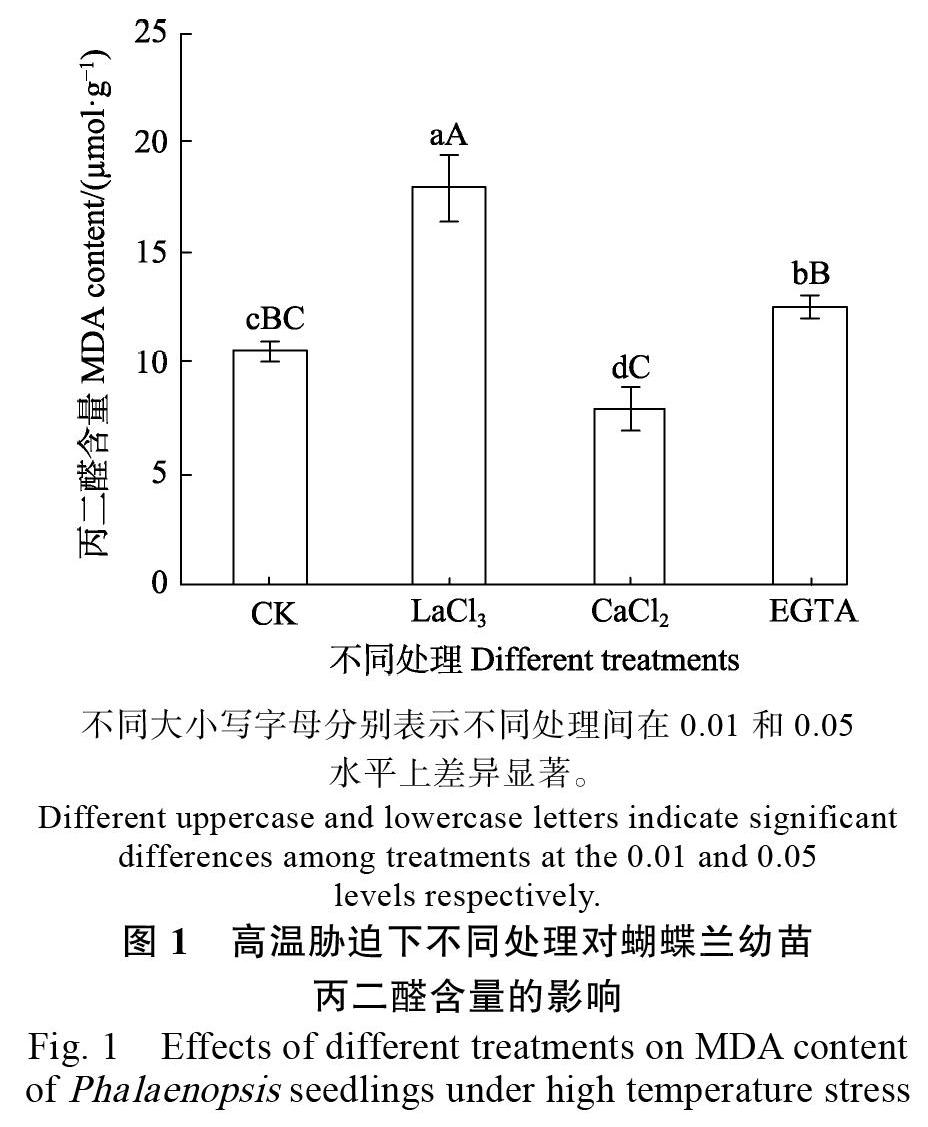
2.1 CaCl2、EGTA和LaCl3对蝴蝶兰幼苗叶片膜脂过氧化的影响
丙二醛(MDA)是细胞膜脂过氧化的主要产物之一,其含量高低能反映细胞膜脂过氧化的程度。由图1所示,CaCl2处理显著降低高温胁迫下蝴蝶兰幼苗的丙二醛含量,比对照的减少24.5%,说明Ca2+处理能减轻高温胁迫下蝴蝶兰幼苗的膜脂过氧化水平。而LaCl3和EGTA处理极显著或显著增加高温胁迫下蝴蝶兰幼苗的丙二醛含量,比对照的分别增加69.7%和19.2%。相比之下,LaCl3处理的膜脂过氧化程度比EGTA处理的更为强烈。说明LaCl3和EGTA处理加重了蝴蝶兰幼苗的膜脂过氧化伤害。
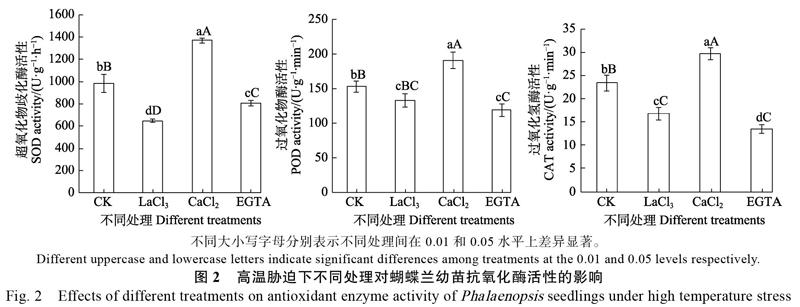
2.2 CaCl2、EGTA和LaCl3对蝴蝶兰幼苗抗氧化酶活性的影响
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是细胞内清除活性氧的重要抗氧化酶,SOD负责清除,而POD、CAT负责清除H2O2,其活性高低可反映细胞抗氧化能力的强弱。从图2可看出,高温胁迫下,CaCl2处理极显著提高蝴蝶兰幼苗叶片的SOD、POD、CAT活性,比对照的分别增加了39.0%、24.5%、26.9%,表明Ca2+处理能提高蝴蝶兰幼苗清除活性氧的能力,减轻活性氧对细胞的氧化伤害。而EGTA和LaCl3处理均会显著降低蝴蝶兰幼苗叶片的SOD、POD、CAT活性,其中,EGTA处理的SOD、POD、CAT活性分别比对照的减少18.3%、22.3%、42.2%,LaCl3处理的SOD、POD、CAT活性分别比对照的减少34.3%、12.9%、28.1%。说明EGTA和LaCl3处理明显降低蝴蝶兰幼苗的抗氧化能力,加重了高温对植株的氧化伤害。但二者的抑制效应不同,EGTA处理对CAT活性的抑制作用最强,而LaCl3处理对SOD活性的抑制作用最强。
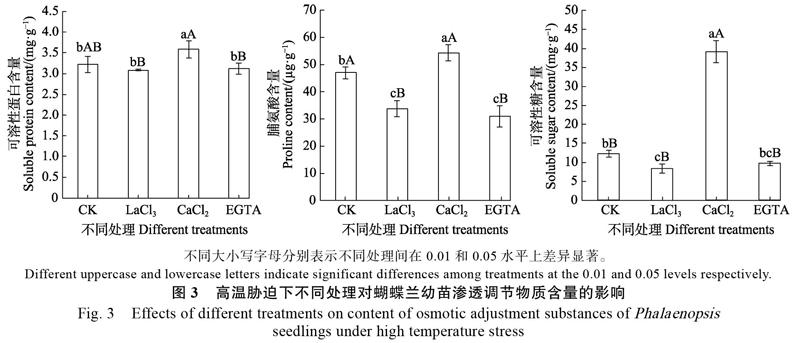
2.3 CaCl2、EGTA和LaCl3对蝴蝶兰幼苗渗透调节物质含量的影响
可溶性蛋白质、脯氨酸、可溶性糖是植物细胞内的重要渗透调节物质,能降低细胞的渗透势,有利于增强细胞的保水能力,减轻逆境对细胞的伤害。高温胁迫下,CaCl2处理显著增加蝴蝶兰幼苗叶片的可溶性蛋白质、脯氨酸、可溶性糖含量,分别比对照的增加11.3%、15.7%、218.1%。表明Ca2+处理能通过提高细胞的渗透调节能力缓解高温对蝴蝶兰幼苗的伤害。而EGTA和LaCl3处理对可溶性蛋白质、脯氨酸、可溶性糖积累的抑制效应不同。EGTA处理极显著降低脯氨酸含量,但不会显著降低可溶性蛋白和可溶性糖含量。LaCl3处理均能显著降低脯氨酸和可溶性糖含量,但不会显著降低可溶性蛋白含量(图3)。说明EGTA和LaCl3处理能减弱蝴蝶兰幼苗的渗透调节能力,使其易受高温伤害。
2.4 CaCl2、EGTA和LaCl3对蝴蝶兰幼苗光合色素含量的影响
叶绿素和类胡萝卜素是植物的2类重要光合色素,其含量多少与光能吸收密切相关,能在一定程度上反映光合作用的强弱。如图4所示,高温胁迫下,CaCl2处理的蝴蝶兰幼苗叶片的总叶绿素和类胡萝卜素含量极显著增加,分别比对照的增加101.6%和149.7%。可见,Ca2+处理可通过增加光合色素的合成来增强光合能力,提高蝴蝶兰幼苗对高温胁迫的适应性。EGTA处理极显著降低总叶绿素含量,但对类胡萝卜素的抑制作用不显著。LaCl3处理的总叶绿素和类胡萝卜素含量分别比对照的减少14.9%和27.1%,二者的下降均未达到显著差异水平。表明EGTA和LaCl3处理会抑制总叶绿素和类胡萝卜素合成,甚至促进其降解,从而降低光合能力,减弱蝴蝶兰幼苗对高温胁迫的抵御作用。
3 讨论
高温胁迫下,Ca2+处理能促使更多的胞外Ca2+通过质膜钙离子通道进入胞内,明显增加胞内的Ca2+含量[3],从而促进CaM基因表达,增加CaM蛋白含量,Ca2+与CaM结合形成钙-钙调素(Ca2+-CaM)信号系统,参与植物热激信号的转导过程[10]。研究发现,Ca2+处理明显降低高温胁迫下辣椒幼苗的质膜透性,而La3+和EGTA处理会增加辣椒幼苗的质膜透性[7]。本研究中,CaCl2处理显著降低高温胁迫下蝴蝶兰幼苗的丙二醛含量,而LaCl3和EGTA處理显著增加丙二醛含量,说明外源Ca2+能减轻高温胁迫下蝴蝶兰幼苗膜脂过氧化作用,缓解质膜系统的损伤,提高了质膜的稳定性,在一定程度上提高了蝴蝶兰幼苗的耐热性,而LaCl3和EGTA处理加剧蝴蝶兰幼苗膜脂过氧化作用,破坏质膜的完整性,降低了蝴蝶兰幼苗的耐热性。进一步证明Ca2+信号参与调控蝴蝶兰等植物的耐热性。
高温胁迫下活性氧的产生与清除失衡,引发活性氧的过量积累,从而激活SOD、POD、CAT活性,三者相互协同共同清除过量的活性氧,减轻了细胞的过氧化伤害,使质膜系统维持相对稳定性,提高了植物的抗热性[19]。SOD、POD和CAT受Ca2+-CaM信号系统的诱导和调控[6],例如,Ca2+与CaM结合能激活SOD活性[20]和CAT活性[21]。研究表明,外源Ca2+处理维持高温胁迫下玉米幼苗相对较高的SOD、CAT、抗坏血酸过氧化物酶(APX)活性,而EGTA处理能使SOD、CAT、APX快速失去活性[11];Ca2+处理能抑制高温胁迫下辣椒叶片抗氧化物质抗坏血酸(AsA)和谷胱甘肽(GSH)的氧化破坏,使其维持在相对较高的水平,而EGTA和La3+处理促使辣椒AsA和GSH含量降低[7]。本研究表明,CaCl2处理显著提高高温胁迫下蝴蝶兰幼苗的SOD、POD、CAT活性,而EGTA和LaCl3处理显著降低高温胁迫下SOD、POD、CAT活性,说明外源Ca2+处理提高了抗氧化酶系统清除蝴蝶兰幼苗活性氧的能力,明显降低细胞的膜脂过氧化伤害,增强其耐热性,而EGTA和LaCl3处理使蝴蝶兰幼苗的抗氧化酶系统受到抑制,加重了蝴蝶兰幼苗的高温伤害。表明Ca2+信号可通过参与调节抗氧化酶活性来调控蝴蝶兰耐热性的形成。
渗透调节是植物防御高温胁迫的重要机制。高温胁迫下,植物体内大量积累可溶性蛋白、可溶性糖、脯氨酸等渗透调节物质,能在一定程度上降低细胞水势,防止细胞内脱水,维持体内水分平衡,稳定细胞膜结构及其功能,提高植物对高温胁迫的适应性[22]。有研究表明,脯氨酸的积累与茄子的耐热性呈显著正相关[23]。适宜浓度CaCl2处理能促进高温胁迫下百合脯氨酸和可溶性蛋白的大量积累,而EGTA处理明显降低百合脯氨酸和可溶性蛋白含量[12]。短期热胁迫下,Ca2+处理可使番茄幼苗及其悬浮培养细胞内的脯氨酸含量增加,而EGTA或La3+处理却使脯氨酸含量下降[13]。本研究中,CaCl2处理能显著或极显著增加高温胁迫下蝴蝶兰幼苗叶片的可溶性蛋白质、脯氨酸、可溶性糖积累,而EGTA和LaCl3处理极显著降低脯氨酸含量,LaCl3处理显著降低可溶性糖含量,表明Ca2+信号主要是通过参与调节高温胁迫下蝴蝶兰幼苗脯氨酸合成和积累来缓解高温对其的伤害。高温胁迫下,CaCl2处理显著增加了蝴蝶兰幼苗叶片的可溶性蛋白含量,而EGTA和LaCl3处理不同程度地降低了可溶性蛋白含量,这可能是由于Ca2+能促进热激蛋白基因表达和热激蛋白合成,而EGTA和LaCl3却能降低热激蛋白基因表达和热激蛋白合成所致[2, 10]。热激蛋白合成,能维持蛋白质的稳态,保护细胞免受高温伤害[2]。
叶绿素是植物吸收光能的主要物质,直接影响植物光合作用的光能利用[24]。类胡萝卜素除吸收光能外,还可作为细胞内的抗氧化剂,起吸收过剩光能,猝灭活性氧,防止膜脂过氧化作用[22]。高温胁迫下,适宜浓度的Ca2+处理能减轻花生幼苗的光系统损伤,增加光合膜的稳定性[25],显著增加皖贝母叶片叶绿素和类胡萝卜素含量,明显提高光合效率[22]。研究发现,CaCl2处理能减缓高温胁迫下百合叶片的叶绿素降解,使叶绿素含量始终高于对照,而EGTA和CaM抑制剂三氟拉嗪(TFP)处理却促进叶绿素的降解,使叶绿素含量始终低于对照[12]。本研究中,CaCl2处理极显著增加了高温胁迫下蝴蝶兰幼苗叶片的叶绿素和类胡萝卜素含量,而EGTA和LaCl3处理不同程度地降低了叶绿素和类胡萝卜素含量,说明CaCl2处理提高了高温胁迫下蝴碟兰的光合能力,有利于增强蝴蝶兰幼苗对高温的适应性,而EGTA和LaCl3处理降低了光合产物的合成,减弱了蝴蝶兰幼苗对高温的耐受性。说明Ca2+信号可通过参与调节光合色素的代谢过程来调控蝴蝶兰幼苗耐热性的形成。
综上所述,本研究初步认为,Ca2+信号可通过参与调节抗氧化酶活性、脯氨酸和光合色素代谢过程来增强蝴蝶兰幼苗的耐热性。但有关Ca2+信号调控蝴蝶兰幼苗耐热性的形成机制有待于从分子机制上进一步加以揭示。
参考文献
Hashimoto K, Kudla J. Calcium decoding mechanisms in plants[J]. Biochimie, 2011, 93(12): 2054-2059.
药欣荣, 高 巍, 张金霞, 等. 高温胁迫下糙皮侧耳胞内钙离子对热激蛋白基因表达的调控[J]. 食用菌学报, 2019, 26(2): 17-23.
齐明芳, 王 丹, 齐红岩, 等. 钙处理对高温胁迫下番茄幼苗光合及钙含量的影响[J]. 沈阳农业大学学报, 2015, 46(3): 277-283.
周人纲. 热激信号转导中的钙-钙调素途径[J]. 华北农学报, 2003(S1): 24-29.
孙宪芝, 郭先锋, 郑成淑, 等. 高温胁迫下外源钙对菊花叶片光合机构与活性氧清除酶系统的影响[J]. 应用生态学报, 2008, 19(9): 1983-1988.
陈贵林, 贾开志. 钙和钙调素拮抗剂对高温胁迫下茄子幼苗抗氧化系统的影响[J]. 中国农业科学, 2005, 38(1): 197-202.
张宗申, 利容千, 王建波. 外源Ca2+、La3+和EGTA处理对辣椒叶片热激反应的影响[J]. 武汉大学学报(自然科学版), 2000, 46(2): 253-256.
张宗申, 利容千, 王建波. Ca2+预处理对热胁迫下辣椒叶肉细胞中Ca2+-ATP酶活性的影响[J]. 植物生理学报, 2001, 27(6): 451-454, 546.
徐坤鹏, 齐明芳, 李天来, 等. 钙及其抑制剂对亚高温逆境条件下番茄秧苗的调控[J]. 北方园艺, 2010(6): 8-12.
李 冰, 周人纲. 钙-钙调素信号系统参与热激信号转导的研究[J]. 西北植物学报, 2004, 24(7): 1322-1328.
Gong M, Chen S N, Song Y Q, et al. Effect of calcium and calmodulin on intrinsic heat tolerance in relation to antioxidant systems in maize seedlings[J]. Australian Journal of Plant Physiology, 1997, 24(3): 371-379.
张铭顺, 吕福堂, 褚鹏飞, 等. 外源Ca2+提高百合耐热性的生理机制初探[J]. 河南农业科学, 2019, 48(2): 120-125.
De B, Bhattacharjee S, Mukherjee A K. Short term heat and cold shock induced proline accumulation in relation to calcium involvement in cultured cells and seedlings of tomato[J]. Indian Journal of Plant Physiology, 1996, 1(1): 2-35.
杨华庚, 颜速亮, 陈慧娟, 等. 高温胁迫下外源茉莉酸甲酯、钙和水杨酸对蝴蝶兰幼苗耐热性的影响[J]. 中国农学通报, 2011, 27(28): 150-157.
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
郑炳松. 现代植物生理生化研究技术[M]. 北京: 气象出版社, 2006.
孔祥生, 易现峰. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2008.
张宪政. 作物生理研究法[M]. 北京: 中国农业出版社, 1992.
李 敏, 王维华, 王 然, 等. 高温胁迫对菠菜叶片保护酶活性和膜透性的影响[J]. 园艺学报, 2004, 31(1): 99-100.
Gong M, Li Z G. Calmodulin-binding proteins from zea mays germs[J]. Phytochemistry, 1995, 40(5): 1335-1339.
Yang T, Poovaiah B W. Hydrogen peroxide homeostasis: Activation of plant catalase by calcium/calmodulin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(6): 4097-4102.
李同根, 王康才, 罗庆云, 等. Ca2+对皖贝母高溫胁迫下抗逆生理指标及光合作用的影响[J]. 植物营养与肥料学报, 2012, 18(3): 765-770.
李 威, 肖熙鸥, 吕玲玲. 高温胁迫下茄子耐热性表现及耐热指标的筛选[J]. 热带作物学报, 2015, 36(6): 1142- 146.
唐延林, 黄敬峰, 王人潮. 水稻不同发育时期高光谱与叶绿素和类胡萝卜素的变化规律[J]. 中国水稻科学, 2004, 18(1): 59-66.
宰学明, 吴国荣, 钦 佩, 等. Ca2+对花生幼苗耐热性的影响[J]. 南京林业大学学报(自然科学版), 2006, 30(3): 47-50.
责任编辑:谢龙莲
