香蕉MaWRKY1转录因子在果实和幼苗诱导抗冷性中表达分析
2021-08-06洪克前谷会陈丽
洪克前 谷会 陈丽
摘 要:为了探究香蕉MaWRKY1转录因子在抗冷诱导过程中的作用,采用外源过氧化氢(H2O2)、茉莉酸甲酯(MeJA)、水杨酸(SA)和丙烯(propylene)等处理香蕉果实,同时采用外源H2O2、MeJA和脱落酸(ABA)等处理香蕉幼苗,处理结束后,将实验材料放置于7 ℃下贮藏,通过Northern blot技术分析实验材料中MaWRKY1基因表达变化。H2O2、MeJA、SA和propylene等处理均使果实冷害症状推迟2 d出现;处理组果实中MaWRKY1 mRNA积累均早且高于对照组。H2O2、MeJA和ABA等處理也均使幼苗推迟18 h显现冷害症状;处理组幼苗中MaWRKY1基因表达提前且表达量相对较高。相比较这几种外源性调节剂,MeJA和H2O2处理的香蕉果实和幼苗所获得的抗冷效果优于其他生长调节剂,同时MaWRKY1基因表达水平也比其他处理组提前或表达量更高,推测MaWRKY1可能更加积极响应MeJA或H2O2诱导香蕉耐冷性
关键词:香蕉;WRKY1;转录因子;耐冷性
Abstract: To investigate the role of MaWRKY1 in induction of chilling resistance of the banana, fruits were treated with H2O2, MeJA, SA and propylene, respectively, and seedlings were treated with H2O2, MeJA and ABA, respectively. Following treatments, fruits and seedlings were stored at 7 ℃. Northern blot technique was adopted to analyze the changes of MaWRKY1 in fruits and seedlings inducted by chilling resistance. The results indicated that H2O2, MeJA, SA, and propylene treatments delayed the occurrence of chilling injury symptom of fruits by 2 d at 7 ℃. MaWRKY1 mRNA accumulation in the treated fruits was earlier and higher than that of the untreated. The treatment of H2O2, MeJA, and ABA retarded the occurrence of chilling injury symptom of seedlings by 18 h at 7 ℃. In addition, MaWRKY1 mRNA accumulation level was significantly earlier and higher in the treated seedlings than that of the untreated. Compared with other exogenous growth regulators, fruits and seedlings treated with MeJA, and H2O2, respectively had a better chilling resistance, and the MaWRKY1 gene expression was earlier or higher than that in other treated groups, MaWRKY1 might be more active in chilling resistance of banana fruits and seedlings inducted by MeJA or H2O2.
Keywords: banana; WRKY1; transcription factor; chilling resistance
香蕉(Musa acuminate)是世界主要水果之一,经济价值很高,也是我国华南地区北运和出口的主要水果[1-2]。香蕉是典型的呼吸跃变型果实,常温下贮藏一周左右即出现呼吸高峰,导致果实迅速成熟软化并缩短其贮藏期和货架期。低温贮藏可有效地抑制香蕉果实的成熟软化,延长其贮藏寿命,但香蕉果实对低温极其敏感,在温度低于11 ℃时,即发生冷害,严重影响果实的商品价值[3]。施用植物生长调节剂如水杨酸(SA)、茉莉酸甲酯(MeJA)、丙烯(propylene,乙烯功能类似物)、脱落酸(ABA)和过氧化氢(H2O2)等均可提高采后香蕉果实的抗冷性[4-7],其中许多基因包括MYC、bHLH、PAL、EPX和WRKY等参与了香蕉果实耐冷过程[6-9]。
抗冷反应的转录因子中,WRKY是植物特有的一类转录因子家族。自WRKY转录因子最早在甜薯中发现以来[10],目前许多WRKY转录因子家族成员从多种植物中被分离出来,如拟南芥和水稻中分别有72和109个成员被鉴定出来[11-12]。WRKY转录因子在生物胁迫中扮演着重要角色,同时在非生物耐受性包括抗冷性方面起着重要作用[13-15]。如大豆GmWRKY21和大麦TaWRKY10转录因子分别在拟南芥中超表达,提高了拟南芥植株的耐冷性[15-16],而拟南芥AtWRKY34在抗冷过程中呈现负调控作用[17]。目前,模式植物如拟南芥和水稻中有许多胁迫反应相关WRKY被鉴定和研究,而非模式植物,如蔬菜和果实中有关WRKY功能方面也有相关研究[18-20]。笔者前期研究结果表明,香蕉MaWRKY1转录因子参与了果实抗病性[21],而其在果实耐冷性中作用尚未见报道。基于此,本实验通过Northern blot技术,研究诱导香蕉果实耐冷害响应中MaWRKY1基因表达变化,以期进一步了解该基因的生理功能。
1 材料与方法
1.1 材料
供试香蕉品种为‘巴西(Musa acuminate, AAA group‘Brazil),果实和幼苗分别购自广东省番禺香蕉果园和广东省果树研究所香蕉组培中心。
1.2 方法
1.2.1 材料处理 (1)香蕉果实抗冷性处理:采收成熟度七至八成的香蕉果实,落梳后立即运回实验室。每梳香蕉分成单个蕉指后,挑选果实大小相近、无病虫害、无机械损伤的果实300个,用0.05%(W/V)施保功进行表面杀菌,冲洗干净后晾干备用,然后室温下晾30 min后装入不封口的聚乙烯塑料袋(厚度为0.04 mm)中,每袋6个,10袋一组,共5组。第1组为对照组,果实用聚乙烯塑料袋包装置于7 ℃恒温箱中贮藏。第2组至第5组为处理组,第2组、第3组和第4组处理参考Chen等[3]的方法进行,分别采用1.0 mmol/L过氧化氢(H2O2)、0.1 mmol/L茉莉酸甲酯(MeJA)和1.0 mmol/L水杨酸(SA)在0.1 MPa负压下,浸泡果实30 min。第5组处理参考Wang等[5]的方法进行,采用1000 μL/L丙烯(propylene)处理约12 h,取出后开盖暴露于空气中2 h,释放残留的丙烯,然后用聚乙烯薄膜袋包装放入7 ℃恒温箱。处理结束后,果实置室温下晾干,然后分别用聚乙烯薄膜袋包装放入7 ℃恒温箱中贮藏。上述对照和处理材料分别在贮藏0、1、3、5、7、9、11、13 d时取样。取样时将香蕉的果皮与果肉分离后分别用液氮速冻并储存于?80 ℃备用。
(2)香蕉幼苗抗冷性处理:选择香蕉幼苗高度约30~35 cm,带有6~7叶和1心,且心叶尚未展开,生长良好的植株。上述所选香蕉幼苗共200株,分成4组,每组50株。第1组为对照组,采用蒸馏水对幼苗进行叶面喷施;第2组分别采用1.0 mmol/L H2O2﹑0.1 mmol/L MeJA和0.1 mmol/L ABA对香蕉幼苗进行叶面喷施。上述2组处理完后,常温下晾干,然后放置在7 ℃恒温箱中。分别在贮藏0、2﹑6﹑12﹑18﹑24﹑36﹑48、60 h时取样,取样时选取香蕉幼苗心叶下的第1叶,用液氮速冻并储存于?80 ℃备用。
1.2.2 冷害指数测定 香蕉果实冷害指数测定参照Jiang等[22]的方法,按照香蕉果实遭受冷害严重程度分为5级。0级为果皮全为绿色或成熟时为黄色;2级为果皮稍显灰色;3级为出现轻微的褐色凹陷小斑点(面积<0.3 cm2);4级为出现中度褐色凹陷斑点(面积0.3~0.8 cm2);5级为出现严重褐色凹陷斑点(面积>0.8 cm2)。统计9个蕉指,冷害指数=Σ(冷害级别×该级别果数所占比例)。
香蕉幼苗冷害指数测定参照韩冬芳[23]的方法,按照香蕉幼苗遭受冷害严重程度分为5级进行测定。0级为叶色正常,叶片无冷害症状;1级为冷害轻度,叶片冷害部分仅限于叶缘,冷害面积小于整个叶面积的5%;2级为冷害中度,叶片冷害部分较少,冷害面积小于整个叶面积的40%;3级为冷害严重,叶片冷害部分较多,冷害面积小于整个叶面积的70%;4级为冷害极严重,冷害面积大于整个叶面积的70%,或整片枯死。统计9盆香蕉苗,冷害指数=Σ(冷害级别×该级别果数所占比例)。
1.2.3 总RNA提取 香蕉果皮(肉)及幼苗组织中总RNA的提取方法为热硼酸法,参照Wan等[24]的方法进行。
1.2.4 RNA印迹 取香蕉果皮(肉)及幼苗组织总RNA约10 g,在琼脂糖凝胶(含1.2%甲醛)上进行变性凝胶电泳。电泳后的凝胶放置2×SSC的溶液中浸洗2次,每次20 min。浸洗结束后,采用上行毛细管转移法将变性RNA从凝胶转移到尼龙膜(Biodyne?B 0.45 m,PALL)上,转移完成后,将尼龙膜置于恒温箱中80 ℃烘烤约2 h,最后将含有RNA尼龙膜经紫外交联后存放于4 ℃冰箱备用。
1.2.5 Northern blot Northern blot參考贺立红等[25]的方法进行,具体步骤如下:将结合有RNA的尼龙膜置于预杂交液中预杂交3 h。预杂交结束后,在杂交液中加入DIG标记的探针,于45 ℃杂交箱中杂交过夜。杂交后的尼龙膜用含有0.1% SDS的2SSC漂洗2次,每次10 min。然后再用同样浓度的SSC在62 ℃下洗2次,每次30 min,漂洗结束后用Tween-20洗去膜上未结合的抗体,最后通过化学发光原理检测杂交信号的强弱。
2 结果与分析
2.1 香蕉果实诱导抗冷性中冷害指数变化
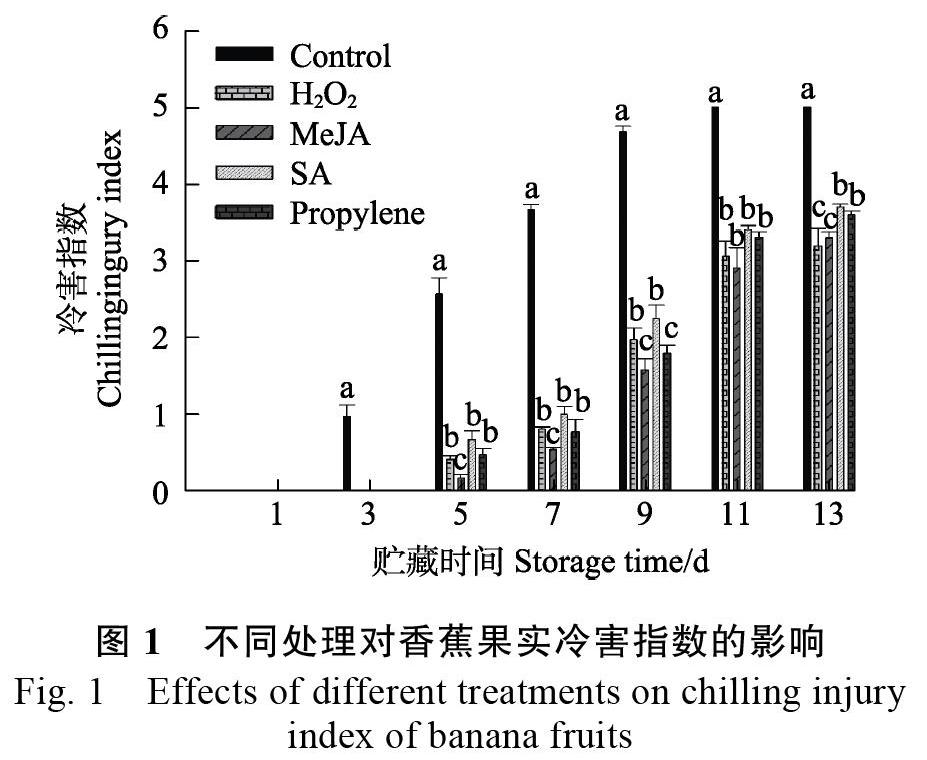
如图1所示,对照果实在7 ℃下贮藏第3天开始出现冷害症状,果皮开始变灰色或出现凹陷小斑点,冷害指数随贮藏时间增加显著上升,贮藏至第11天时达最大值即5级。H2O2、MeJA、SA和propylene等处理延缓冷害症状出现且推迟冷害指数上升,处理组果实均贮藏至第5天开始出现冷害症状,冷害指数上升较缓慢。H2O2、MeJA、SA和propylene等处理果实,贮藏至第11天时,冷害指数分别约是对照果实的60%、58%、68%和66%;经过这些外源性生长性调节剂处理,提高了果实抗冷性,延缓了冷害症状的发生,综合整个贮藏期冷害指数的变化,MeJA处理组比其他处理组抗冷效果更好。
2.2 果皮中MaWRKY1基因表达分析
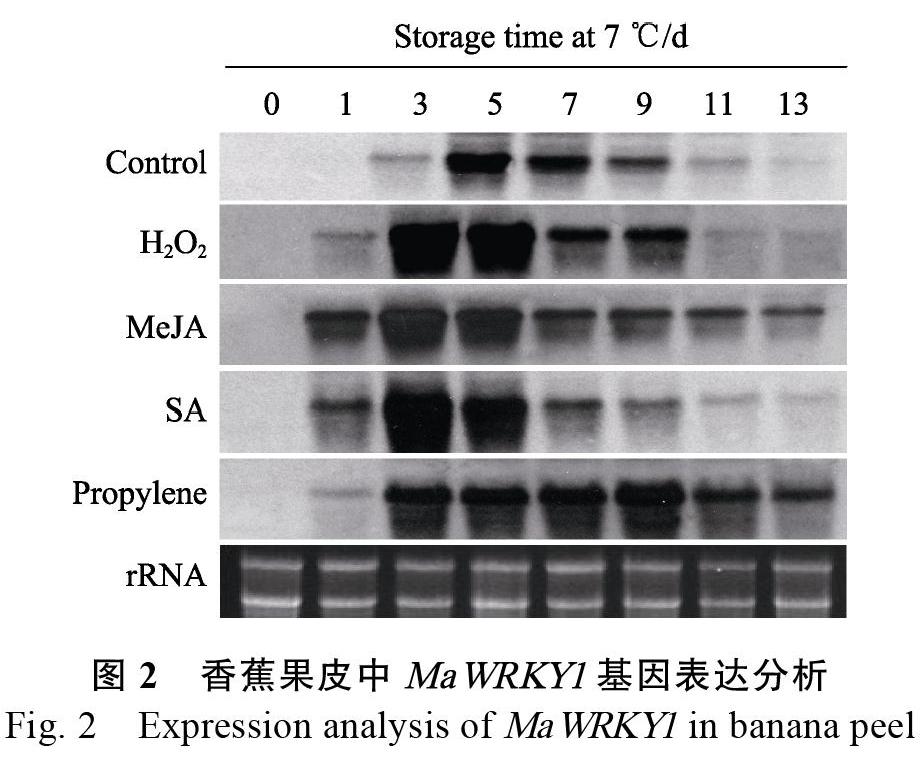
外源H2O2、MeJA、SA和propylene处理香蕉果实后置于7 ℃低温贮藏,以Northern blot检测果实中MaWRKY1基因表达。结果表明,对照组果皮第3天即有MaWRKY1基因表达,至第5天表达量最高,之后逐渐下降;H2O2、MeJA、SA和propylene等处理组果皮中,MaWRKY1第1天均被诱导表达,MeJA处理组基因表达明显高于其他处理组;处理组MaWRKY1表达量峰值均在第3天,随后呈下降模式,但在第11天和第13天,MeJA处理基因表达依然高于其他处理组(图2)。综合以上结果,与对照和其他处理组相比,MeJA处理组更能快速、持久地诱导MaWRKY1基因的表达。
2.3 果肉中MaWRKY1基因表达分析
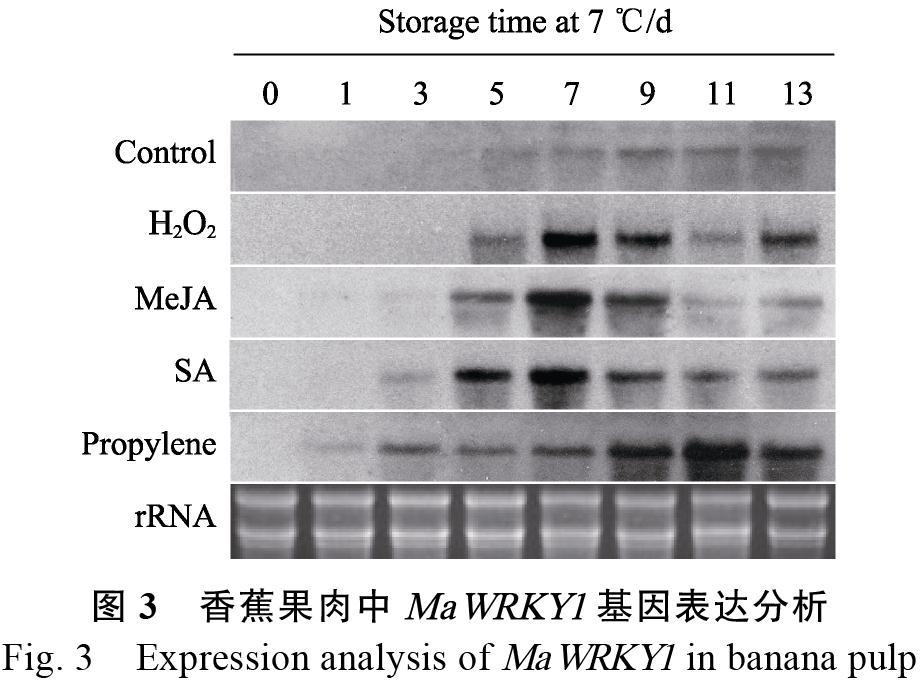
如图3所示,对照组果肉中MaWRKY1基因第5天开始表达,表达趋势较为平稳。尽管H2O2处理组与对照组相比,MaWRKY1初始表达时间基本一致,但其基因表达量明显高于对照组。MeJA、SA和propylene等处理组果肉中,MaWRKY1基因表达分别出现在第3天、第3天和第1天,明显早于对照组MaWRKY1基因表达;并且,处理组中基因表达量显著高于对照组。
2.4 香蕉幼苗诱导抗冷性中冷害指数变化
由图4可知,对照组幼苗在7 ℃低温贮藏18 h时出现冷害症状,H2O2、MeJA和ABA等处理组低温贮藏36 h时显现轻微冷害症状,冷害指数均约为0.2,而对照组冷害指数则接近0.6,差异显著。低温贮藏至60 h,对照组幼苗已死亡(冷害指数达1.0级),H2O2、MeJA和ABA等处理组冷害指数仅为0.4~0.6。经H2O2、MeJA和ABA等处理,延缓了香蕉幼苗冷害症状的出现,减轻了冷害程度的发生,相比较而言,H2O2和MeJA处理组幼苗具有较低的冷害指数,暗示这2个处理组抗冷效果较好。
2.5 香蕉幼苗组织中MaWRKY1基因表达分析
Northern-blot检测结果表明,对照叶片中MaWRKY1在7 ℃低温贮藏12 h有微弱表达,之后表达量基本恒定,低溫贮藏48 h表达量达到峰值,随后其表达量下降。外源H2O2、MeJA和ABA处理组叶片中MaWRKY1在低温贮藏2 h均有表达,低温贮藏18、24、24 h,其表达量开始逐渐升高,低温贮藏48 h表达量均达到峰值(图5);与对照相比,H2O2等处理组MaWRKY1基因表达提前,且表达量显著增加。说明在外源H2O2、MeJA和ABA处理提高香蕉叶片抗冷性过程中,诱导了MaWRKY1表达。
3 讨论
采后香蕉果实对低温敏感,容易遭受冷害,严重制约果实的贮藏、运输和销售等。植物生长调节剂包括过氧化氢(H2O2)、茉莉酸甲酯(MeJA)、水杨酸(SA)、和丙烯(propylene,乙烯类似物)等在香蕉果实抗冷性方面发挥重要作用[4-5]。本实验中未经处理的对照组果实放置在7 ℃下贮藏,第3天出现冷害症状,经H2O2、MeJA、SA和丙烯等处理的果实均比对照组推迟2 d出现冷害症状。庞学群等[4]报道,采用外源H2O2、SA和MeJA等处理香蕉果实放置7 ℃下贮藏,对照果实也是贮藏第3天出现冷害症状,但处理组比对照果实延缓2~5 d出现冷害症状。Wang等[5]报道丙烯处理香蕉果实放置7 ℃下贮藏,对照果实第4天出现冷害症状,处理比对照果实延缓3 d出现冷害症状。本研究采用H2O2、MeJA、SA和丙烯等处理香蕉果实,诱导果实抗冷性效果与庞学群等[4]和Wang等[5]报道的并非完全一致。笔者分析认为,可能香蕉果实成熟度、产地、采收季节和采前管理措施等因素不同,导致不同研究者所得结果稍有不同。但本研究与庞学群等[4]和Wang等[5]所得结果也有相同点,即H2O2、SA、丙烯和MeJA等处理香蕉果实均延缓了冷害症状的出现,提高了果实的抗冷性。
为了应对低温,植物进化出复杂的生理和生物化学机制以适应低温胁迫,在分子水平上诱导胁迫响应基因包括低温调节基因和低温功能基因的表达[26]。转录因子作为一种重要的调节基因,在响应胁迫信号和调节功能基因的表达方面发挥重要作用[27]。诱导基因转录是植物对低温胁迫的反应,目前已从香蕉果实鉴定出多个响应低温诱导WRKY转录因子,其中包括MaWRKY11[2]、MaWRKY26[28]和MaWRKY31、MaWRKY33、MaWRKY60、MaWRKY71[7]。本研究中,7 ℃下贮藏,幼嫩的香蕉叶片中MaWRKY1转录因子mRNA积累在贮藏12 h便显现出来,果皮中MaWRKY1 mRNA积累在第3天开始显现,果肉中mRNA积累稍慢,在贮藏5 d时开始出现。表明MaWRKY1响应了低温胁迫,但不同组织对低温响应所需时间不同,呈诱导型表达;同时该研究拓展了MaWRKY家族响应低温的新成员。
WRKY转录因子在植物应答逆境胁迫中发挥重要作用,很多WRKY转录因子能被逆境信号诱导表达,参与多种信号途径的传导,其中包括JA、SA、ABA和ET等信号通路[29]。因此,WRKY转录因子受多种植物生长调节剂调控,包括MeJA、SA、乙烯和ABA[6]。逆境胁迫所激活激素信号途径,相关基因表达水平进而发生变化。例如,拟南芥AtWRKY70转录因子参与抗病中可以分别被外源SA和JA诱导和抑制[30],烟草NtWRKY4在抗烟草花叶病毒中被SA诱导表达[31]。MeJA作为JA的甲酯衍生物,参与植物信号转导途径,调节低温胁迫防御反应,从而提高植物对低温的耐受性[32]。施用外源MeJA能提高多种果蔬的耐冷性和减轻冷害的发生率[28, 33]。
本研究中,H2O2、MeJA和SA等诱导香蕉果实耐冷性过程中,MaWRKY1转录因子呈现类似的表达模式,这些信号分子均使MaWRKY1表达提前且表达量显著上调,果皮和果肉中MaWRKY1基因表达峰值均在第3天和第7天出现;但香蕉幼苗中MaWRKY1响应H2O2和MeJA诱导模式不同,前者中MaWRKY1表达时间更早且表达量(贮藏36 h前)明显高于后者。MaWRKY1响应ET诱导香蕉果实耐冷性过程中,尽管贮藏第5天处理组果皮中MaWRKY1基因表达稍微低于对照,但其他时间点前者基因表达量明显高于后者,推测MaWRKY1作为转录因子,主要在贮藏前期(第3天前)通过高量表达,调节抗冷相关基因,进而提高香蕉耐冷性。
ABA作为一种重要的植物生长调节剂,调控WRKY转录因子参与的抗逆反应。如小麦中的TaWRKY1和TaWRKY33转录因子参与了ABA诱导的耐旱性[34];香蕉MaWRKY31、MaWRKY33、MaWRKY60和MaWRKY71等转录因子在ABA调控果实抗冷性中具有重要作用[7]。本研究中,ABA处理减轻香蕉幼苗冷害发生的同时,诱导了MaWRKY1基因表达量增加,可能MaWRKY1参与了ABA诱导的幼苗耐冷性。
综上所述,外源H2O2、MeJA、SA、ABA和propylene等诱导了香蕉耐冷性,这些外源生长调节剂可能通过不同的信号途径,如SA、ABA和JA/ET等激活了MaWRKY1 mRNA的积累,MaWRKY1进一步调节下游的功能基因的表达,进而提高了香蕉耐冷性;综合分析H2O2等处理对香蕉冷害指数和MaWRKY1 mRNA积累时间和量的变化模式,认为适宜浓度的外源MeJA和H2O2处理的香蕉果实和幼苗所获得的抗冷效果优于其他植物生长调节剂。但MaWRKY1如何响应低温胁迫,通过何种信号途径通路调节相应的功能基因还需要深入探讨。
参考文献
徐群刚, 邝健飞, 单 伟, 等. 香蕉果实冷胁迫相关MaWRKY11转录因子的特性、互作蛋白筛选与鉴定[J]. 热带亚热带植物学报, 2015, 23(5): 543-552.
Feng B H, Han Y C, Xiao Y Y, et al. The banana fruit Dof transcription factor MaDof23 acts as a repressor and interacts with MaERF9 in regulating ripening-related genes[J]. Journal of Experimental Botany, 2016, 67(8): 2263-2275.
Chen J Y, He L H, Jiang Y M, et al. Role of phenylalanine ammonia-lyase in heat pretreatment-induced chilling tolerance in banana fruit[J]. Physiologia Plantarum, 2008, 132(3): 318-328.
庞学群, 潘少丽, 王海波, 等. 过氧化氢在香蕉果实采后耐冷性誘导中的作用[J]. 园艺学报, 2007, 34(6): 1373- 1378.
Wang Y, Chen J Y, Jiang Y M, et al. Cloning and expression analysis of phenylalanine ammonia-lyase in relation to chilling tolerance in harvested banana fruit[J]. Postharvest Biology and Technology, 2007, 44(1): 34-41.
Zhao M L, Wang J N, Shan W, et al. Induction of jasmonate signalling regulators MaMYC2s and their physical interactions with MaICE1 in methyl jasmonate-induced chilling tolerance in banana fruit[J]. Plant Cell and Environment, 2013, 36(1): 30-51.
Luo D L, Ba L J, Shan W, et al. Involvement of WRKY transcription factors in abscisic-acid-induced cold tolerance of banana fruit[J]. Journal of Agricultural and Food Chemestry, 2017, 65(18): 3627-3635.
Wang Y, Lu W J, Jiang Y M, et al. Expression of ethylene-related expansin genes in cool-stored ripening banana fruit[J]. Plant Science, 2006, 170(5): 962-967.
Peng H H, Shan W, Kuang J F, et al. Molecular characterization of cold-responsive basic helix-loop-helix transcription factors MabHLHs that interact with MaICE1 in banana fruit[J]. Planta, 2013, 238(5): 937-953.
Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5′upstream regions of genes coding for sporamin and β-amylase from sweet potato[J]. Molecular and General Genetics, 1994, 244(6): 563-571.
Zhang Y, Wang L. The WRKY transcription factor superfamily: its origin in eukaryotes and expansion in plants[J]. BMC Evolutionary Biology, 2005, 5(1): 1-12.
Eulgem T, Somssich I E. Networks of WRKY transcription factors in defense signaling[J]. Current Opinion in Plant Biology, 2007, 10(4): 366-371.
Bakshi M, Oelm?ller R. WRKY transcription factors: Jack of many trades in plants[J]. Plant Signaling & Behaviour, 2014, 9(2): e27700.
Manerjee A, Roychoudhury A. WRKY proteins: signaling and regulation of expression during abiotic stress responses[J]. The Scientific World Journal, 2015: 807560.
Zhou Q Y, Tian A G, Zou H F, et al. Soybean WRKY-type transcription factor genes, GmWRKY13, GmWRKY21, and GmWRKY54, confer differential tolerance to abiotic stresses in transgenic Arabidopsis plants[J]. Plant Biotechnology Journal, 2008, 6(5): 486-503.
Niu C F, Wei W, Zhou Q Y, et al. Wheat WRKY genes TaWRKY2 and TaWRKY19 regulate abiotic stress tolerance in transgenic Arabidopsis plants[J]. Plant Cell & Environment, 2012, 35(6): 1156-1170.
Zou C, Jiang W, Yu D. Male gametophyte-specific WRKY34 transcription factor mediates cold sensitivity of mature pollen in Arabidopsis[J]. Journal of Experimental Botany, 2010, 61(14): 3901-3914.
Guo R R, Qiao H B, Zhao J, et al. The grape VlWRKY3 gene promotes abiotic and biotic stress tolerance in transgenic Arabidopsis thaliana[J]. Frontiers in Plant Science, 2018, 9: 545.
Liu W J, Wang Y C, Yu L, et al. MdWRKY11 participates in anthocyanin accumulation in red-fleshed apples by affecting MYB transcription factors and the photoresponse factor MdHY5[J]. Journal of Agricultural Food Chemistry, 2019, 67(32): 8794-8809.
Nan H, Gao L Z. Genome-wide analysis of WRKY genes and their response to hormone and mechanic stresses in carrot[J]. Frontiers in Genetics, 2019, 10: 363.
Tang Y, Kuang J F, Wang F Y, et al. Molecular characterization of PR and WRKY genes during SA-and MeJA-induced resistance against Colletotrichu mmusae in banana fruit[J]. Postharvest Biology and Technology, 2013, 79: 62-68.
Jiang Y M, Joyce D C, Jiang W B, et al. Effects of chilling temperatures on ethylene binding by banana fruit[J]. Plant Growth Regulation, 2004, 43(2): 109-115.
韓冬芳. 外源甜菜碱提高香蕉抗寒性的作用及其机理的研究[D]. 广州: 华南农业大学, 2007.
Wan C Y, Wilkins T A. A modified hot borate method significantly enhances the yield of high-quality RNA from cotton (Gossypium hirsutum L)[J]. Analytical Biochemistry, 1994, 223(1): 7-12.
贺立红, 陈建业, 于伟民, 等. 香蕉果实乙烯受体基因克隆及其表达特性[J]. 中国农业科学, 2009, 42(4): 1359-1364.
Knight M R, Knight H. Low-temperature perception leading to gene expression and cold tolerance in higher plants[J]. New Phytologist, 2012, 195(4): 737-751.
Gong X Q, Zhang J Y, Hu J B, et al. FcWRKY70, a WRKY protein of Fortunella crassifolia, functions in drought tolerance and modulates putrescine synthesis by regulating arginine decarboxylase gene[J]. Plant Cell & Environment, 2015, 38(11): 2248-2262.
Ye Y J, Xiao Y Y, Han Y C, et al. Banana fruit VQ motif-containing protein5 represses cold-responsive transcription factor MaWRKY26 involved in the regulation of JA biosynthetic genes[J]. Scientific Reports, 2016, 6: 23632.
Thomma B P, Eggermont K, Tierens K F, et al. Requirement of functional ethylene-insensitive 2 gene for efficient resistance of Arabidopsis to infection by Botrytis cinerea[J]. Plant Physiology, 1999, 121(4): 1093-1102.
Li J, Brader G, Palva E T. The WRKY70 transcription factor: a node of convergence for jasmonate-mediated and salicylate-mediated signals in plant defense[J]. Plant Cell, 2004, 16(2): 319-331.
Ren X J, Huang W D, Li W Z, et al. Tobacco transcription factor WRKY4 is a modulator of leaf development and disease resistance[J]. Biologia Plantarum, 2010, 54(4): 684- 690.
Creelman R A, Mullet J E. Biosynthesis and action of jasmonates in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1997, 48: 355-381.
Ding C K, Wang C Y, Gross K C, et al. Reduction of chilling injury and transcript accumulation of heat shock proteins in tomato fruit by methyl jasmonate and methyl salicylate[J]. Plant Science, 2001, 161(6): 1153-1159.
He G H, Xu J Y, Wang Y X, et al. Drought-responsive WRKY transcription factor genes TaWRKY1 and TaWRKY33 from wheat confer drought and/or heat resistance in Arabidopsis[J]. BMC Plant Biology, 2016, 16(1): 116.
责任编辑:黄东杰
