猪链球菌2型强弱毒株对BALB/c小鼠肠道菌群影响的差异
2021-08-06王小敏王俣棋
许 格,王小敏,王俣棋,徐 鹏
猪链球菌(Streptococcussuis,SS)是养猪业中最常见的病原菌之一,对养猪业的健康发展造成了极大的危害。猪链球菌亦可感染人类,引起多种致命疾病,如脑膜炎和链球菌中毒性休克综合征,对人和动物的生命安全与健康构成了重大威胁[1]。猪链球菌可分为29个血清型,猪链球菌2型(SS2)被认为是流行最广、最致命的血清型[1-2]。要引起疾病,猪链球菌就必须首先定殖于宿主,然后逃离宿主的免疫系统,使感染持续和传播。猪是猪链球菌的主要宿主,研究表明猪链球菌的主要定殖和进入位点是猪的上呼吸道,还可定殖于断奶仔猪的胃肠道,所以胃肠道也成为猪链球菌感染的次要部位[3]。
肠道微生物不仅影响机会致病菌的生长,而且广泛影响宿主的免疫状态和功能[3-5]。肠道微生物在宿主防御和急性炎症反应中扮演着重要角色,但影响宿主免疫系统发育的特定微生物分子或组分仍在发现和研究中[5]。中性粒细胞是细菌感染早期激活的免疫细胞,可通过吞噬、胞外诱捕网等方式杀菌,对于猪链球菌感染的发生与发展十分重要,而肠道微生物对于中性粒细胞的发育和稳态至关重要[6]。另外,有研究表明,BALB/c小鼠感染SS2后增加了粪便中变形杆菌等条件致病菌的比例,存在肠道微生态失调[3]。由此可见,肠道微生物可能影响着SS2的感染过程。本研究拟利用BALB/c小鼠感染模型,比较分析SS2强弱毒株对BALB/c小鼠结肠粪便中微生物菌群的影响。
1 材料与方法
1.1 试验动物 27只18日龄的SPF级BALB/c雌性小鼠(13±1)g购自长沙天勤生物技术有限公司,作为试验动物。
1.2 菌株 猪链球菌2型强菌株SS2-1和弱毒株HA0609均由江苏省农业科学院兽医研究所分离、保存和馈赠。
1.3 动物实验 实验小鼠适应性喂养3 d后,随机分为3组:空白对照组(Mock组)、SS2-1组和HA0609组,每组各9只。Mock组小鼠腹腔注射200 μL ddH2O, SS2-1组和HA0609组分别腹腔注射200 μL含有4×107CFU的SS2-1和HA0609。小鼠饲养条件清洁干净,光照12 h/黑夜12 h昼夜循环,室温约20 ℃。每天对小鼠摄食量、饮水量、行动活跃程度、体重、皮毛光泽度以及小鼠死亡进行观察和记录,连续观察至攻菌后的第7 d。各组小鼠于攻菌后的第7 d,颈椎脱臼处死后无菌条件下采集肺脏和结肠粪便置于无菌冻存管中。肺脏样本立即进行荷菌量测定,结肠粪便样本于-80 ℃保存备用。
1.4 肺脏荷菌量测定 采用菌落计数法测定小鼠脏器荷菌量,即无菌条件下取小鼠肺脏,称重后进行组织研磨匀浆,使用PBS梯度稀释涂板后计数,以Log10 CFU/g表示。
1.5 测序和数据分析 将攻菌后第7 d采集的小鼠结肠粪便(如遇小鼠死亡,则取死亡当日结肠内粪便),组内每3只小鼠的粪便进行混样,空白对照组样本标记为Mock,猪链球菌2型强毒株攻菌组标记为SS2-1,猪链球菌2型弱毒株攻菌组标记为HA0609。所有样品干冰保存送至成都凯来博生物科技有限公司进行16S rRNA的高通量测序。
1.6 数据分析 测序数据经过质控、去噪、拼接、去嵌合体过滤得到有效数据后,对每个样本测序量进行统计分析;按照Vsearch、QIIME2等软件对数据进行OTU聚类、Alpha多样性分析、Beta多样性分析、物种组成及差异分析等。实验数据使用Graphpad Prism6.01统计软件进行分析,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 猪链球菌2型小鼠模型实验 感染后2 d,BALB/c小鼠摄食量、饮水量和活跃程度下降,SS2-1组第3 d和第4 d各有3只和2只小鼠死亡,HA0609组第4 d有1只小鼠死亡。由图1可知,Mock组的肺脏中未检测到活菌,SS2-1组菌量显著高于HA0609组(P<0.01)。
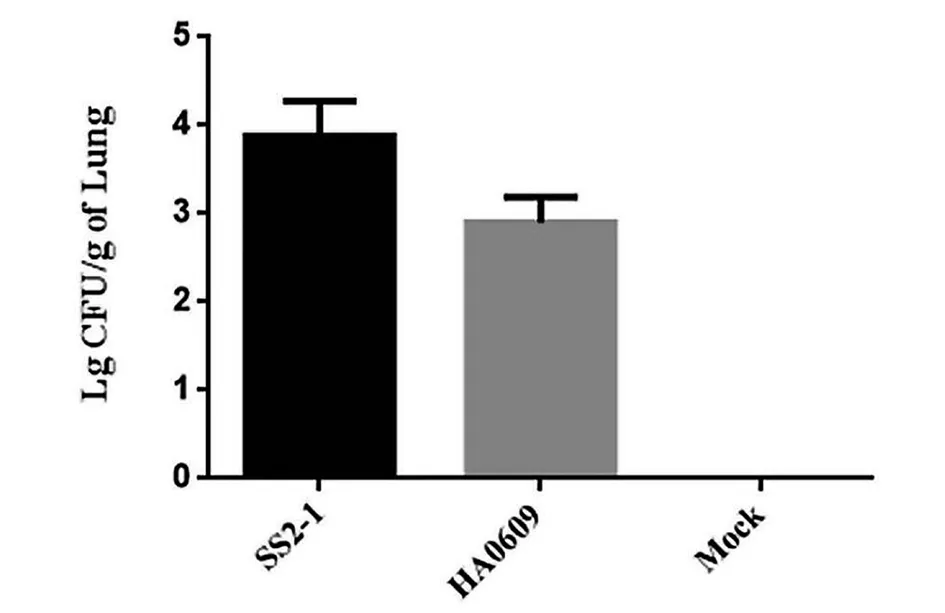
图1 各组BALB/c 小鼠脏器的荷菌量
2.2 不同组别微生物OTUs的比较 一般认定2个序列相似度为97%时属于一个菌属,当相似度为99%时,认定其是一个菌种。本文采用相似度为97%为一个OTU[7],对样品进行OTU统计,Mock组、HA0609组和SS2-1组分别获得1 125个,1 167个和1 383个(图2)。
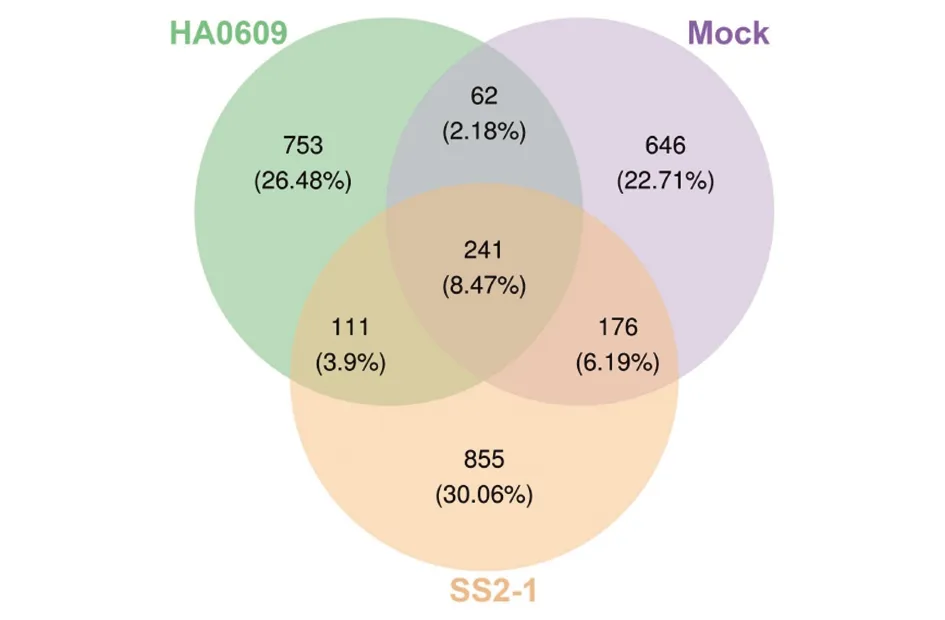
图2 猪链球菌2型强弱毒株对BALB/c小鼠肠道微生物基因OTU分布的影响
2.3 猪链球菌2型强弱毒株对BALB/c小鼠肠道微生物群落Alpha多样性的影响 Chao1和Observed species指数用于衡量样本微生物群落的丰富度,Chao1指数越大,OTU数目越多,样本数比较多。Shannon和Simpson指数用于衡量样本微生物群落的多样性,Shannon值越大说明群落多样性越高,Simpson指数越大,即种类越均一,丰富度越低。Faith’s PD、Pielou’s evenness和Good’s coverage指数分别表征基于进化的多样性、均匀度和覆盖度。由图3可知,HA0609组与Mock组差异较小,而SS2-1组与Mock组差异较显著。SS2-1组样本物种数较多,但种类相对均一。可见,相对于Mock组和HA0609组,猪链球菌强毒株SS2-1 对小鼠肠道微生物群落的丰富度、多样性等均有较显著的影响。
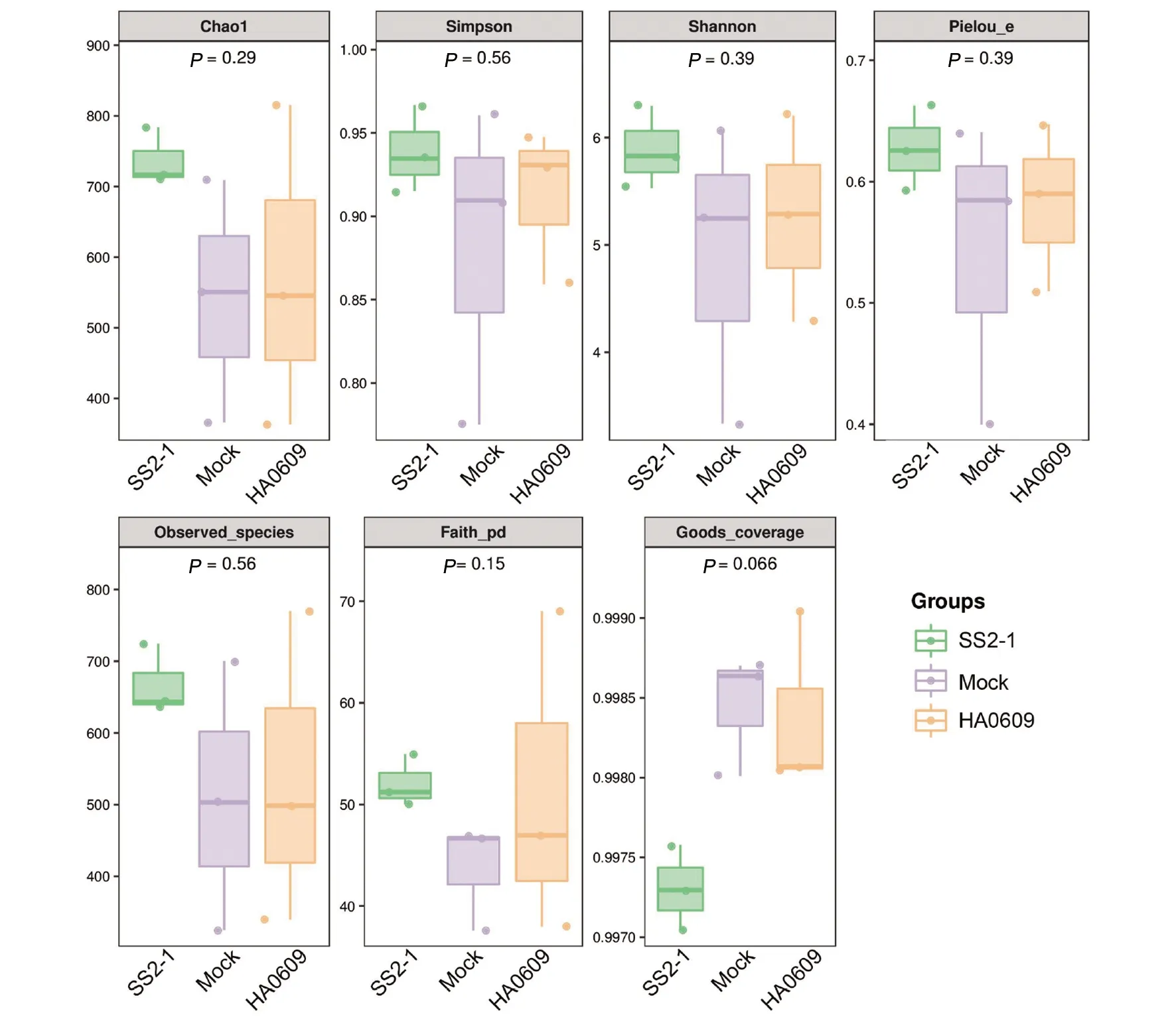
图3 猪链球菌2型强弱毒株对BALB/c小鼠肠道微生物多样性指数的影响
2.4 猪链球菌2型强弱毒株对BALB/c小鼠肠道微生物群落Beta多样性的影响 Beta多样性是对不同生态系统之间的多样性进行比较,用以表示生物种类对环境异质性的反应[8]。两点在坐标轴上的投影距离越近,物种丰度组成就越相似。如图4所示,三组样品点的远近均能明显的区分,这也表明三组的微生物物种存在着一定的覆盖,但其多样性亦存在差异。
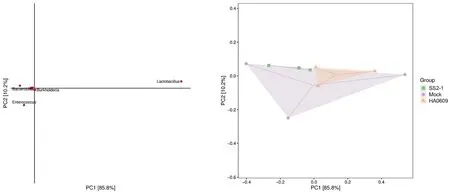
左图点的横坐标和纵坐标可分别表示该物种对样本在这两个维度上差异的贡献大小;两个坐标轴括号中的百分数分别为所有样本在该维度上的物种丰度组成差异占总差异的比值。
2.5 猪链球菌2型强弱毒株对BALB/c小鼠肠道微生物科水平的影响 图5为不同组别在科水平上肠道微生物的组成和结构,科水平上共得到20个主要的细菌科。三组的优势菌科存在差异,其中SS2-1组的优势菌科是Lactobacillaceae(乳杆菌科)、S24-7(拟杆菌门S24-7菌科)、Rikenellaceae(理研菌科)、Bacteroidaceae(拟杆菌科)和Lachnospiraceae(毛螺菌科);HA0609组的优势菌科是Lactobacillaceae(乳杆菌科)、S24-7(拟杆菌门S24-7菌科)、Enterococcaceae(肠球菌科)、Burkholderiaceae(伯克氏菌科);Mock组的优势菌科是Lactobacillaceae(乳杆菌科)、S24-7(拟杆菌门S24-7菌科)、Enterococcaceae(肠球菌科)、Bacteroidaceae(拟杆菌科)和Prevotellaceae(普雷沃氏菌科)。三组有着共同的优势菌科为Lactobacillaceae(乳杆菌科)和S24-7(拟杆菌门S24-7菌科),但所占比例显著不同。SS2-1组相对于HA0609组和Mock组,Lactobacillaceae(乳杆菌科)、Prevotellaceae(普雷沃氏菌科)和Enterococcaceae(肠球菌科)减少,Rikenellaceae(理研菌科)、Lachnospiraceae(毛螺菌科)、Ruminococcaceae(瘤胃菌科)、F16(F16菌科)和Coriobacteriaceae(红蝽菌科)显著增多。
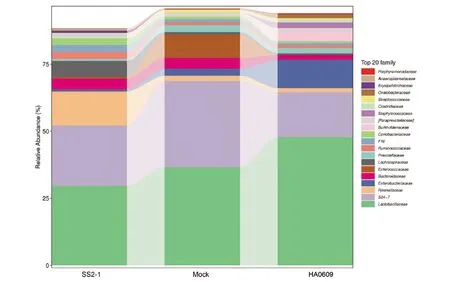
图5 BALB/c小鼠肠道微生物科水平物种组成分析柱状图
2.6 聚类热图(Heatmap 图)分析 在属水平上,使用平均丰度前50位的属的丰度数据绘制热图(图6)。热图通过颜色梯度及相似程度反映不同组别或不同样品在各分类水平上群落组成的相似性和差异性。由聚类结果可知,SS2-1组、HA0609组和Mock组存在差异。相对于Mock组,SS2-1组和HA0609组的Enterococcus(肠球菌属)、Akkermansia(艾克曼菌属)、Lactococcus(乳球菌属)、Butyricimonas(丁酸弧菌属)相对丰度降低,Alistipes、Ruminococcus(瘤胃球菌属)、Roseburia(罗氏菌属)、Butyricicoccus(丁酸球菌属)、Pediococcus(片球菌属)和Coprobacillus(粪芽孢菌属)相对丰度升高。

图6 BALB/c小鼠肠道微生物属水平热图
2.7 LEfSe(LDA Effect Size)分析 为了进一步分析猪链球菌强弱毒株感染组和Mock组间的差异,我们使用LEfSe多级物种差异判别及组间差异比较,挖掘潜在的鉴别生物标志[9](图7)。从门到属(从内圈到外圈)主要分类等级上,相对于Mock组,感染组的差异物种为Proteobacteria(变形杆菌门)、Alphaproteobacteria(α-变形杆菌纲)和Burkholderiales(伯克氏菌目)。
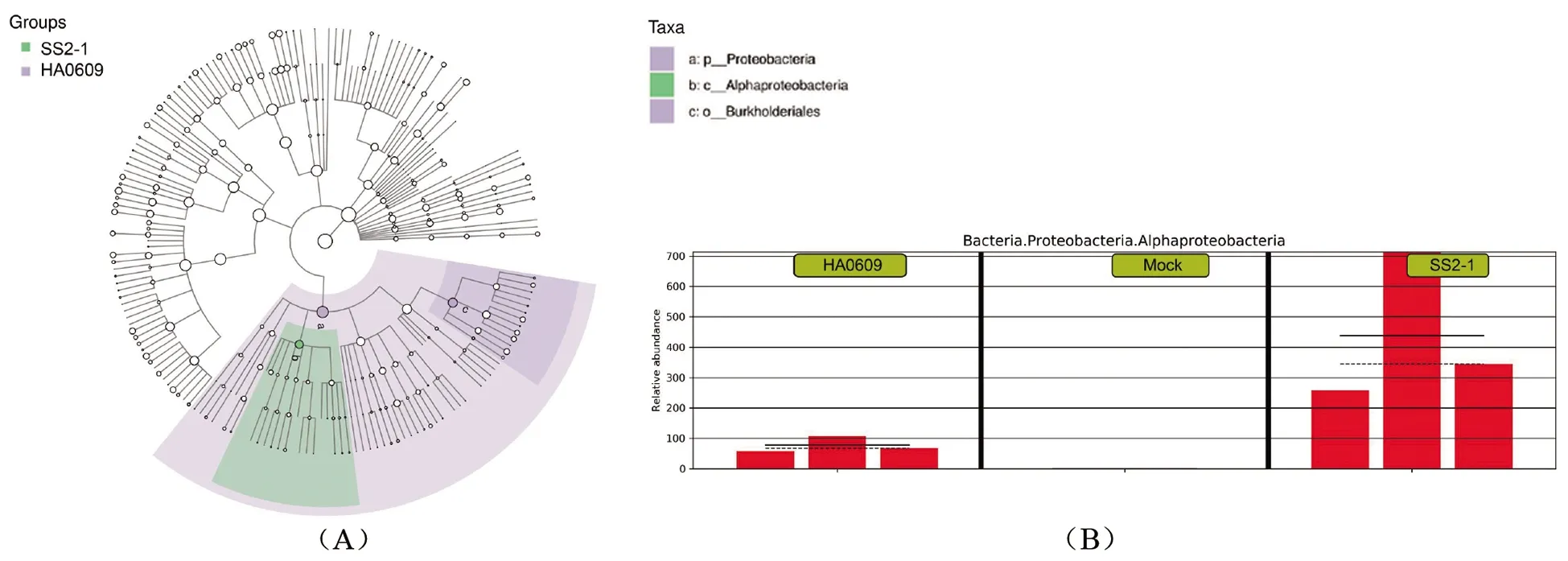
图7 基于LEfSe的组间差异分析
3 讨 论
肠道菌群是宿主必不可少的组成部分,被誉为机体自身的“黑匣子”,影响着宿主的消化吸收能力、免疫力等方面,与代谢性疾病、感染性疾病、癌症等密切相关[3,8,10-11]。研究表明,肠道微生物在肺炎链球菌感染过程中能够增强肺炎链球菌的传播、炎症反应和器官损伤等[3,9]。猪链球菌2型通常定殖在口咽部和胃肠道黏膜表面,而黏膜形成的物理和免疫屏障对侵入机体的病原体发挥阻挡和排除作用。因而,猪链球菌2型感染后的内环境失衡也是猪链球菌2型定殖在宿主体内的条件之一[3]。研究表明,链球菌感染后影响了小鼠肠道微生物的多样性和构成,增加了变形杆菌等条件致病菌的比例,增强了疾病发生的可能性[3]。本文为避免外界环境对肠道菌群的影响,选用结肠中的粪便,采用Illumina Miseq测序技术研究猪链球菌2型强弱毒株感染对小鼠肠道菌群多样性的影响。结果表明,各组样本的测序覆盖率均达到0.99以上,测序覆盖率较高,实验数据可靠;SS2-1组群落丰富度、多样性与HA0609组和Mock组显著不同。具体表现为,SS2-1组小鼠的肠道菌群OTU数量与Alpha多样性高于HA0609组和Mock组,HA0609组与Mock组相似度最为接近。
人体肠道菌群以拟杆菌门和厚壁菌门为主,其次是变形菌门、放线菌门等[12]。人体和动物体内有益的细菌主要为酪酸杆菌、乳酸菌、双歧杆菌、嗜酸乳杆菌等;致病菌主要为大肠杆菌、肠球菌、变形杆菌、沙门氏菌、志贺氏菌等。王小敏等[3]研究表明,SS2-1感染小鼠后,小鼠自身增加厚壁菌门和拟杆菌门等有益菌的比例,但同时也增加了变形杆菌等条件致病菌的比例。本文证实SS2-1组、HA0609组和Mock组有着共同的优势菌科,即Lactobacillaceae和S24-7,但所占比例不同。SS2-1组相对于HA0609组和Mock组,益生菌Lactobacillaceae和Prevotellaceae减少,具有致病性或潜在致病性的Rikenellaceae和Coriobacteriaceae增多,但潜在有益菌Lachnospiraceae和益生菌Ruminococcaceae亦有增多。可见,相对于HA0609组和Mock组,SS2-1感染小鼠后,菌群结构改变,益生菌或潜在益生菌所占比例有增多亦有减少,致病菌或潜在致病菌增多,存在肠道菌群失调现象,这一现象与王小敏等[3]的结果相一致。
相对于Mock组,感染组的致病菌Enterococcus、有益菌Akkermansia、Lactococcus和Butyricimonas相对丰度降低,Alistipes、Ruminococcus、Roseburia相对丰度升高。Akkermansia具有潜在的抗炎作用,能够调节宿主的代谢紊乱,可以根据宿主的健康状况帮助或伤害宿主[13-14]。Lactococcus具有良好的改善肠道屏障功能和抵抗致病微生物的作用[14]。Butyricimonas产生丁酸,丁酸是结肠能量的首选来源,对肠黏膜修复及结肠炎和结肠癌的预防起作用,然而,也有研究表明分离自健康人肠道内的丁酸盐产生菌能够伴随肠道菌群结构的加速失衡加重实验动物的肠道炎症[15-16]。Alistipes是一种容易导致肠道炎症的致病菌[14]。由此说明,相对于Mock组,感染组的有益菌丰度降低,致病菌有降低亦有升高;产丁酸或丁酸盐的Roseburia丰度升高,Butyricimonas丰度降低,可见猪链球菌2型感染后,产丁酸或丁酸盐的菌丰度此消彼长,有降低亦有升高。
本研究通过LEfSe分析筛选差异性物种。结果表明,SS2-1组和HA0609组的差异物种为Proteobacteria、Burkholderiales和Alphaproteobacteria,而相对于HA0609组,SS2-1组的差异物种为致病菌变形杆菌门下的Alphaproteobacteria。这与王小敏等[3]发现SS2-1感染小鼠后,小鼠粪便菌群中变形杆菌这一致病菌的比例升高相一致。
综上,猪链球菌2型感染后可改变小鼠结肠粪便的菌群结构,弱毒株HA0609组与Mock组菌群丰富度和多样性更为接近。强毒株SS2-1感染对小鼠结肠粪便菌群的丰富度和多样性影响更为明显,益菌所占比例减少,致病菌或潜在致病菌增多,肠道菌群失调。另外,变形杆菌门下的Alphaproteobacteria作为强毒株SS2-1组的差异物种,推测其可作为强毒株感染的潜在鉴别生物标志,但仍需更深入的研究。
利益冲突:无
