高产酸扣囊复膜酵母的筛选与培养基配方优化
2021-08-05张宸瑞高瑞杰缪礼鸿刘蒲临廖卫芳
张宸瑞,高瑞杰,缪礼鸿*,刘蒲临,廖卫芳
(武汉轻工大学 生命科学与技术学院,湖北 武汉 430000)
米酒因其独特的风味及口感受到广大消费者青睐。酒曲是决定米酒品质的关键因素之一。酒曲内微生物的相互作用不仅生成了酒体内醇、醛、酸等物质,也是有机酸的重要来源。有机酸的组成比例及类型对米酒的品质有很大影响,SHEN F等[1]采用液相色谱对米酒进行了测定,发现米酒中的有机酸包括草酸、乙酸、乳酸、苹果酸、琥珀酸、柠檬酸和酒石酸等。其中乙酸属于挥发性酸,是赋予酒体有醇厚感的主要物质,使酒体温和,具有酸快爽味;而乳酸在酒体中会让其稍有涩感,酸味尖利[2]。此外,有机酸也是生成酯类的重要前驱物质[3],闫华文等[4]对6种不同地区的米酒酒曲进行分析,在其中4种酒曲中发现了扣囊复膜酵母(Saccharomycopsis fibuligera)。李静心等[5]研究表明,扣囊复膜酵母在白酒高温大曲真菌组成中占25.66%。扣囊复膜酵母(S.fibuligera)是多种酒曲和酒醅中的主要酵母菌之一[6-7]。具有产有机酸、醇类、酯类和水解淀粉等多种能力[8-10]。吴健等[11]比较了扣囊复膜酵母(S.fibuligera)、毕赤酵母、酿酒酵母等4种酵母菌在米曲汁培养基中发酵产酸能力,结果表明扣囊复膜酵母(S.fibuligera)产总酸能力最强达3.57 g/L,且具有一定的产淀粉酶能力。鉴于扣囊复膜酵母(S.fibuligera)在酒曲中具有一定优势,并对酒体品质具有促进作用,因此,可以将其制备成菌剂提高酒体质量。黄芳等[12]的研究表明,使用糖蜜作为培养基碳源,也能提升酵母菌的数量。孙思佳等[13]采用响应面法对扣囊复膜酵母(S.fibuligera)培养基进行了优化,以OD600nm值计算的酵母菌的生物量提高了170%。
本研究采用平板分离方法,从不同来源的米酒及黄酒曲中分离筛选产酸酵母菌株,采用分子生物学法对其进行鉴定,比较测定了不同菌株的总酸产量和耐受性差异,并通过培养基的优化提高产酸酵母菌株液态发酵总菌数,为该菌种的开发应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 酒曲及材料来源
10种酒曲[湖北房县任氏米酒曲(R)、湖北房县元氏黄酒曲(Y)、湖北房县黄酒曲(7#)、湖北孝感孝南区米酒曲(3#)、湖北孝感某厂区米酒曲(YL、H、F)、湖北广水米酒曲(GS)、四川达州大竹县华联米酒曲(5#)、四川达州大竹县石河镇米酒曲(6#)],用无菌密封袋保存。糯米:市售,经粉碎机磨碎后过40目筛后备用。
1.1.2 试剂
α-淀粉酶(3×104U/mL)、耐高温糖化酶(1×105U/mL):枣庄杰诺生物酶有限公司;2×F8 FastLong聚合酶链式反应(polymerase chain reaction,PCR)MasterMix,北京艾德莱生物科技有限公司;宝生物工程(大连)有限公司;PCR引物、基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:生工生物工程(上海)股份有限公司;酵母膏、蛋白胨:安琪酵母有限公司;葡萄糖、乳酸、无水乙醇、异丙醇、可溶性淀粉、蔗糖、乳糖、甲醛溶液(36%):国药集团化学试剂有限公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):北京索莱宝科技有限公司;β-巯基乙醇:上海试剂四分厂;牛肉膏:北京奥博星生物试剂公司;以上试剂均为分析纯或生化试剂。
1.1.3 培养基
糯米糖化液发酵培养基:糯米粉与水按料液比1∶3(g∶mL)混合,混匀后按15 U/g干料添加α-淀粉酶,于95 ℃水浴锅中处理90 min,然后冷却后再按150 U/g干料添加糖化酶,于65 ℃水浴锅中处理30 min,期间需不断搅拌,分装好后115 ℃灭菌30 min。
酵母浸出粉胨葡萄糖(yeastextractpeptonedextrose,YPD)培养基[9]:葡萄糖20 g/L,酵母膏10 g/L,蛋白胨20 g/L,蒸馏水1 000 mL;YPD固体培养基添加2%琼脂粉,培养基115 ℃灭菌30 min。
马丁孟加拉红-链霉素培养基[14]:葡萄糖10 g/L、蛋白胨5g/L、KH2PO41g/L、MgSO4·7H2O0.5g/L、孟加拉红33.4mg/L、链霉素30 μg/mL,121 ℃灭菌20 min。
1.2 仪器与设备
ZHJH-C1115B超净工作台、ZXDP-A2160恒温培养箱、ZHWY-2102摇床:上海智城科技有限公司;T-Gradient 聚合酶链式反应仪:德国Biometra公司;SYDR/1305凝胶成像仪:美国Syngene公司;7890A气相色谱仪:美国安捷伦公司;UV-5900PC紫外可见分光光度计:上海元析仪器有限公司;WH-3涡旋振荡仪:上海沪西分析仪器厂有限公司;ST2100E pH计:奥豪斯国际贸易(上海)有限公司;78-1磁力加热搅拌器:国华(常州)仪器制造有限公司;Centrifuge 5424小型台式高速离心机:德国Eppendorf公司;YXQ-LS-50Sll立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 酵母菌株的分离及鉴定
(1)菌株分离方法及总基因组抽提方法
称取酒曲10 g添加到90 mL无菌水中,30 ℃、170 r/min摇床振荡1 h使其混匀。样品梯度稀释(10-2、10-3、10-4),涂布孟加拉红培养基上,30 ℃静置培养1~2 d后挑取形态不同的单菌落,多次在YPD平板上划线纯化,获得纯培养的菌株。取纯化后的菌株,挑取单菌落接种于YPD培养基中,30 ℃、170 r/min恒温摇床内培养24 h,用Ezup柱式酵母基因组DNA抽提试剂盒提取DNA,完成后置于-20 ℃冰箱中保存备用。
(2)26S rDNA PCR扩增及测序[15]
PCR扩增26S rDNA,酵母26S rDNA正向引物NL1:5'-GCATATCAATAAGCGGAGGAAAAG-3';反向引物NL4:5'-GGTCCGTGTTTCAAGACGG-3'。
PCR扩增体系:25 μL 2×F8 FastLong PCR MasterMix、22 μL三蒸水、1 μL正向引物、1 μL反向引物、1 μL提取出的酵母DNA模板。
PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸60 s,循环33 次;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测,送至苏州金唯智生物科技有限公司进行测序。
(3)测序结果分析及菌种鉴定[16-17]
测序结果采DNAStar软件人工校对,校正序列在美国国家生物技术信息中心(national center for biotechnology in formation,NCBI)的GenBank数据库中进行同源序列搜索,采用MEGA 5.2软件中的邻接(neighbor-joining,NJ)法,1 000次Bootstrap检验构建系统发育树。
1.3.2 筛选菌株的发酵能力
酵母菌种子液的制备:在YPD平板上挑取单菌菌落,接种于YPD液体(培养基pH 5.89,下同)培养基中,30 ℃、170 r/min摇床培养24 h,得一级种子液。按1%接种YPD液体培养基,28 ℃、170 r/min摇床培养12 h,得到二级种子液。
将筛选的酵母菌的二级种子液接种至糯米糖化液中,摇匀后放入28 ℃培养箱内静置培养7 d,取样测定总酸和残糖含量。
1.3.3 分析检测
发酵液经蒸馏后总酸含量测定按照国标GB/T 13662—2018《黄酒》中的气相色谱法[18],气相色谱检测条件:分流比为20∶1,氢气(H2)流速为30 mL/min,空气流速为400 mL/min,N2流速为25 mL/min,柱温60 ℃,维持5 min,再以10 ℃/min升温至160 ℃,维持5 min。检测器温度200 ℃,进样口温度220 ℃,总运行时间20 min。以上发酵液均做3组平行样;残糖含量的测定采用DNS法[19];pH值采用pH计测定;酵母菌总数使用血球计数板计数法计数[14]。
1.3.4 筛选菌株耐受性比较
(1)耐温能力测定
分装装瓶量30 mL/100 mL的YPD培养基,按2%体积比接种二级种子液,将其分别在24 ℃、27 ℃、30 ℃、33 ℃、36 ℃、39 ℃、42 ℃、45 ℃条件下170 r/min摇床培养20 h后取出。稀释一定倍数后测定OD600nm值。
(2)耐酸能力测定
分装装瓶量30 mL/100 mL的YPD培养基,将其pH分别调至3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0。按2%体积比接种二级种子液,在30 ℃、170 r/min摇床培养20 h后取出测定OD600nm值。
(3)耐酒精能力测定
二级种子液按2%体积比接种至不同体积分数乙醇(2%、4%、6%、8%、10%)YPD培养基中,在30 ℃、170 r/min摇床培养20 h后取出测定OD600nm值。
1.3.5 培养基配方优化
单因素试验:以YPD液体培养基为对照,在其培养基配方基础上对碳源(10 g/L糖蜜、蔗糖、葡萄糖、乳糖、可溶性淀粉)及氮源(10 g/L(NH4)2SO4、大豆蛋白胨、蛋白胨)进行优化。
响应面试验:以菌株3-1生长量(Y)为响应值,糖蜜(A)、葡萄糖(B)、大豆蛋白胨(C)及酵母浸出粉(D)添加量为影响因子,进行Box-Behnken试验设计,采用Design Expert 8.0.6.1软件预测最佳培养基组分及浓度。
2 结果与分析
2.1 不同米酒曲样品酵母菌的分离与鉴定结果
从10个酒曲样品中共分离获得31株酵母,其系统发育树见图1,鉴定结果见表1。由表1可知,共获得7个属的7种酵母菌,扣囊复膜孢酵母(Saccharomycopsis fibuligera)6株,Cyberlindnera fabianii共5株,酿酒酵母(Saccharomyces cerevisiae)8株,热带假丝酵母(Candida tropicalis)5株,异常威克汉姆酵母(Wickerhamomyces anomalus)5株,库德毕赤酵母(Pichia kudriavzevii)和葡萄牙棒孢酵母(Clavispora lusitaniae)各1株。扣囊复膜孢酵母在6个米酒曲样品中均有出现,说明扣囊复膜孢酵母广泛存在于多种不同地域来源的米酒曲中。W.anomalus与C.fabianii出现的频率也较高,在4种酒曲中均有出现。W.anomalus是米酒发酵的另一种常见生香酵母[20],除P.kudriavzevii和C.lusitaniae外,其余酵母均在不同酒曲中多次出现。与酿酒酵母相比,扣囊复膜酵母较强的产酸能力可能与丙酮酸转化为乙醇的效率较低有关,且扣囊复膜酵母可产生大量液态氨基酸[21]。对提高米酒风味及品质有至关重要的作用,故选6株扣囊复膜酵母进行下一步试验。

表1 酵母分离与鉴定结果Table 1 Isolation and identification results of yeasts
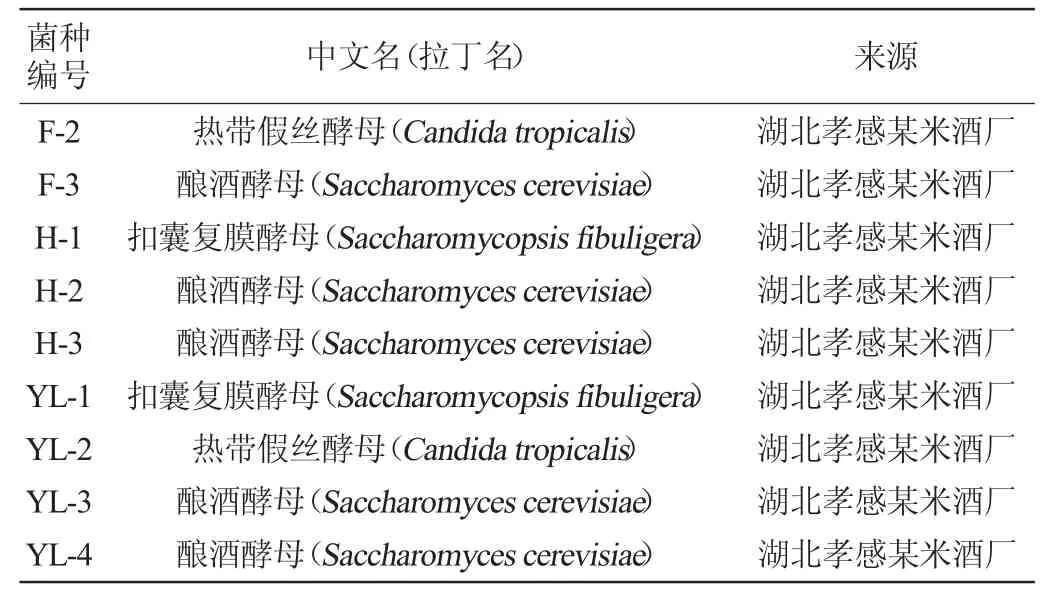
续表
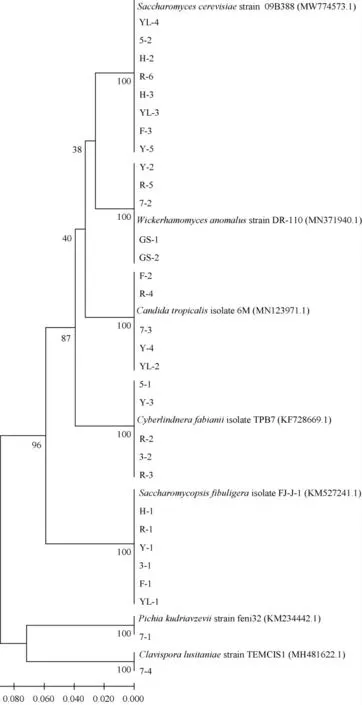
图1 基于26S rDNA D1/D2区域序列酒曲来源的酵母菌的系统发育树Fig.1 Phylogenetic tree of yeasts isolated from Jiuqu based on 26S rDNA D1/D2 region alignment
2.2 不同扣囊复膜孢酵母菌株发酵特性及产酸能力比较结果
由表2可知,扣囊复膜酵母不同菌株之间产总酸、酒精和乙酸乙酯等能力差异较大。经测定,糯米糖化液初始还原糖含量为140 g/L,pH 5.9。残糖值越低,说明发酵过程越彻底,而pH下降幅越大则表示该株酵母产酸能力越强。扣囊复膜酵母不同菌株之间乙酸乙酯产量相差绝对值达到29.86 mg/L,乙醇产量相差绝对值最高可达6.11%vol,正丙醇产量绝对值达到48.88 mg/L,残糖含量之间差值达到31.3 g/L。pH值总体差距较小,而总酸与pH呈正相关,pH值越低的菌株,其总酸含量越高。在这些菌株中,菌株3-1的产酸和产乙酸乙酯、正丙醇能力最强,且最终发酵液pH值为2.89,在所有菌株中降幅最大。其总酸含量达5.40 g/L,乙酸乙酯产量达33.07 mg/L,正丙醇产量为84.33 mg/L。
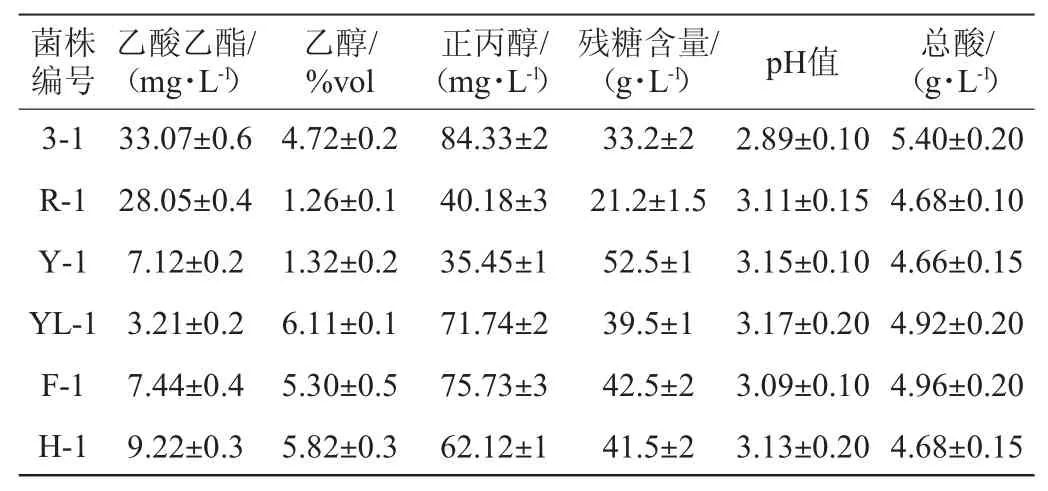
表2 不同扣囊复膜酵母菌株的发酵蒸馏液总酸、残糖及挥发成分测定结果Table 2 Determination results of total acid,residual sugar and volatile compounds in fermentation distillate of different Saccharomycopsis fibuligera strains
2.3 扣囊复膜酵母不同菌株的耐受性比较结果
不同扣囊复膜酵母的温度、pH及酒精耐受性比较结果见图2。
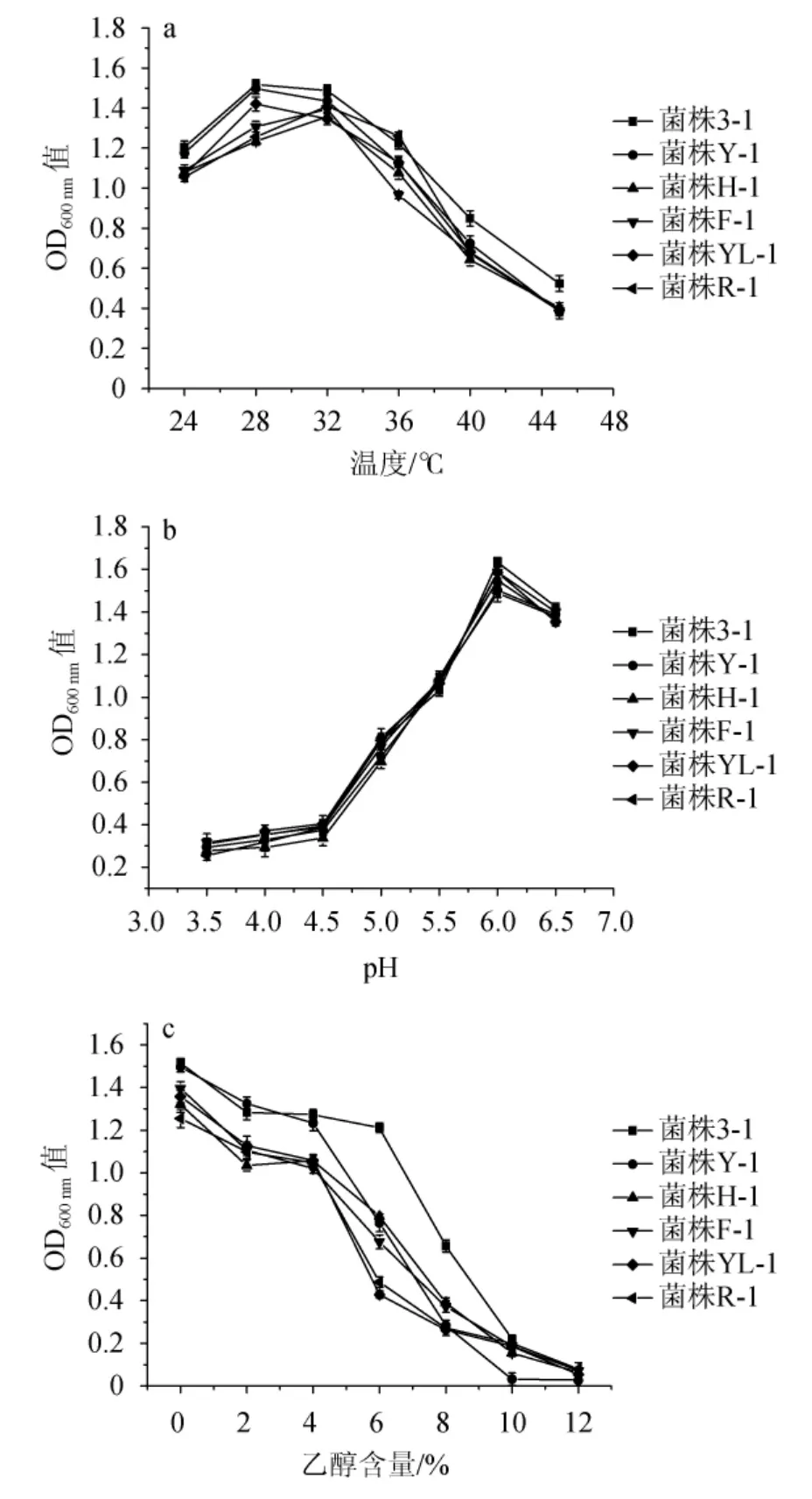
图2 不同扣囊复膜酵母菌株的温度(a)、pH(b)及乙醇(c)耐受性比较Fig.2 Comparison of temperature (a),pH (b) and alcohol (c) tolerance among different Saccharomycopsis fibuligera strains
由图2a可知,所分离扣囊复膜酵母生长温度范围基本一致,不同菌株的最适生长温度区间为28~32 ℃。当温度高于36 ℃之后,所有菌株的生长均受到明显抑制。结果表明,其中菌株3-1的耐热性最好,在45 ℃培养时其OD600nm值仍达0.64,这可能与菌株的特性或发酵液中还未利用完全的残糖具有的热保护剂作用有关[22]。由图2b可知,扣囊复膜酵母在pH较低的条件下生长情况较差,当pH5.5时,扣囊复膜酵母生长情况均开始受到不同程度的抑制。pH 6.0时不同菌株的生长量均达最大。当pH继续上升,扣囊复膜酵母的生长情况均受到不同情况的抑制,菌株3-1的在pH6.0时,生长量在所有菌株中最高。由图2c可知,扣囊复膜酵母不同菌株的耐乙醇生长能力具有一定差异。在乙醇含量为0~4%时,对扣囊复膜酵母的生长影响不大;当乙醇含量达6%时,多数菌株的生长均受到明显抑制,但对菌株3-1的生长影响较小。随着乙醇浓度的继续上升,扣囊复膜酵母生长情况受到进一步抑制,当乙醇含量达到10%时,所有菌株基本上均不生长。高浓度的乙醇对酵母具有毒害作用,使得酵母丧失正常的生理功能[23],编号3-1的酵母在2%~10%的生长量均为最高,耐受性较好。
根据以上试验结果,扣囊复膜酵母3-1菌株的总酸产量最高,综合耐受性最好,故将其选为培养基优化的试验菌株。
2.4 菌株3-1培养基优化
2.4.1 单因素试验
由图3a可知,菌株3-1在糖蜜培养基中的生物量最高,其原因可能是因为糖蜜中含有一定的可发酵性氮、多种维生素及矿物质,这些物质在酵母生长过程中均可被利用,并促进酵母生长[24]。由图3b可知,使用大豆蛋白胨和普通蛋白胨的培养基中菌株3-1的生物量最高,而硫酸铵作氮源时其生物量最低。两种蛋白胨对扣囊复膜酵母的生长量没有明显差异。
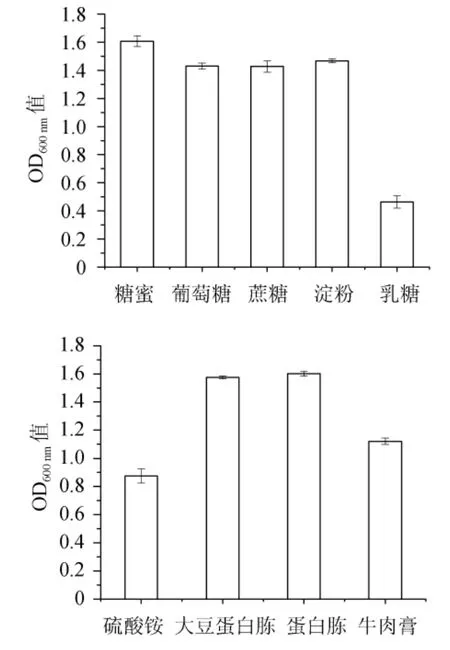
图3 不同碳源(a)及氮源(b)对菌株3-1生长的影响Fig.3 Effect of different carbon sources (a) and nitrogen sources (b) on strain 3-1 growth
2.4.2 Box-Behnken响应面优化试验
王瑶等[25]的研究表明,糖蜜与葡萄糖按3∶7的比例混合添加可以使成本降低的同时发酵产物的量得到一定的提升。所以本研究以菌株3-1生长量(Y)为响应值,糖蜜(A)、葡萄糖(B)、大豆蛋白胨(C)及酵母浸出粉(D)添加量为影响因子,进行Box-Behnken试验设计。Box-Behnken试验设计及结果见表3,方差分析见表4。

表3 Box-Behnken试验设计及结果Table 3 Design and results of Box-Behnken experiments
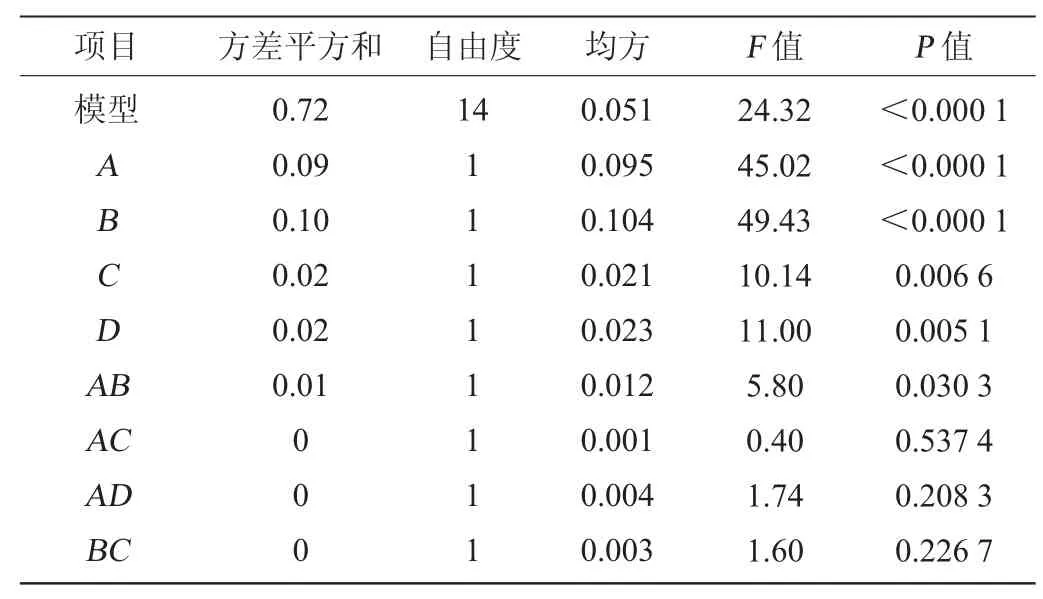
表4 回归模型方差分析Table 4 Variance analysis of regression model
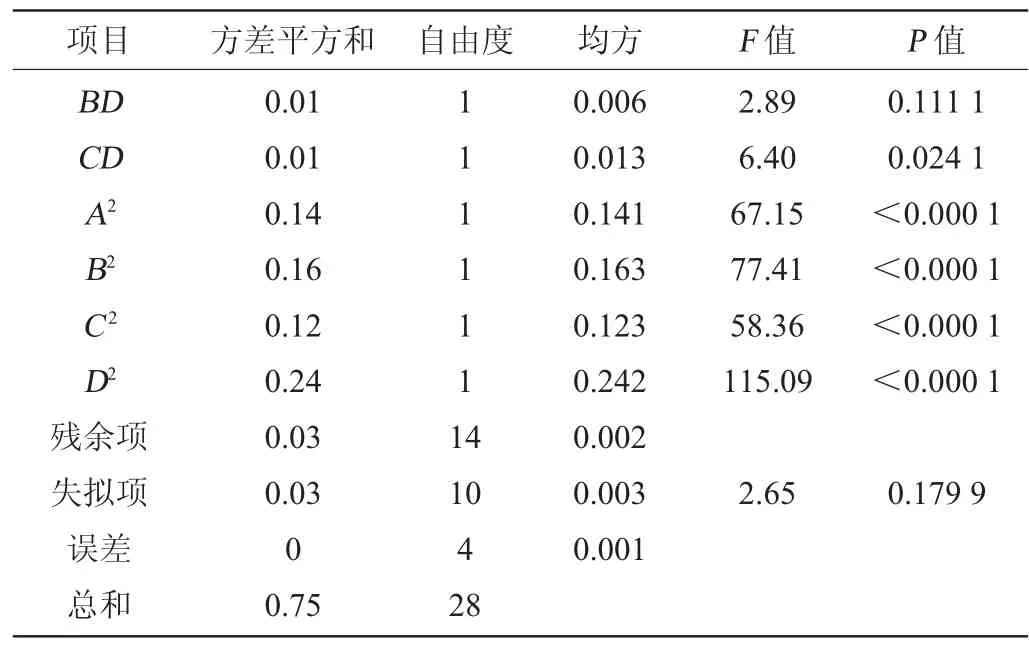
续表
对表3数据进行拟合分析,得到回归方程为Y=0.81+0.089A+0.093B+0.042C+0.044D-0.055AB-0.014AC+0.03AD+0.029BC+0.039BD-0.058CD-0.15A2-0.16B2-0.14C2-0.19D2
由表4及图4可知,模型的P值<0.000 1,表明极显著,失拟项P值=0.179 9>0.05,表明受未知因素影响较小,可以用此模型对菌株3-1生长进行分析和预测。回归方程的决定系数R2=0.960 5,校正决定系数R2adj=0.921 2,表明该模型拟合度较好。对菌株3-1生长影响顺序为葡萄糖(B)>糖蜜(A)>酵母浸粉(C)>大豆蛋白胨(D)。一次项A、B、C、D,二次项A2、B2、C2、D2对结果影响极显著(P<0.01),交互项AB、CD对结果影响显著(P<0.05)。
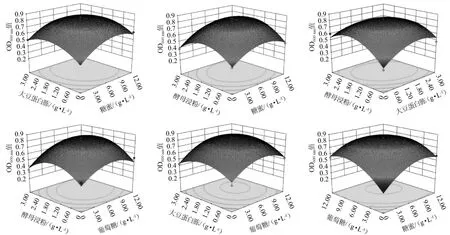
图4 各因素对菌株3-1生长影响的响应面及等高线Fig.4 Response surface plots and contour lines of effects of interaction between each factors on strain 3-1 growth
通过Design Expert 8.0.6.1软件对回归方程求解,预测最佳培养基配方为:糖蜜添加量7.54 g/L,葡萄糖添加量7.68g/L,大豆蛋白胨添加量1.71g/L,酵母浸粉添加量1.71g/L。在此优化条件,OD600nm值理论值为0.842。为了便于实际操作,将最佳培养基配方修正为糖蜜添加量7.5 g/L,葡萄糖添加量7.7 g/L,大豆蛋白胨添加量1.7 g/L,酵母浸粉添加量1.7 g/L。在此优化条件下进行3次验证试验,OD600nm值实际值为0.839±0.07,与预测值基本一致。说明该回归方程对菌株3-1生长量的分析和预测是可信的。优化后的培养基酵母总数达2.45×108个/mL,与对照培养基相比,酵母菌总数提升了63%。
3 结论
本研究从不同地域来源的多种米酒曲和黄酒曲样品中共分离和鉴定了31株酵母菌,其中扣囊复膜酵母是米酒曲中的主要酵母菌之一。通过试验比较测定了6株不同扣囊复膜酵母菌株的产酸能力和对温度及乙醇等耐受性,筛选获得了1株产总酸能力强、耐受性好的扣囊复膜酵母菌株3-1。在单因素试验的基础上,采用响应面法对扣囊复膜酵母3-1培养基进行优化,建立了合理可靠的二次多项模型,模型与试验数据拟合度较高。优化后的培养基配方为糖蜜7.5 g/L,葡萄糖7.7 g/L,大豆蛋白胨1.7 g/L,酵母浸粉1.7 g/L。在此优化条件下,扣囊复膜酵母菌株3-1总菌数达2.45×108个/mL,比YPD液体培养基的酵母菌总数提升了63%。本研究将为扣囊复膜酵母在米酒强化曲的制备与成品米酒总酸含量优化等方面的应用提供基础。
