辅酶Ⅰ体内代谢调控研究进展
2021-08-05孙卉张春义姜凌
孙卉, 张春义, 姜凌
中国农业科学院生物技术研究所, 北京100081
烟酸(nicotinic acid,NA)早在1937 年被确定为是预防和治疗饮食缺乏性疾病(糙皮病)的化合物,被命名为维生素B3。糙皮病曾经在欧洲、美洲、非洲和亚洲频繁爆发,患者皮肤通常发炎并出现硬皮的症状,一般也会伴随着腹泻和痴呆,严重时甚至会导致死亡[1]。后续研究发现缺乏辅酶Ⅰ——烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)合成的前体和中间化合物是人类糙皮病的根本原因。辅酶Ⅰ在1906 年作为酵母提取物中提高酒精发酵速率的主要成分被首次报道,其结构中包括烟酸、腺嘌呤、还原糖和磷酸盐[2]。NAD+在能量代谢途径(糖酵解、糖异生、三羧酸循环和呼吸链)的调节中起着核心作用[3]。氧化(即NAD+)和还原形式的NADH 之间的氧化还原反应介导了这些途径中NAD+依赖的酶促反应[4]。NAD+广泛参与新陈代谢、衰老、细胞死亡、DNA修复和基因表达等多种生命活动[2,5]。
NAD+对人类健康至关重要。膳食中有维生素B3 活性的NAD+合成的前体和中间化合物包括NA、烟酰胺(nicotinamide,NAM)、烟酰胺核苷(nicotinamide riboside,NR)和烟酰胺单核苷酸(nicotinamide mononucleotide,NMN),它们均能被人体吸收、相互转化并生成NAD+(图1)。摄入这些化合物可以调节体内NAD+的平衡,从而有效治疗并预防糙皮病等饮食缺乏性疾病[2]。植物产生的NA 与细菌和酵母产生的NAM 是NAD+合成前体的主要来源,以下三种饮食方式容易导致烟酸缺乏症:一是仅依赖精制谷物的单一化饮食,成熟的谷物中大部分NA 是结合状态的,不利于人体吸收利用;二是动物组织、乳制品和豆类摄入量较少的饮食,豆类、牛奶和动物组织都富含NAD+合成的前体和中间化合物;三是以高粱为主的饮食,因为高粱中过多的亮氨酸阻碍了色氨酸在NAD+合成中的利用[6]。此外,继发性烟酸缺乏的发生风险随着代谢性NAD+消耗的增加而升高,如糖尿病和肥胖患者、阿尔茨海默病和脑缺血患者、老年人和孕妇、正在接受放疗的癌症患者或暴露于DNA 损伤药物的情况,即使在膳食补充的情况下患者也会出现烟酸缺乏症状。因此,如何平衡机体内辅酶Ⅰ的调控机制成为近年来的研究热点[3-6]。已有研究表明NAD+合成的前体和中间化合物在预防糙皮病、延缓衰老、调节胰岛素分泌、调控mRNA 的表达、治疗神经和心血管疾病等方面具有多种重要医疗效果[2,5-6]。本文着重介绍了辅酶Ⅰ体内合成和代谢的调控过程,以期为利用合成生物学技术在大肠杆菌中富集NAD+各类中间化合物提供理论依据和技术支撑。

图1 辅酶Ⅰ及其前体和中间化合物的化学结构式及相互转化关系Fig.1 Chemical structures and interconversion of coenzyme Ⅰand its precursor and intermediate product
1 NAD+合成途径
NAD+的体内合成途径有3 类:色氨酸为底物的从头合成途径、NA 为底物的Preiss-Handler 途径、NAM 和 NR 为底物的补救途径(图 2),其中NAD+消耗产生NAM 的过程对维持生命体活动非常重要[7]。

图2 体内NAD+的合成途径Fig.2 NAD+synthetic pathway in living body
1.1 NAD+的从头合成途径
如图2 所示,色氨酸2,3-双加氧酶(tryptophan 2,3-dioxygenase,TDO)或吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)利用色氨酸生成N'-甲 酰 基 犬 尿 氨 酸(N’-formylkynurenine,N’-FKYN),然后通过芳基甲酰胺酶(arylformamidase,AFMID)转 化 为 犬 尿 氨 酸(kynurenine,KYN)。犬尿氨酸3-单加氧酶(kynurenine 3-monooxygenase,KMO)、犬 尿 氨酸 酶(kynureninase,KYNU)和3-羟基邻氨基苯甲酸3,4-双加氧酶(3-hydroxyanthranilate 3,4-dioxygenase,3HAO)依次将 KYN 转化为 2-氨基-3-羧基粘蛋白-6-半醛(2-amino-3-carboxymuconic-6-semialdehyde,ACMS),ACMS 可以自然环化形成喹啉酸(quinolinic acid,QA),喹啉酸磷酸核糖转移酶(quinolinic acid phosphoribosyltransferase,QaPRT)从 QA 和 5-磷酸核糖-1-焦磷酸(5-phosphoribosyl-1-pyrophosphate,PRPP)产生烟酸单核苷酸(nicotinic acid mononucleotide,NaMN)。最后两个步骤与Preiss-Handler途径相同[8]。
NAD+从头合成途径中有3 个环节影响NAD+的含量:①TDO/IDO 是第一个限速步骤,IDO 参与多种免疫抑制反应,炎症也可以诱导IDO 活性并导致色氨酸耗竭进而降低NAD+的含量[9]。②ACMS是两个反应的底物,它可能经过自然非酶促反应的环化,形成喹啉酸,继而参与NAD+的合成,或者由ACMS 脱羧酶(ACMS decarboxylase,ACMSD)转化为α-氨基粘酸半醛(α-amino-muconatesemialdehyde,AMS)、继而形成乙酰辅酶A。因此乙酰辅酶A 合成途径中的ACMSD 酶活性的高低可以改变ACMS 的含量,进而影响NAD+的含量[10]。③QaPRT 是从头合成途径的第二个限速步骤,是维持肝脏NAD+水平的重要酶,其活性不足导致具有神经毒性的喹啉酸过量产生,引起神经相关疾病,如癫痫和亨廷顿病[11]。
1.2 NA为底物的Preiss-Handler反应
Preiss-Handler 途径首先通过烟酸磷酸核糖转移酶(nicotinic acid phosphoribosyltransferase,NAPRT)将 NA 转化为 NaMN[12]。NaMN 通过烟酰胺/烟酸单核苷酸腺苷酸转移酶(nicotinamide/nicotinic acid mononucleotide adenylyltransferase,NMNAT)形成烟酸腺嘌呤二核苷酸(nicotinic acid adenine dinucleotide,NaAD+)。最后,NAD+合成酶(NAD+synthetase,NADS)将NaAD+转化为NAD+[8]。
这个途径中最重要的酶学反应是NMNAT。在动物中存在的 3 种 NMNAT 同工酶:NMNAT1 位于细胞核内,在各类组织中广泛表达,其缺失会导致胚胎致死[13]。NMNAT2 是一种定位于细胞质膜和高尔基膜的蛋白。在中枢和周围神经系统中大量表达,其缺陷型小鼠在围产期死于严重的周围神经系统缺陷和中枢神经系统轴突的断裂[14]。NMNAT3在线粒体中负责维持NAD+稳定,保证了70%的细胞内NAD+定位于线粒体,参与呼吸作用和众多的氧化还原反应[15]。
1.3 以NAM和NR为底物的补救合成途径
补救途径是体内产生和维持细胞内NAD+水平的最重要途径。NAD+消耗酶利用NAD+作为辅酶,包括DNA 修复酶——多聚ADP 核糖聚合酶(poly-ADP-ribose polymerases,PARP)、Sirtuin(动物有 7 个同源蛋白 SIRT1~SIRT7)、IDO、以及NAD+依赖的ADP 环化酶CD38。这些酶对NAD+的酶切获得NAM,NAM 可以直接从膳食中吸收,是NAD+补救途径的起始化合物[5]。NAM 在烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyltransferase,NAMPT)作用下和 PRPP 生成NMN。随后,NMNAT 通过将ATP 的腺苷酸部分与NMN结合产生NAD+[16]。NR 是NAD+的另一个来源,体内的NR 在烟酰胺核糖苷激酶(nicotinamide riboside kinase,NRK)的作用下磷酸化形成NMN,然后通过NMNAT 合成NAD+[8]。细胞之外的NMN 通过CD73 在细胞外转化为NR,然后被细胞吸收。也有报道认为,Slc12a8 是NMN 的特异性转运体,NMN 也通过细胞或组织特异性的方式被吸收进入生物体内[17]。
补救途径中NAD+合成速率主要由NAMPT 决定,NAMPT 的表达受昼夜节律机制的调节。这使得它成为昼夜节律与NAD+挽救途径之间的关键调节位点[18]。NAMPT 在存在细胞内NAMPT(iNAMPT)和细胞外 NAMPT(eNAMPT)两种形式。eNAMPT 由多种细胞(脂肪细胞、肝细胞、心肌细胞和胰腺β-细胞等)分泌到细胞外,iNAMPT通常以乙酰化形式存在于细胞质中[19]。Sirtuin 蛋白1(SIRT1)在营养缺乏时被诱导活性增强,导致iNAMPT 脱乙酰、活性增强、蛋白也显著积累[20]。研究还发现NAMPT 高度特异性抑制剂FK866 能够通过结合变构调节位点非竞争性地抑制NAMPT 的酶活性[19]。这些研究充分说明NAD+合成与调控的复杂多样性。
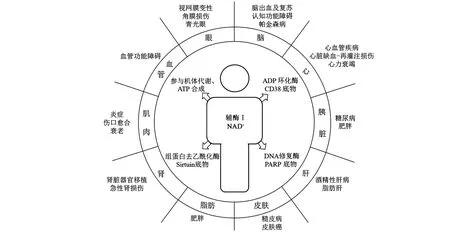
图3 NAD+参与的生命过程Fig.3 Life processes that NAD+participates in
2 调控体内NAD+平衡的分子机制
2.1 NAD+参与的生命过程
辅酶Ⅰ在糖酵解、糖异生、三羧酸循环及呼吸链中发挥着不可替代的作用,也是多种酶促氧化还原反应中不可缺少的辅助因子[6]。NAD+不仅随营养摄入和机体运动状况而变化,还随昼夜节律变化而波动、反映饮食中NA 摄入不足、营养不良或过度运动等代谢状况。NAD+水平和利用率降低不仅会改变细胞代谢过程,还会导致基因表达改变、DNA 修复、细胞凋亡、细胞死亡或癌变[18]。辅酶Ⅰ的缺乏对不同组织器官影响不同,下文将分器官描述。
2.1.1 脑 NAD+及相关小分子在人体脑缺血、帕金森病(Parkinson’s disease,PD)和神经退行性疾病病程中都有重要的治疗作用。脑缺血症与线粒体NAD+代谢、线粒体动力学和活性氧的产生量之间联系密切,NAD+及相关小分子可以刺激神经元DNA 修复,改善线粒体质量,预防记忆丧失和神经性退行病变。作为NAMPT 产物,NMN 可减轻脑梗死面积、神经功能缺损和神经元细胞死亡从而治疗缺血性中风[21-22]。NMN 治疗还可预防缺血后线粒体NAD+缺失,抑制线粒体碎片,并通过SIRT3 依赖机制减少活性氧的生成,增强超氧化物歧化酶的脱乙酰化和线粒体分裂动力相关蛋白磷酸化[23]。PD 主要由于多巴胺合成不足引起震颤,而由酪氨酸合成多巴胺的过程中需要NAD+作为辅酶。在PD患者中,血浆NAD+水平低,而膳食中补充NA可以使NAD+恢复到健康对照个体的水平,从而改善PD患者的运动和认知功能[24]。
2.1.2 眼 视网膜变性和角膜损伤光感受器对光传导至关重要。NAD+生物合成减少可以引起眼部血管衰减、视神经萎缩、外核层厚度减少和视网膜功能损害。补充NMN 或其他NAD+前体可恢复视觉系统中SIRT1 等蛋白的活性,治疗黄斑变性和视网膜色素变性等眼睛疾病[25]。
2.1.3 心脏 心脏缺血-再灌注损伤的过程中降低了组织中的氧、NAD+和ATP 水平。通过摄入具有维生素B3 活性的化合物可以增加NAD+水平,激活SIRT1,上调NAMPT,减少一些转录因子的乙酰化,缩小梗死面积[26]。
2.1.4 血管 NA具有降低血脂、增加高密度脂蛋白胆固醇的作用,可抑制血管炎症,还可以治疗患者的心血管功能障碍性疾病[27]。
2.1.5 肝脏 酒精性肝病由慢性饮酒引起,乙醇诱导的NAD+缺失参与了乙醇诱导的脂肪变性、氧化应激、脂肪性肝炎等症状的发生。NMN 额外摄入可以维持NAD+水平,恢复乙醇诱导的三羧酸循环代谢物的改变,还能阻止乙醇引起的肝脏损伤性生物标志物水平的升高[28]。
2.1.6 胰脏 糖尿病是由胰岛素抵抗随后产生的胰岛素分泌障碍,近年来,糖尿病的发病率急剧增加,NAD+的代谢在胰岛素敏感性和分泌中发挥着至关重要的作用,eNAMPT 是NAD+生物合成所必需的。该基因突变后导致胰腺NAD+水平下降。此外,NAMPT 抑制剂 FK866 降低了 NAD+水平,并减少了胰腺β-细胞中葡萄糖刺激的胰岛素分泌,而NMN 治疗能改善NAD+生物合成和葡萄糖刺激胰岛素分泌的不足[19]。
2.1.7 肾脏 全球每年约有133 万人患有急性肾损伤。SIRT1 和SIRT3 在保护肾脏免受损伤方面发挥重要作用[29]。NMN 可通过抑制内源性NAMPT、恢复肾脏NAD+和SIRT水平,从而减轻糖尿病肾病肾纤维化[30]。
2.1.8 脂肪 肥胖和糖尿病的发生密切相关。microRNAs(miRNAs)是代谢的关键调节因子,在饮食诱导的肥胖小鼠中,肝脏microRNA-34a(miR-34a)的升高抑制了 NAMPT 和 SIRT1 的表达,进而导致NAD+水平和SIRT1 活性降低。SIRT1 活性的降低导致脂肪增加和炎症发生。肥胖还会导致各种代谢器官发生低度慢性炎症[31]。
2.1.9 皮肤 皮肤健康状况和皮肤癌的发生与体内烟酸水平相关,如糙皮病的特征是太阳暴露区域的皮肤出现红斑疹、角化过度和皮肤纤维化。NAD+缺乏导致人角质形成细胞生长速率降低,凋亡细胞死亡率增加,进一步导致活性氧的形成和DNA 损伤率的增加。通过NA 补充可以恢复NAD+水平,使损伤皮肤康复[32]。
2.1.10 肌肉 随着年龄的增长,骨骼肌中的NAD+水平显著降低。肌肉特异性NAMPT 敲除小鼠也表现出进行性肌肉退化,补充NR 可降低NAMPT 敲除小鼠的年龄依赖性, 而且骨骼肌中NAMPT过量表达可以让小鼠保持运动耐力[33]。
2.2 衰老过程中调控NAD+平衡的分子机制
许多疾病都是由于衰老进程引起的,科学家们将NAD+视为调节机体老化和新陈代谢的代谢振荡器[34]。不同物种中,随着老化程度的增加,NAD+水平显著而稳定地下降[35]。伴随着脂质过氧化和DNA 损伤的增加以及抗氧化能力的下降,脂质氧化和NAD+消耗酶活性也相应增加,最终导致衰老相关疾病[36]。相反,NAD+代谢的上调,包括饮食中补充NAD+合成的前体和中间化合物,已被证明可以防止NAD+代谢的下降,并显示出对衰老和衰老相关疾病的有益作用。NAD+合成和降解之间的平衡决定着机体中的NAD+水平(图4)[5]。

图4 衰老过程中调控NAD+平衡的分子机制Fig.4 Molecular mechanisms that balancing NAD+during aging
2.2.1 DNA 损伤 衰老过程中NAD+水平下降的主要原因是NAD+消耗的增加。PARP 是主要的NAD+消耗酶,它聚集在DNA 单链断裂位点,并通过利用NAD+的自动ADP 核糖基化启动修复过程,持续消耗大量的NAD+。此外,衰老加速了活性氧的产生,从而导致进一步的DNA 损伤[37]。PARP 在NAD+中切断NAM 和核糖之间的糖基键,释放NAM,将释放的ADP核糖单元连接到锚定的靶蛋白上,并在后续的步骤中不断向最初连接的ADP 核糖中添加更多的ADP 核糖单元,从而产生ADP-核糖的聚合物作为翻译后修饰。ADP 核糖基化是一种多功能的翻译后修饰,与许多关键的生物过程有关。ADP 核糖基化促进和调节DNA复制、细胞分裂、转录和信号转导以及细胞对应激、感染和衰老的反应[38]。
2.2.2 慢性炎症 NAMPT 随年龄增长而下降的另一个原因可能是各种细胞应激引起的慢性炎症。众所周知,这些细胞应激会随着年龄的增长而增加,并促进多种代谢组织(如脂肪组织、骨骼肌和肝脏)的慢性炎症。慢性炎症诱导炎症细胞因子的释放,进一步降低了NAMPT 的表达水平。已有报道证明NAD+消耗酶CD38在衰老过程中导致NAD+下降[35]。CD38是细胞内主要的NAD+依赖性ADP 环化酶,可将NAD+降解为环腺苷二磷酸核糖(cyclic adenosine diphosphoribose,cADPR)[39]。随着年龄的增长,CD38 蛋白水平显著升高,导致NAD+消耗量的增加。因此,衰老过程中慢性炎症的增加可能是衰老组织中CD38 基因表达上调的触发因素。合成的cADPR 作为一种信号分子发挥作用,触发细胞内信号级联并导致钙离子升高。CD38 缺陷小鼠能保持较高的NAD+水平,并可预防肥胖和代谢综合症的发生,还可以通过NAD+水平的变化改变Sirtuin等酶的活性[40]。
2.2.3 昼夜节律和microRNA 昼夜节律的恶化被认为是NAMPT 随衰老而下降的原因之一。据报道,CLOCK:BMAL1 是昼夜节律转录因子的核心复合物,通过直接结合NAMPT的启动子区域来调节NAMPT 的表达。同时,SIRT1 也被证明是昼夜节律基因表达的调节因子。事实上,SIRT1 的抑制导致昼夜节律振幅的降低。因此,NAD+和NAMPT 水平显示昼夜节律振荡,通过NAMPT-NAD+-SIRT1 调节放大,衰老可以改变昼夜节律系统的节律质量和幅度,进一步,昼夜节律下降可能会降低NAMPT活性和NAD+水平[41]。
MicroRNA 可以通过调控各种基因表达调节NAD+的平衡。miR-34a 参与了肝脏NAD+随年龄增加而下降的调控过程,miR-34a 通过直接结合到NAMPT 和SIRT1 的3'UTR 区域来抑制它们的基因表达。此外,随着年龄的增长,肝脏中miR-34a 的水平显著升高。肥胖也诱导miR-34a的表达,而过量表达miR-34a 导致NAMPT 水平降低和肥胖。相反,肥胖患者中miR-34a 的沉默可恢复NAMPT 和NAD+的水平,并通过NAMPT/NAD+/SIRT1 的协同作用改善肝脏脂肪的变性、炎症和葡萄糖不耐受等情况[31]。 其他部分microRNAs 也可调节癌细胞中NAMPT 的水平;然而,它们如何参与衰老过程目前尚不清楚[42]。
昼夜节律和microRNA 调控NAD+的靶标基因都是NAMPT,它编码的蛋白可以被组蛋白去乙酰化酶Sirtuin 通过脱乙酰化而激活。Sirtuin 的酶活性直接依赖于NAD+的有效性。它们的活性随着NAD+浓度的增加而增加,而随着年龄的增长,NAD+浓度的降低伴随着NAMPT 和Sirtuin 活性的下降[40]。Sirtuin 还能从表观遗传上调控遗传信息,例如,组蛋白脱乙酰后染色质结构改变;Sir-tuin 还可以作为转录因子直接或间接调节线粒体氧化代谢、抗氧化防御基因等的表达。因此,Sirtuin 活性的下降(例如在NAD+缺乏的情况下)会降低细胞在线粒体中进行氧化代谢的能力[43]。而且这种调节允许Sirtuin直接感知和响应细胞内的NAD+浓度和细胞的氧化还原状态[34]。同时,Sirtuin 与其他NAD+消耗酶(PARP1)共同竞争体内的NAD+,还可以通过去乙酰化直接下调PARP1活性[5]。上述研究均表明NAD+消耗酶(PARP1、CD38 和Sirtuin)相互之间从转录、转录后和翻译后等不同层面上竞争NAD+资源、调控NAD+平衡。
3 展望
综上所述,饮食中的NAD+合成前体及中间化合物(具有维生素B3 活性)对细胞NAD+水平起着核心调节作用。不过,NA 过量可引起血管舒张、胃肠道反应和肝毒性等副反应,有时也会增加患糖尿病的风险[44]。NAM会导致NAMPT明显减少,同时由于驻留时间短、需要较高的给药剂量。相对来说,NMN 和NR 能更有效地提高哺乳动物的NAD+水平[45]。但目前还需要利用甲基化谱、转录组、蛋白质组和代谢组学来研究复杂的NAD+相关网络变化,明确NMN 和NR 的药理作用差异。除了在NMN 和NR 之间做出选择外,还需要更精准的剂量数据和更详细的机理研究来进一步实现对NAD+代谢的整体调控。
此外,NAD+代谢的药理学层面上的激活可以成为促进NAD+代谢的另一个选择。由于NAMPT被认为是NAD+合成的限速酶,它可成为增加哺乳动物细胞NAD+水平的药理学靶点,已有研究发现P7C3 这种可以激活NAMPT 的化合物[46]。尚未发现能够激活NMNAT、其他NAD 合成酶或消耗酶的酶活性的化合物,这些酶的激活剂的开发有望在治疗衰老相关疾病中发挥有益作用。
近年来,NAD+中间化合物的生物合成已经成为保健品、食品原料等领域的研究热点。NAD+合成生物学将工程学和生命科学结合在大肠杆菌中,同时设计利用了其他物种中高效的酶学反应,结合相关化合物的转运,最终可以获得高产量的中间化合物。例如,目前NMN 产量最高的生物合成方法综合了多条NAD+合成途径,首先是在大肠杆菌中提供足够的葡萄糖满足PRPP 高效转化,提供足够的NAM 作为底物;其次选用来自青枯菌(Ralstonia solanacearum)的高活性NAMPT,可以保证NAM 都转化为NMN;最后在大肠杆菌中同时强化两种外排NMN 的活性功能转运蛋白(NiaP和PnuC)使得NMN 排泄到细胞外,最终NMN 的产量可以高达6.79 g·L-1[47]。另外,传统的细菌中从头合成途径的底物是色氨酸,2021 年最新的研究表明在大肠杆菌中还可以创制从分支酸到NAD+的人工合成途径(包含了4 个新基因C3N 途径),完成了从分支酸到喹啉酸的转化[48]。辅酶Ⅰ的深入研究为通过营养代谢调控强化生物体内NAD+水平提供了新的研究思路。
