枸杞水提取物中37种农药残留检测及其风险评估△
2021-08-05甘龙李晨晨薛健潘瑞乐
甘龙,李晨晨,薛健,潘瑞乐
中国医学科学院 北京协和医学院 药用植物研究所,北京 100193
枸杞子为茄科枸杞属植物宁夏枸杞LyciumbarbarumL.的干燥成熟果实,具有滋补肝肾、益精明目等功效,对虚劳精亏、腰膝酸痛、眩晕耳鸣、阳萎遗精、内热消渴、血虚萎黄、目昏不明等有一定的改善作用[1]。作为著名的药食同源物质,枸杞子作为食品补充剂出口至美国、欧洲等地。据统计,枸杞子年平均出口量超过8000 t,涉及105个国家和地区[2]。在我国,枸杞子是重要的保健食品和中成药原料。截至2020年9月,在国家食品药品监督管理局国产保健食品数据库登记注册的16 549种保健食品中,含枸杞子的产品达1645种,约占总数的10%;在中成药处方数据库中,以其作为配方组分的中成药处方超过总量的5.5%。
随着枸杞子需求量逐年增加,其种植面积不断扩大,蚜虫、瘿蚊、实蝇等病虫害对枸杞的危害日益严重[3]。新烟碱、有机磷、拟除虫菊酯等各类农药在枸杞的种植过程中均有使用,这使得枸杞子的农药残留问题日益严重[4]。目前,文献报道使用气相色谱、气相色谱-串联质谱、液相色谱-串联质谱、荧光检测等多种分析手段建立枸杞子药材的农药残留检测方法,并发现其中杀虫脒、多菌灵、克百威等多种农药残留超标的问题[5-11]。
枸杞子直接食用时,最常见的形式是泡茶或水煮煲汤等;作为保健食品或中成药原料时,多采用水提取工艺处理[12]。此外,枸杞子水提取物还作为配方颗粒用于中药复方。然而,枸杞子经水提取后农药残留是被富集还是减少尚缺乏深入研究,对枸杞子水提取物的农药残留检测方法及其膳食暴露风险评估也未见报道。
本研究从《中华人民共和国药典》(以下简称《中国药典》)2020年版规定的禁用或限用农药种类、近5年枸杞子出口美国被美国国家食品药品监督管理局(FDA)自动扣留或退回的枸杞子中涉及的农药种类及文献报道中枸杞子农药残留高频检出或超标的种类中筛选出37种农药,建立枸杞子水提取物的液相色谱串联质谱法(LC-MS/MS)检测方法,并对市场随机购买的有机级、绿色级、无公害级、普通级4种不同等级的枸杞子及其水提取物进行农药残留量检测和风险评估,为枸杞子的食用、药用安全提供参考。
1 材料
1.1 试药
石墨化碳氨基复合固相萃取柱[Carb-NH2,500 mg·(6 mL)-1]、亲水亲脂平衡固相萃取柱[HLB,200 mg·(6 mL)-1]均购于天津博纳艾杰尔公司;37种农药对照品溶液(多菌灵、甲胺磷、涕灭威亚砜、久效磷、涕灭威砜、杀虫脒、3-羟基克百威、涕灭威、甲磺隆、克百威、苯线磷砜、胺苯磺隆、甲拌磷亚砜、内吸磷、特丁硫磷亚砜、三唑醇、甲拌磷砜、水胺硫磷、杀扑磷、虫螨畏、苯线磷、灭线磷、特丁硫磷砜、马拉硫磷、三唑磷、氯唑磷、杀螟硫磷、硫线磷、蝇毒磷、甲基异柳磷、治螟磷、地虫硫磷、甲拌磷、毒死蜱、克螨特、甲氰菊酯、哒螨灵,质量浓度均为100 μg·mL-1,农业部环境保护科研监测所);甲酸、乙腈(质谱级,Fisher公司);蒸馏水(广州屈臣氏公司)。枸杞子为市售商品,具体信息见表1。

表1 枸杞子样品信息
1.2 仪器
LC-20A Prominence UFLCXR型液相色谱仪(日本岛津公司);QTRAP 5500型质谱仪(美国AB Sciex公司);Voterx-5型涡旋混合仪(海门市其林贝尔仪器制造有限公司);DHG-9140A型电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);ME-104E型分析天平(瑞士梅特勒-托利多公司);N-1100型旋转蒸发仪(日本东京理化器械株式会社);2-6型台式低速离心机(上海托莫斯科学仪器有限公司)。
2 方法
2.1 混合对照品溶液制备
分别精密吸取各农药对照品溶液500 μL,置100 mL量瓶中,乙腈定容至刻度,摇匀,密封,-18 ℃避光保存,作为混合对照品母液使用。
2.2 枸杞子提取物制备
参考文献[13]农药残留检测方法,对购买的不同等级枸杞子进行测定,选择测定结果中不含本研究37种目标农药的样品作为空白样品。
取空白样品粉末100 g,加入蒸馏水800 mL,浸泡30 min,加热回流提取1 h,滤过;滤渣复提1次,滤过,合并滤液,浓缩、低温干燥,即得空白枸杞子水提取物(GOJI-kb)。
不同等级枸杞子提取物的制备:分别取不同等级枸杞子粉末100 g,同空白枸杞子提取物制备方法。分别得有机食品级枸杞子提取物(GOJI-a)、绿色食品级枸杞子提取物(GOJI-b)、无公害食品级枸杞子提取物(GOJI-c)、普通食品级枸杞子提取物(GOJI-d)。
2.3 不同前处理方法供试品溶液制备
取GOJI- kb粉末适量,准确加入混合对照品溶液,等量递增法混合均匀,挥干溶剂,制得各农药残留量为20 ng·g-1的加标样品,参考《中国药典》2020年版[14]对不同样品前处理方法[直接提取法(direct extraction)、快速样品处理法(QuEChERS)、分散固相萃取法(dispersive solid-phase extraction,dSPE)、亲水亲脂平衡固相萃取法(HLB SPE)、石墨化碳氨基复合固相萃取法(Carb-NH2SPE)]进行比较及参数优化。
2.4 检测条件
2.4.1色谱条件 色谱柱:Thermo Scientific Hypersil GOLD C18(100 mm×2.1 mm,1.9 μm);柱温:30.0 ℃;流动相:乙腈(含0.1%甲酸,A)-水(含0.1%甲酸,B),梯度洗脱(0~0.5 min,25%A;0.5~4.0 min,25%~30%A;4.0~8.0 min,30%~55%A;8.0~10.0 min,55%~75%A;10.0~15.0 min,75%~95%A;15.0~15.2 min,95%~25%A;15.2~18.7 min,25%A);流速:0.20 mL·min-1;进样量:2 μL。
2.4.2质谱条件 以三重四级杆串联质谱仪检测,电喷雾离子源(ESI),监测模式为多反应监测(MRM);扫描模式:正离子扫描;多反应监测时间窗(MRM detection window):90 s,扫描时长(target scan time):0.9 s,离子喷雾电压(IS):+5.5 kV;射入电压(EP):10 V;碰撞室射出电压(CXP):9 V;离子源温度:550 ℃,雾化气(GS1):344.75 kPa,辅助气(GS2):344.75 kPa,气帘气(CUR):137.9 kPa。各化合物监测离子对、去簇电压(DP)、碰撞电压(CE)见表2。

表2 枸杞水提取物中37种农药质谱信息
3 结果
3.1 样品前处理方法
以加样回收率(60%~120%为合格)、试剂用量、处理步骤等作为评估指标,如表3所示,dSPE合格的农药品种数目最多且分析周期短、试剂用量少,可作为进一步优化的基质净化方法。最终确定的样本前处理方法:将提取物粉碎,过三号筛,精密称取1.5 g,置带盖离心管中,加入蒸馏水10 mL,涡旋混匀后静置30 min,准确加入含1%冰醋酸的乙腈溶液10 mL,涡旋3 min,加入萃取盐包(其中包含无水乙酸钠1 g、无水硫酸镁4 g),涡旋混匀后4000 r·min-1离心5 min(离心半径为11.0 cm),精密吸取上清液5 mL,置于预先装有净化材料(无水硫酸镁600 mg,ODS C18300 mg,GCB 120 mg)的带盖离心管中,涡旋3 min 使充分混匀,净化完全,4000 r·min-1离心5 min(离心半径为11.0 cm),上清液经0.22 μm微孔滤膜滤过,即得。

表3 5种前处理方法不同指标结果
3.2 方法学验证
参考《中国药典》2020年版[14],对2.4、3.1项下所述的样品前处理及检测方法进行方法学验证,37种农药基质匹配标准溶液总离子流色谱图见图1,各农药色谱峰峰形较好。

图1 37种农药基质匹配标准溶液总离子流色谱图
除杀螟硫磷(15%)外,其他精密度RSD均小于6%;重复性RSD均小于10%;除多菌灵(63%)外,其他加样回收率为75%~115%;37种农药在0.001~0.100 mg·kg-1线性关系良好,除杀螟硫磷r为0.975,其他r均大于0.99,满足农药残留最大限度测定要求(表4)。
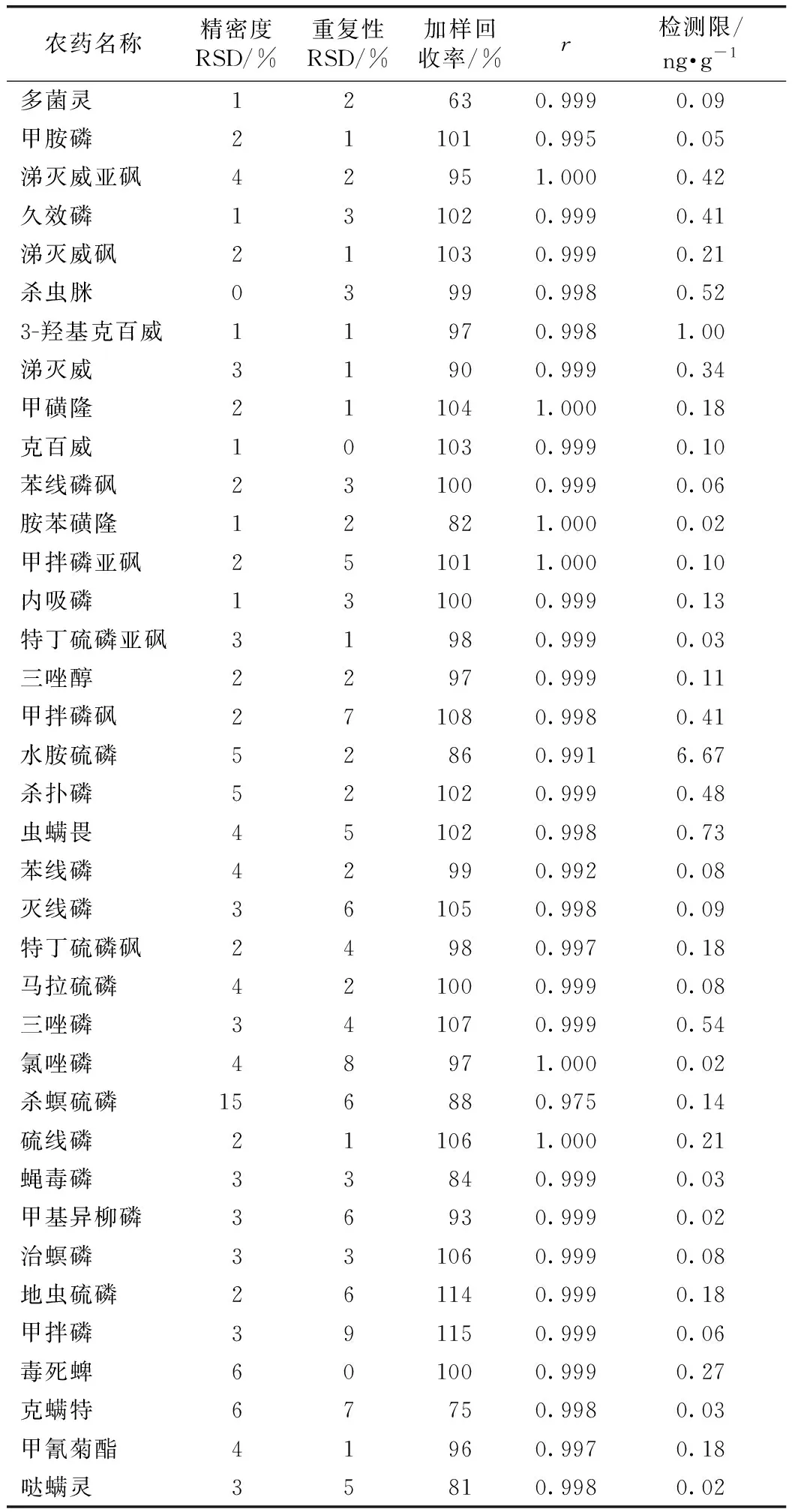
表4 枸杞水提取物中37种农药方法学验证结果
3.3 不同等级枸杞子提取物农药残留量测定
分别将枸杞子水提取物(GOJI-a、GOJI-b、GOJI-c、GOJI-d)按3.1、2.4项下方法进行处理和测定,结果见表5。经水提取后,各提取物中农药残留总量均有不同程度的降低,其中,杀虫脒、甲拌磷亚砜、克螨特均未被检出,但克百威(含3-羟基克百威)的残留量相对于枸杞子有略微升高。不同等级枸杞子农药残留检测结果为参考文献[13]农药残留测定方法,在筛选枸杞子空白药材时测定,结果见表5。
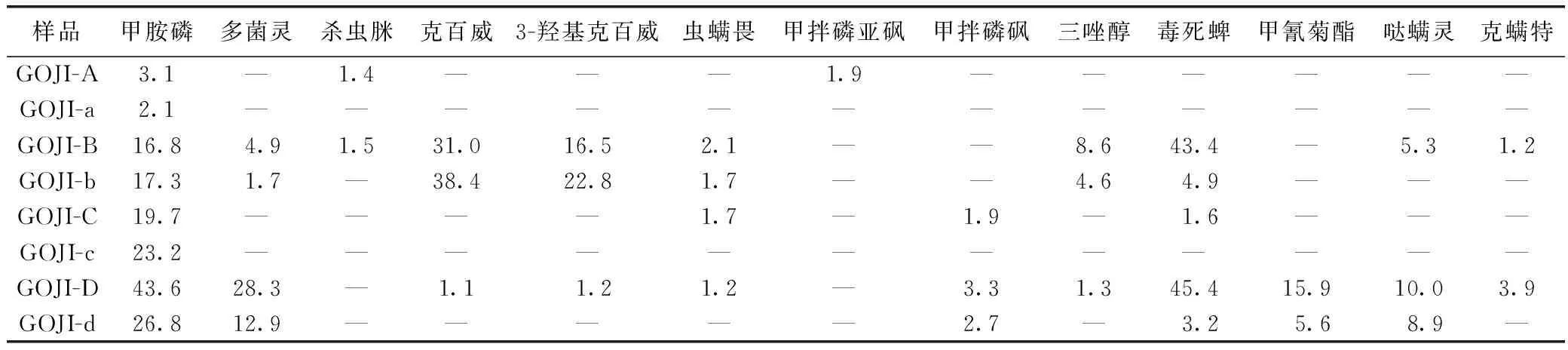
表5 不同等级枸杞子及提取物农药残留量 ng·g-1
3.4 膳食风险评估
膳食暴露评估可以判断食品中各类污染物的风险等级,依据世界卫生组织(WHO)对膳食暴露风险的定义,使用点评估方法作为膳食暴露风险评估方法,即分为急性膳食暴露风险(EXPa)与慢性膳食暴露风险(EXPc),采用参考文献[5]方法计算,急性参考剂量(ARfD)%≤100%说明风险可以接受,ARfD%>100%说明风险不可接受[15];每日允许摄入量(ADI)%≤100%说明风险可以接受,ADI%>100%说明风险不可接受[16]。累计膳食暴露风险值(RQ)≤100%说明风险可以接受,RQ>100%说明风险不可接受。克百威含3-羟基克百威,甲拌磷含甲拌磷砜及亚砜。杀虫脒、哒螨灵、克螨特无ARfD值,采用ADI值进行EXPa计算,虫螨畏ADI值采用ARfD值计算(表6)。对随机购于市面上的不同等级枸杞子及其水提取物农药残留检测后进行风险评估,结果表明,37种农药残留中被检出的13种农药均处于较低的风险水平,其EXPa与EXPc均小于100%,且RQ均小于100%,枸杞子及其提取物膳食暴露风险处于可接受范围。对比不同等级枸杞子,有机食品级膳食暴露风险最小,但RQ与食品安全等级未呈现负相关关系,绿色食品级枸杞子及提取物RQ最高。除绿色食品级外,其余3种级别的枸杞子提取物相较于枸杞子,其RQ均有所降低(表7)。

表6 不同农药膳食风险参考剂量

表7 不同等级枸杞子及其提取物膳食风险评估结果 %
4 讨论
4.1 检测指标的选取
本研究所选37种农药建立枸杞子水提取物农药残留检测品种,主要是基于枸杞种植过程中农药的使用种类、枸杞子农药残留检出种类及相关的法律法规等确定的。根据FDA近5年对我国出口美国的枸杞子自动扣留或退回情况,枸杞子所涉及的农药残留检测品种有多菌灵、杀虫脒、甲氰菊酯。近年来文献报道枸杞子农药残留超标品种,如毒死蜱、久效磷、克百威等,结合《中国药典》2020年版[14]禁用或限用农药种类甲胺磷、甲拌磷、内吸磷等液质检测品种,既满足农药残留检测研究的科学性,也兼顾方法的经济性与普适性。
4.2 仪器检测方法的优化
本研究的仪器检测方法主要基于《中国药典》2020年版[14]及枸杞子药材农药残留检测文献报道[6,13],对色谱条件和质谱参数进行优化。色谱方法主要对流动相初始比例和甲酸体积分数进行微调,选取75%初始水相比例、乙腈(含0.1%甲酸)和水(含0.1%甲酸)为流动相,峰形与分离度较好。质谱条件的优化则以特征离子对选取为主,如在对多菌灵、虫螨畏等的检测时,枸杞子提取物存在不同于枸杞子药材的基质效应,因而采用不同于现有标准及方法的离子对作为定量离子对,以达到最佳的检测灵敏度。同时,由于相同保留时间共流出组分较多,导致一级质谱对母离子的选择性差,采用时间窗(detection window)分段检测模式,可以进一步增强检测的选择性和灵敏度,其检测能力可达十亿分之一浓度级别。
4.3 前处理方法的确定
中药或农产品由于基质复杂,对农药分子在离子源中的电离存在基质抑制效应,使部分农药的检测灵敏度降低,难以达到农药残留最大限度要求的定量限[17]。为了提高分析效率、降低基质效应,同时减少有毒有害试剂的使用,对样本前处理方法的改良和优化是必要的。本研究通过采用直接提取法、QuEChERS法、dSPE及2种固相萃取小柱净化法对样品前处理进行对比研究,结果表明,dSPE农药加样回收率合格率最高、方法简便快捷。通过减少无水硫酸镁的用量、加入GCB等方式改变净化剂的配比和组成,各农药的加样回收率达到测定要求。改良后的方法免去了浓缩步骤,经简单提取、净化、离心即可,适于推广使用。
4.4 枸杞子药材与提取物的农药残留量存在差异
不同等级枸杞子及其水提物的农药残留量检测结果存在明显的差异,水提物中检出的11种农药残留中仅有克百威(含3-羟基克百威)的残留量相较于枸杞子有所升高,杀虫脒、甲拌磷亚砜、克螨特在水提物中未被检出,毒死蜱、多菌灵、甲氰菊酯、哒螨灵、虫螨畏、甲拌磷砜、三唑醇在提取物中的残留量均有不同程度的降低。
查询PubChem数据库所登记的农药理化信息,毒死蜱、多菌灵、甲氰菊酯、哒螨灵、克螨特等在水中溶解度极低(20 ℃,水溶解度<10 mg·L-1),而克百威的溶解度为350 mg·L-1。根据“相似相溶”原则,毒死蜱和多菌灵等很难被水溶出,即不易残留于水提物中,而克百威易溶于水,意味着其易残留于水提取物中。本研究结果表明,毒死蜱、多菌灵等农药在水提取物中均处于极低的残留水平(<0.01 mg·kg-1),然而克百威从枸杞子到枸杞子水提取物的转移率高达91.5%,出现了富集行为,符合其溶解度高的特征。由于克百威属于高毒农药,在膳食暴露风险评估中权重很大,占RQ的96.6%。不难理解,这也是风险评估结果中枸杞子水提物的农药残留种类少和总量虽低,但RQ反而增加的原因。上述结果表明,枸杞子水提取对不同农药残留的溶出及转移率不同,由于提取后去掉了水不溶杂质,使水溶性大的农药残留相对浓度提高,进而影响水提物的安全系数。由于枸杞子等药食同源物质,主要采用茶饮水煮食用,因此加强对克百威等水溶性大的高毒农药的禁用、监管及检测力度是很有必要的。
5 结论
本研究建立了枸杞子水提取物中37种农药残留的UFLC-MS/MS检测方法,该方法简便、经济、快速,可用于枸杞子提取物的农药残留快速准确测定。枸杞子加工制备为水提取物时,农药残留总量呈现降低水平,膳食暴露风险也同步下降,为枸杞子提取物质量标准的研究提供了新的思路与参考。
