制约中成药产业高质量发展的因素分析及对策探讨△
2021-08-05张霄潇
张霄潇
1.中国中医科学院 中药资源中心,北京 100700;2.中国中医科学院 博士后管理办公室,北京 100700;3.中华中医药学会,北京 100029
随着《中共中央 国务院关于促进中医药传承创新发展的意见》(以下简称《意见》)的发布,中医药行业迎来了发展的战略机遇期。中成药产业作为中医药行业的重要组成部分,在面对机遇的同时也存在诸多的挑战。这源于其与现代治理理念不完全适应,或不能完全满足卫生、医保及药品监管等政策的要求。本文分析制约中成药产业高质量发展的因素,并提出对策建议,供行业同仁参考。
1 中成药产业高质量发展的基础
随着社会的进步,当下任何一个产业的高速发展都必须顺应现代社会治理理念并具备良好的工业化基础,否则很难在高度发达的工业文明社会中发展,中成药产业也不例外。
1.1 顺应现代社会治理的理念
现代社会治理正在发生深刻的转变,越来越专业化、标准化、智能化、精细化,越来越强调循证治理,越来越依赖于现代科学技术,具体的法规政策基于大量的研究证据或一系列大数据分析[1]。中医药起源于农耕文明时代,具有农耕文明的一些特点:描述相对宏观或模糊、逻辑关联不强、标准化程度不高等。在中成药方面具体体现为说明书中功能主治宽泛、用法用量不精准等,这与现代社会治理理念是不完全一致的。中成药产业要在现代工业文明时代取得长足的发展,就必须顺应现代社会治理的理念。
1.2 满足医药管理的基本要求
现代社会治理的理念在医药管理领域可以体现在卫生政策、医保政策及药品监管等各个方面,如:卫生部门为提高诊疗效率,促进医疗资源的分工协作、保证治疗效果、按照标准化的思路制定相关诊疗方案、临床路径等,药品是否纳入方案或路径与临床使用量息息相关;医保部门为提高基金使用效率,以药监部门一致性评价结论为基础,通过谈判确定药品支付价格,或以卫生部门的临床路径为基础,制定按病种付费标准。其与药品生产企业的发展和药品临床应用息息相关,其设计都源于现代社会治理理念。因此,中成药产业高质量发展应顺应现代社会治理的理念,满足医药政策基本要求。
2 制约中成药产业高质量发展的主要因素分析
中成药的特点是研发源于中医药理论,但临床应用主要在西医为主的医疗机构,为了满足应用端的需求,应该做到4个“基本清楚”,即物质基础基本清楚、作用机制基本清楚、临床安全性基本清楚、有效性基本清楚。而大量中成药由于历史原因等问题,很难做到4个“基本清楚”,因此,在近期的一系列卫生、医保、药监政策的复合作用下,多数中成药销售或多或少都受到了一定的影响。表现在宏观层面就是中成药产业面临困境。2015—2016年中成药制造业增速分别为5.69%和7.88%,远低于行业平均水平,在医药工业各子领域中增速垫底。据国家统计局数据,近10年中成药总产量整体呈上升趋势,但从2015年开始,增速逐年下降,2018年出现了显著的负增长,较2017年中成药产量下降了31.72%[2]。
2.1 难满足现代治理的要求
随着社会治理理念的变化,对数据、证据的研究在整个治理体系中变得越来越重要,各个领域都以证据为基础制定相关管理制度,而医药领域的循证理念最为深刻。在20世纪70年代,以Cochrane为代表的一些流行病学家通过大量工作,提出在现有的临床诊治措施中,仅有不到20%被证明有效[3]。这使临床医生开始怀疑惯用的诊治方法是否合适,并认识到通过循证医学对这些方法再验证的必要性。因此,在目前医药管理的各个环节都充满了循证医学的理念,如基本药物目录遴选、医保目录遴选、临床指南及路径制定、新药审评审批、生产工艺优化等。目前政策环境下,一旦失去了这些目录或指南的准入,药品临床应用将受到极大的限制[2]。由于历史原因,目前上市的中成药获准上市前多数未开展严格的临床随机对照试验,中成药上市后临床研究起步也较晚,因此相关证据的绝对数量和质量很难与西医药相比,这就是中成药在顺应现代治理方面较化学药或生物药的主要劣势。虽然随着循证医学理念在中医药领域的逐渐深入,中医药循证医学研究取得了长足的进步,仅中医药临床证据数据库系统(EVDS)收录的中医药随机对照试验文献就已达到8万余篇,但是从质量上看,中西医公认的证据较少,改变一线诊疗方案的里程碑式成果不多[3]。这也可能与证据充分是一个相对概念、国家级中医药循证医学机构长期缺位、中医药领域的循证医学研究质量普遍不高等因素相关。
近年来,只有少数中成药的研究得到了普遍的认可,如北京大学人民医院等机构的临床研究证实[4-5],复方黄黛片治疗急性早幼粒细胞白血病可替代三氧化二砷制剂可改善患者预后、提高生活质量、降低医疗费用。因此,复方黄黛片2014年遴选进入《急性早幼粒细胞白血病(APL)中国诊疗指南》,成为一线用药,2017年遴选进入《国家基本医疗保险、工伤保险和生育保险药品目录》,2018年遴选进入《国家基本药物目录》。
2.2 难满足西医临床应用的要求
中成药的研发源于中医药理论,但临床应用大量在西医为主的综合性医院。从目前的现实情况看,中西医理论体系、诊疗思路、评价标准是不完全一致的,西医临床医师首先会参考相关西医方面的临床指南、诊疗方案或临床路径等开展治疗,只有在解决部分特定的临床问题或满足未被满足的临床需求时,会采用中成药(或其他中医干预手段)治疗。而目前已经上市的中成药限于当时的研发条件及医药环境,在研发阶段对临床需求的调研是不充分的,导致目前多数中成药临床定位不清晰,临床价值体现不充分。如针对冠心病西医临床干预手段比较成熟,缓解疼痛可以采用硝酸酯类药物、β受体阻滞剂,预防心血管事件可以采用他汀类药物,动脉粥样硬化导致狭窄程度较高的可以采用介入手术治疗等。同时也存在一些介入治疗后患者的抑郁、稳定斑块、微血管病变等尚待解决的临床问题或未被满足的临床需求,而该类中成药产品大多数适应证都是冠心病心绞痛(或是中医病名胸痹),缺乏具体的临床应用场景。近几年获批上市的中药新药或近期开展系列上市后临床研究的少量中成药在逐步改善这方面的问题,临床定位越来越明确,逐步得到中西医临床专家的共同认可,如三七、银杏类制剂。
因此,近年来临床应用广泛的中成药品种主要是有一定的中医理论内涵,且具备明确的临床定位和临床价值,并被西医临床广泛接受的一些药品,如“络病学说”理论指导下的一系列产品,通过研究阐明了严重危害人类健康的心脑血管疾病及糖尿病、肾病等难治性疾病发病的共性机制是微血管病变,而保护微血管内皮细胞则是治疗微血管病变的核心机制。通过循证医学研究方法开展了大量临床试验,明确通心络胶囊能解决急性心梗无再流问题,芪苈强心胶囊联合标准治疗能明显提高慢性心力衰竭临床治疗效果[6]。
2.3 优胜劣汰的机制尚未建立
化学药和生物药具有代际淘汰的特点,新一代药品一般有效性或安全性高于原药品,形成自然淘汰机制,如质子泵抑制剂与H2受体阻滞剂的关系、各代头孢类抗生素之间的关系。若不形成具体的淘汰,新旧产品的临床应用场景也会形成一定的分化,这也是化学药和生物药研发的原始动力。而中成药领域不存在自然淘汰机制,很少有相同适应证的新药出现即对原药品形成替代,导致中成药品种总数达到9994个,批准文号数达到59 594个。中成药只占医院药品使用份额约20%,但中成药品种数却多于化学药和生物药的总和,见图1。没有自然淘汰机制,理应建立法定淘汰机制,但这方面的政策缺位,生产企业研发和生产能力也参差不齐,导致中成药品种和批准文号不断积累,管理难度增加,甚至有时在药品招标采购领域出现唯低价中标、“劣币驱逐良币”的现象,非常不利于产业发展。2017—2019年有招标信息的品种5792个,涉及批准文号17 466个,分别占中成药品种和批准文号总数的57.95%和29.31%,也就是说42.05%的中成药品种和70.69%中成药批准文号处于“休眠”状态,未生产或上市销售。由于淘汰不力导致大量的休眠品种和批准文号占用管理资源,且有不确定性风险。同时,从宏观产业层面考虑,由于没有良性的优胜劣汰机制,导致优质的产品、优秀的企业难于脱颖而出,引领产业高质量发展反受“劣币驱逐良币”现象的影响,难于快速发展。
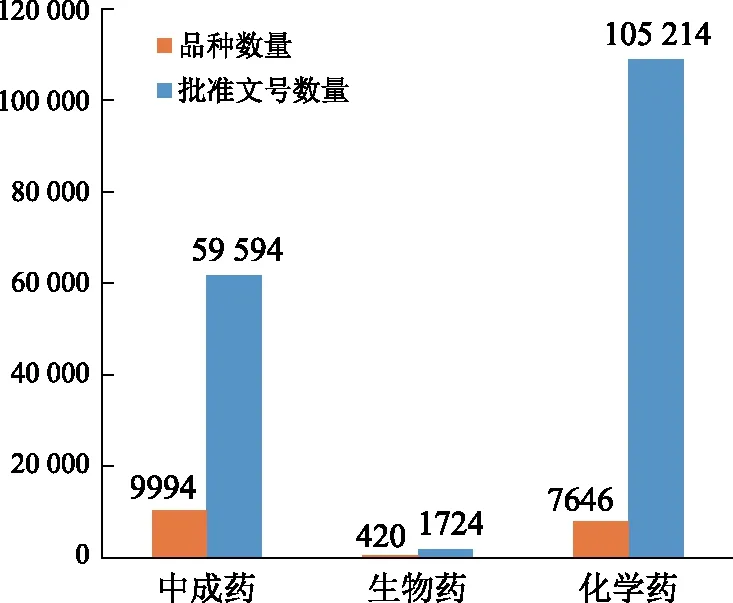
注:品种数量统计时间截至2019年10月;批准文号数量统计时间截至2019年11月;中成药批准文号为国药准字Z和国药准字B;生物药批准文号为国药准字S;化学药批准文号为国药准字H。图1 中成药、生物药和化学药品种数量及批准文号数量情况
2.4 管理协调性不够
中成药产业链条较长,涉及的管理部门有国家发展和改革委员会(以下简称“国家发改委”)、国家医疗保障局(以下简称“国家医保局”)、农业农村部、科学技术部(以下简称“科技部”)、工业和信息化部(以下简称“工信部”)、商务部、财政部、国家税务总局、海关总署、国家药品监督管理局(以下简称“国家药监局”)、国家知识产权局、国家卫生健康委员会(以下简称“国家卫健委”)、国家中医药管理局、生态环境部、自然资源部、国家林业和草原局、人力资源和社会保障部等十多个部门。由于高层次的沟通协调未完全建立,部分政策可能会出现不完全适应的现象,一定程度上制约了中成药产业的发展,如:工业与信息化主管部门支持的生产企业设备更新项目与药监部门对生产工艺优化的相关要求不完全适应;科技部推动的重大新药创制专项与药监部门审评审批要求不完全协调;药监部门批准的中药新药在医保部门的医保目录制定或价格谈判中暂未得到充分支持等。
3 推动中成药产业高质量发展的对策探讨
3.1 加强循证医学方面的研究
按照《意见》精神[7],为了顺应现代治理的基本要求,从行业管理及政策导向的角度将探索建立以临床价值为导向的评估路径,综合运用循证医学等方法加大中成药上市后评价工作力度,建立与公立医院药品采购、基本药物遴选、医保目录调整等联动机制,促进产业升级和结构调整。中成药制药企业若希望取得长足发展,应充分重视循证医学方面的研究,加强中成药临床有效性和安全性方面的评价,明确产品临床定位、临床价值、精准给药方案等,积极发表高水平临床研究学术论文,为临床路径制定、医保支付标准制定、基本药物目录和医保目录遴选等提供研究依据,这是企业发展优胜劣汰的“分水岭”。
在开展研究的同时,应该充分发挥政府或权威学术机构的作用,开展中医药相关临床研究的里程碑式总结。据统计,仅EVDS收录的中医药随机对照试验文献已达到8万余篇,每年开展的中成药随机对照临床研究约2000项,但哪些是里程碑式的成果,哪些应该着重宣传推广(类似“三药三方”的模式)并不清晰。建议充分发挥中国中医药循证医学中心等国家级循证医学中心的作用,按照《意见》精神,筛选中医治疗优势病种、疗效独特的中药品种,聚焦癌症、心脑血管病、糖尿病、感染性疾病、阿尔茨海默病和抗生素耐药问题等,开展中西医协同攻关。加强中国中医药循证医学中心与世界卫生组织(WHO)等国际权威机构的合作,推广中成药临床研究成果,推动中成药进入国际临床指南,进入WHO的基本药物目录,成为中西医共同认可的一线用药,如:青蒿素、三氧化二砷制剂、银杏类制剂、复方黄黛片等。
3.2 建立长效的中成药淘汰机制
目前,我国的药品管理法规还没有对“药品淘汰”进行一个明确的定义,但是有一个基本的标志就是药品批准文号被撤销、吊销等导致产品丧失合法药品的身份。我国也暂无完善的药品淘汰制度,主要是通过自然淘汰或企业主动淘汰的方式淘汰药品,这与美国、日本等国的药品淘汰机制有些差异。但在我国药品监管的历程中,国家相关管理部门曾有利用行政手段淘汰药品的尝试,如《关于公布淘汰127种药品的通知》《关于撤销“红升丹”等768种中成药地方标准的通知》《关于撤销“朱珀宁神丸”等105种中成药批准文号的通知》《关于淘汰第二批128个中成药品种的通知》《关于淘汰第三批105个中成药品种的通知》《关于撤销中药保健药品批准文号的公告(第1号)》《关于撤销中药保健药品批准文号的公告(第2号)》《国家食品药品监督管理局关于撤销炎毒清注射液等品种药品标准的通知》《国家食品药品监督管理局安监司关于拟淘汰部分中药注射剂品种征求意见的函》[8]。
通过对现行《中华人民共和国药品管理法》(以下简称《药品管理法》)及涉及药品淘汰的相关法规的梳理,能实现淘汰中成药的方式只有药品再注册和药品上市后评价。根据《药品注册管理办法》第一百二十六条,只有药品出现规定的9个方面的情形才不予再注册,而且目前药品再注册具体实施在各地方省局,因此,通过该途径淘汰中成药的可行性不高。通过上市后评价建立中成药淘汰机制是最可行的方法,新《药品管理法》第八十三条规定:“药品上市许可持有人应当对已上市药品的安全性、有效性和质量可控性定期开展上市后评价。必要时,国务院药品监督管理部门可以责令药品上市许可持有人开展上市后评价或者直接组织开展上市后评价。经评价,对疗效不确切、不良反应大或者因其他原因危害人体健康的药品,应当注销药品注册证书。”建议国家药品监管部门会同中医药行政管理部门,根据《药品管理法》的要求和中成药产业发展的需求,联合相关管理部门、研究机构和行业组织,尽快建立中成药上市后评价工作委员会或相关机构,分期分批开展中成药淘汰工作。第一阶段应重点针对风险较高的产品,主要可以分为3类:一是造成行业声誉受损的公众质疑产品,如某些虚假宣传的产品;二是不良反应风险较大或获益风险高的产品,如部分高风险中药注射剂;三是特殊类别的产品,如部分研究基础大量缺失的地方标准升国家标准类中成药。
3.3 加强管理的协调性
建议按照《意见》的要求[7],充分发挥中医药各管理部门的积极性,加强部门协调,逐项推进相关工作,促进中成药产业高质量发展,如国家发改委、国家医保局、科技部、工信部、财政部、国家药监局、国家卫健委、国家中医药管理局等部门充分协作,建立常态化协调机制,探索建立以临床价值为导向的评估路径,综合运用循证医学等方法,加大中成药上市后评价工作力度,建立与公立医院药品采购、基本药物遴选、医保目录调整等联动机制,促进产业升级和结构调整;筛选疗效独特的中药品种,针对优势企业优质品种开展产业扶持;制定严谨的《中华人民共和国药典》中药标准,加强飞行检查力度,保证中成药质量可控;建立健全符合中医药特点的中药安全、疗效评价方法和技术标准,实施基于临床价值的优先审评审批制度;鼓励运用新技术、新工艺及体现临床应用优势的新剂型改进已上市中药品种,优化已上市中药变更技术要求。
