基于冠状动脉CT 血管成像定量钙化负荷的可行性研究
2021-08-05邓瑗琳张璋杨帆闫彦李锋坦李东
邓瑗琳 张璋 杨帆 闫彦 李锋坦 李东
冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CHD)简称冠心病,是全球最常见的死亡原因,每年死于冠心病的人数占死亡总人数的近1/3[1]。临床常采用常规冠状动脉CT检查进行评估和诊断,包括心电门控CT 平扫和冠状动脉 CT 血管成像(coronary CT angiography,CCTA)检查。心电门控CT 平扫能够测量标准冠状动脉钙化积分(coronary artery calcium score,CACS,又称Agatston 积分),定量钙化总负荷,是CHD 的独立预测因素之一[2];而CCTA 检查能够评估病人血管狭窄程度。随着CCTA 技术的发展,影像质量逐渐提高,更有利于准确区分管腔对比剂及钙化斑块。本研究拟采用CCTA 检查一站式测量钙化积分并评估血管狭窄程度,并与常规冠状动脉CT 检查进行对比,以期提高冠状动脉的检查效率。
1 资料与方法
1.1 研究对象 本研究回顾性连续纳入2018 年4月—2019 年6 月在天津医科大学总医院行常规冠状动脉CT 检查的1 075 例受试者,男447 例,女628 例,年龄 23~70 岁,平均(56.79±9.49)岁。记录受试者基本临床资料。纳入标准:①年龄≥18 岁;②无常规冠状动脉CT 检查禁忌证;③影像质量符合诊断要求。排除标准:①CACS>1 000;②有冠状动脉搭桥或支架植入史;③先天性冠状动脉异常。
1.2 设备与方法 采用Siemens SOMATOM Force CT 设备。受试者取仰卧位,扫描范围为气管隆突下1 cm 至左膈下2 cm,屏气扫描。心电门控平扫CT 扫描参数:采用横断面连续门控平扫,管电压为120 kV,管电流为80 mA。CCTA 扫描参数:采用CARE Dose 4D 模式,心电门控采集,管电压120 kV,管电流350~650 mA,准直器宽度为 196×0.6 mm,转速 250 ms/r。当受试者心率<80 次/min 时,选用Flash 扫描方式(545 例),扫描时相 65%R-R 间期,螺距 3.2;当受试者心率≥80 次/min 时,选用Sequence 扫描方式(530 例),扫描时相30%~70%R-R 间期。采用高迭代技术进行重建,门控平扫层厚3 mm、层间距3 mm,重建内核Qr36;CCTA 层厚0.75 mm、层间距0.5 mm,重建内核Br36。采用双筒高压注射器经受试者肘正中静脉注射30~50 mL 非离子型碘对比剂碘普罗胺(含碘370 mg/mL,德国拜耳),注射流率4.5 mL/s,随后再以相同流率注射生理盐水30 mL。
1.3 CACS 及体积积分(volume score,VS)的测算 采用钙化评分软件Syngo calcium score(Siemens)计算标准CACS 及VS。观察者首先人工选择含有钙化的动脉节段,软件自动将斑块面积≥1 mm2且CT值≥130 HU 的区域视为钙化并进行标注,然后将不同的钙化斑块密度赋予不同的密度加权因子(density weighting factor,DWF),DWF 赋值 1-4(钙化斑块内最大 CT 值 130~199 HU 为 1;200~299 HU为 2;300~399 HU 为 3;≥400 HU 为 4)。计算单个钙化斑块 CACS:CACS病灶=面积 ×DWF,并对所有冠状动脉中所有钙化病变的评分进行求和,以确定总CACS[3]。VS 为每个钙化病变的体积与数目的乘积,所有单个病灶VS 相加得到总VS。软件自动计算钙化斑块体积及数目,得到标准VS 及各分支动脉的VS(图1A、1B)。冠状动脉分支包括:左冠状动脉主干、左冠状动脉前降支、左冠状动脉回旋支和右冠状动脉。根据测得的CACS 将受试者分成A 组(CACS 为 0 组,581 例) 与 B 组(CACS 不为 0 组,494 例);同时,将测得的CACS 按欧美国家公认的风险预测标准[4]进行心血管病危险度分层,分为无心血管病风险(CACS 为0),低危心血管病风险(CACS 为 1~100 分),中危心血管病风险(101~400分),高危心血管病风险(CACS>400 分)。
1.4 CCTA 钙化积分的测算 将CCTA 影像导入Syngo.via 工作站,在左冠状动脉主干近端勾画约0.1 cm2的圆形兴趣区(ROI),若受试者左冠状动脉主干近端存在严重钙化或管腔严重狭窄,则在右冠状动脉近端勾画ROI。记录ROI 内的平均CT 值与标准差(standard deviation,SD),个体化CCTA 钙化阈值=平均管腔CT 值(HU)+2SD[5(]图1C、1D)。观察者人工选择出含有钙化的动脉节段,软件自动勾画此区域超过CCTA 钙化阈值的体素,并识别为钙化。计算 CCTA 钙化积分(CCTA-CS)与 CCTA 体积积分(CCTA-VS)的方法与CACS/VS 的方法一致。由2 位有心血管疾病诊断经验且工作年限为3 年和6 年的放射科诊断医师采用Syngo.via 工作站软件独立计算各组数据,同时记录血管狭窄程度(轻微狭窄:1%~24%;轻度狭窄:25%~50%;中度狭窄:51%~69%;重度狭窄:70%~99%;闭塞:100%)及斑块特征(钙化斑块、非钙化斑块及混合斑块)。
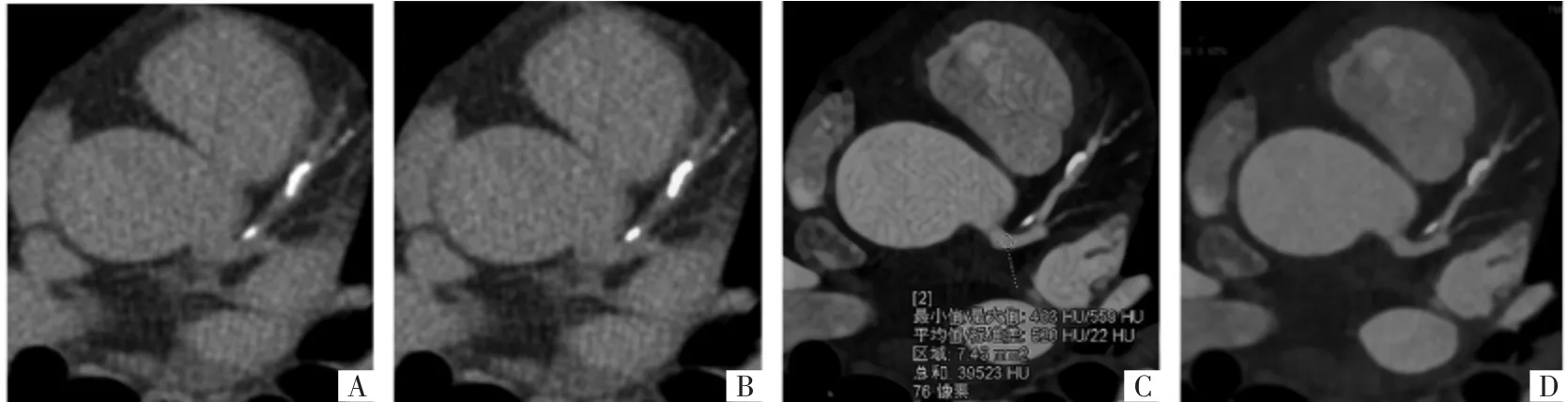
图1 受试者男,57 岁。A 图为门控CT 平扫横断面影像,显示左冠状动脉前降支近端可见冠状动脉钙化;B 图为门控CT 平扫横断面影像,钙化评分软件自动识别CT 值≥130 HU 的区域,测得标准CACS=78.7,标准VS=72.1。C 图为CCTA 增强横断面影像,选取左冠状动脉主干近端的ROI,钙阈值为564 HU。D 图为CCTA 增强横断面影像,使用CCTA 特定钙阈值,软件半自动识别CT 值≥564 HU 的区域,其CCTA-CS=34.6,CCTA-VS=29.1。
1.5 CT 辐射剂量评估 记录2 种扫描技术(CCTA、常规冠状动脉CT 检查)的CT 剂量指数(CT dose index,CTDIvo)l和剂量长度乘积(dose length product,DLP),计算有效辐射剂量(effective dose,ED),即ED=DLP×k,k 为0.014 mSv(/mGy·cm)[5]。
1.6 统计学方法 采用SPSS 23.0 软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,2 组间比较采用独立样本t检验;非正态分布的计量资料以中位数(四分位间距)[M(P25,P75)]表示,2 组间比较采用 Mann-WhitneyU检验,3 组间比较采用Kruskal-WallisH检验,采用Bonferroni 校正法进行事后多重比较。计数资料以例(%)表示,2 组间比较采用χ2检验。对CACS 和CCTA-CS 均不为0的数据进行分析。采用组内相关系数(intraclass correlation coefficient,ICC)评估2 名观察者间及观察者内测量CCTA-CS 和CCTA-VS 的一致性(ICC<0.4 为一致性差,0.4≤ICC≤0.75 为一致性一般,ICC>0.75 为一致性较好)。采用线性相关分析与Bland-Altman 检验分析 CCTA-CS、CCTA-VS 与CACS、VS 的相关性及一致性,线性相关中r2越接近1,其方程拟合程度越好。采用二元Logistic 回归分析 CACS 与 CCTA-CS 临床影响因素。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组受试者基本资料及钙化积分比较 B 组年龄高于A 组,B 组多有高脂血症病史,其 CACS、VS、CCTA-CS、CCTA-VS 均高于 A 组(均P<0.05)。2 组间其余各项指标差异均无统计学意义(均P>0.05)。详见表1。
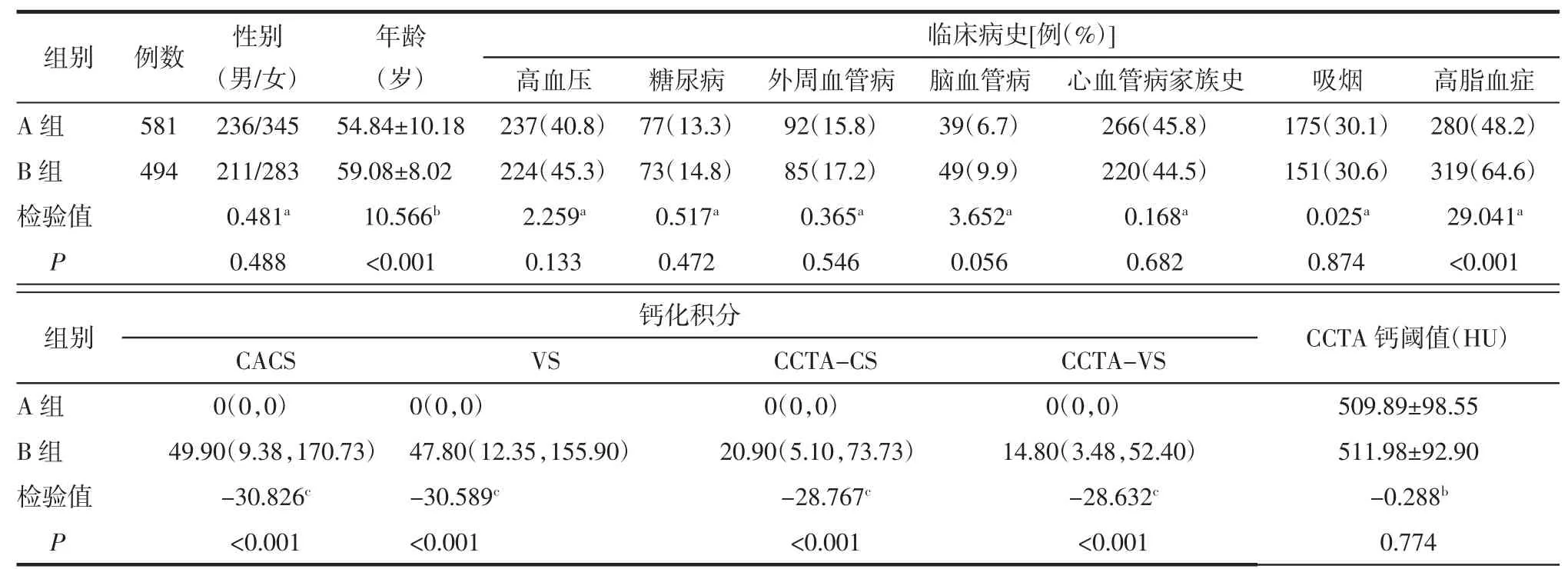
表1 2 组受试者基本资料及钙化积分比较
2.2 2 组的 CCTA-CS 与 CACS 的对照 A 组 581例受试者中,569 例 CCTA-CS 和 CACS 均为 0,其中68 例(约12%)共82 支血管存在斑块(包括11支小钙化斑块、8 支混合斑块、63 支非钙化斑块),呈不同程度狭窄[微狭窄33 支,轻度狭窄43 支,中度狭窄4 支(均为非钙化斑块),重度狭窄2 支(均为非钙化斑块)];12 例受试者 CCTA-CS 不为 0,CCTA-CS 为 0.8~7.5 分,中位评分 1.23(1.03,5.58)分。B 组 494 例受试者中,有 437 例 CACS 和 CCTA-CS均不为 0;57 例 CCTA-CS 为 0,而其CACS 为 0.1~23.3,中位评分 1.05(0.5,2.23)分。
2.3 2 名观察者测量 CCTA-CS、CCTA-VS 的一致性 采用随机数表法从CCTA-CS 和CACS 均不为0 的437 例受试者中抽取100 例,对积分数据进行2 名观察者间及观察者内测量一致性分析,结果显示观察者间及观察者内测得的CCTA-CS 和CCTAVS 一致性均较好,ICC分别为 0.96、0.97 和 0.97、0.97。
2.4 CCTA 钙化积分与标准钙化积分的相关性和一致性分析 437 例病人中,CCTA-CS 与 CACS 的中位评分分别为 25.20(6.90,86.15)、62.10(14.90,180.90) 分,CCTA-VS 与 VS 的中位评分分别为18.40(4.75,61.60)、56.40(16.65,169.10)分。线性相关分析结果显示CACS 和CCTA-CS、VS 和CCTAVS 之间呈较好的正相关(r2=0.98、0.96,均P<0.001),详见图 2。
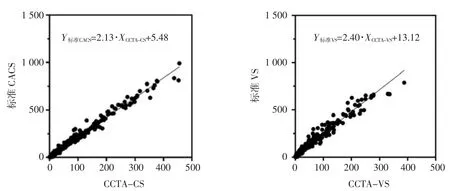
图2 CCTA-CS 及CCTA-VS 与相应标准评分的线性相关分析图
对CCTA-CS及CCTA-VS进行方程校正(Y标准CACS=2.13·XCCTA-CS+5.48、Y标准VS=2.40·XCCTA-VS+13.12)并做Bland-Altman 检验。CCTA-CS 与 CACS 测量差值的95%一致性界限为-40.32~44.14 分,差值均数为(1.91±21.54)分,CCTA-CS 测量结果大部分分布在95%一致性界限范围内,超上、下限范围概率为3.9%。CCTA-VS 与VS 测量差值的95%一致性界限为-44.35~48.02 分,差值均数为(1.84±23.57)分,CCTAVS 测量结果大部分分布在95%一致性界限范围内,超上、下限范围概率为5.9%。CCTA-CS 与CACS、CCTA-VS 与VS 间的一致性较高。详见图 3。
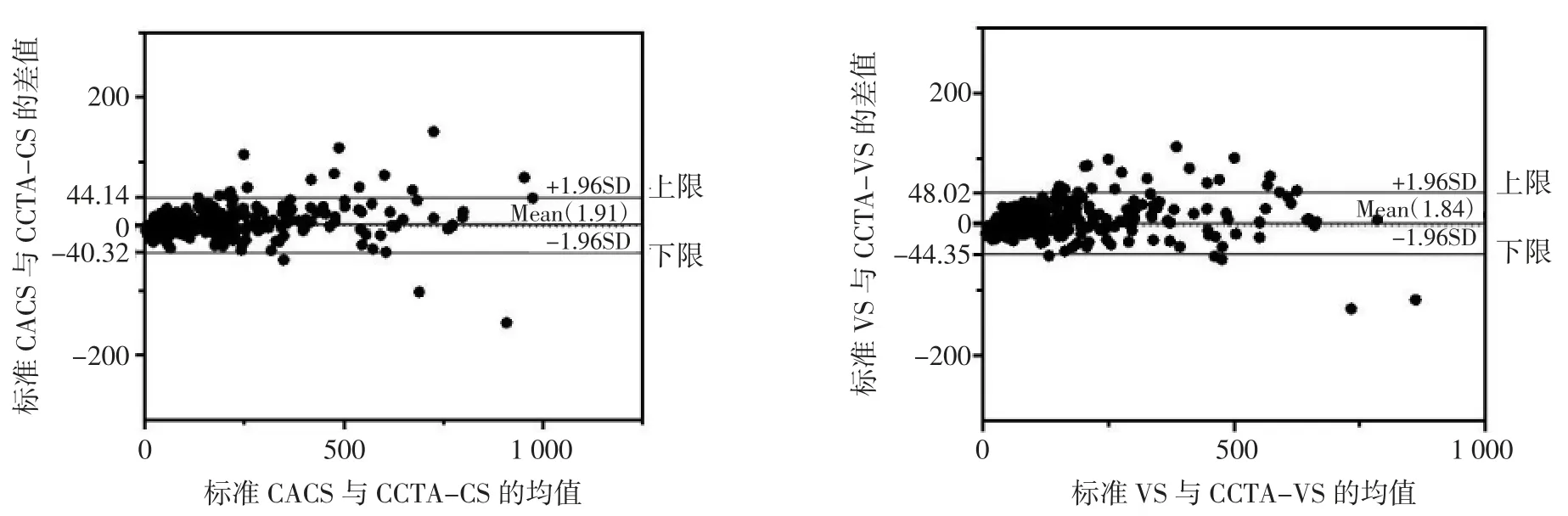
图3 CCTA-CS 与 CACS、CCTA-VS 与 VS 的 Bland-Altman 差值分析图
2.5 不同危险分层受试者的CCTA 积分分析 将437 例受试者根据CACS 进行心血管病危险度分层,其中低危267 例、中危128 例、高危42 例。不同危险分层受试者的CCTA-CS、CCTA-VS 差异均有统计学意义(均P<0.05),与根据CACS 分层的结果相符,见表2。
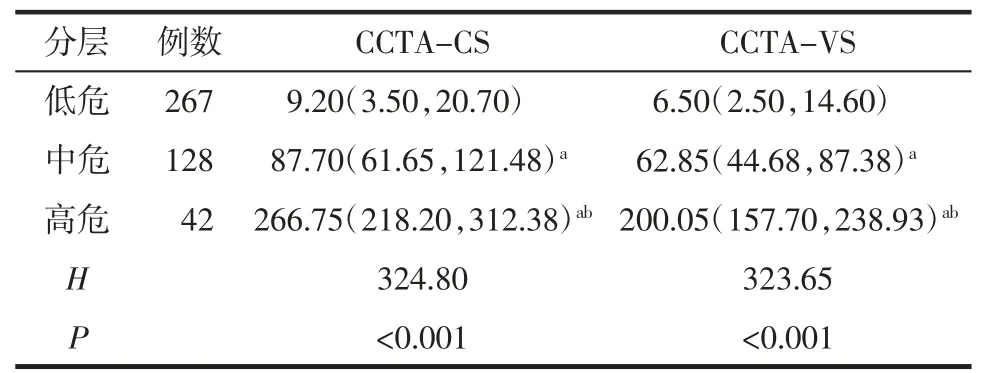
表2 低、中、高危分层受试者的CCTA-CS、CCTA-VS 比较
2.6 影响CS 的冠心病危险因素的Logistic 回归分析 以是否有钙化为因变量,以有无高血压、糖尿病、血脂异常等可能影响冠状动脉病变的因素作为自变量,做二元逐步Logistic 回归分析。结果显示,高血压、糖尿病、脑血管病、吸烟史、高脂血症均为CACS、CCTA-CS 的危险因素(均P<0.05),而外周血管病及家族史不是CS 的危险因素(均P>0.05)。见表3。
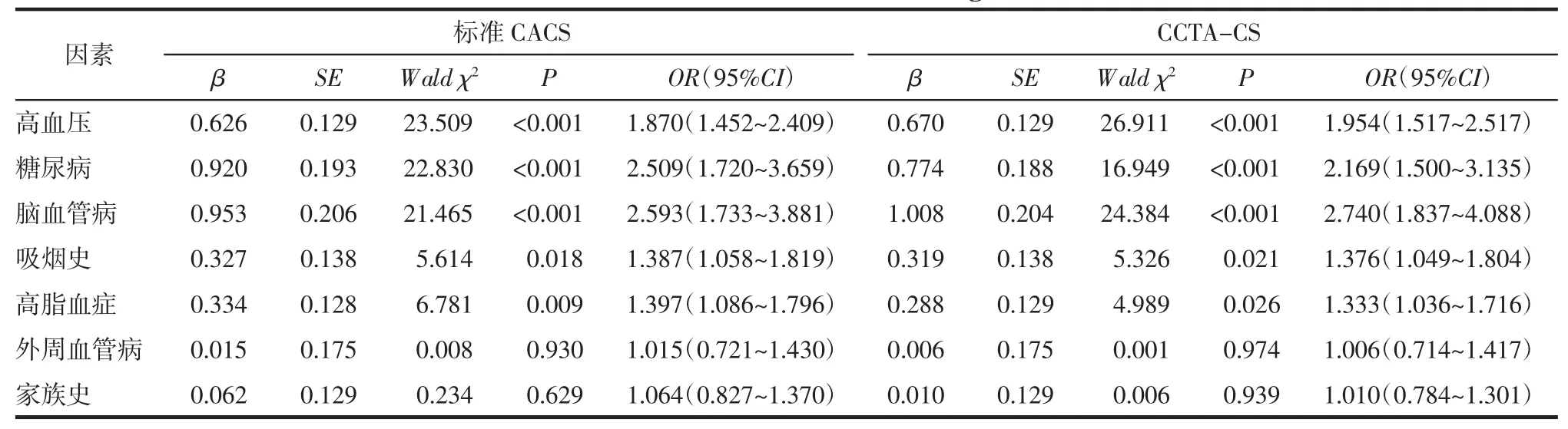
表3 影响钙化积分的冠心病危险因素的Logistic 回归分析
2.7 CCTA 与常规冠状动脉CT 检查的ED 比较 CCTA 与常规冠状动脉CT 检查的ED 相比,Flash扫描可减少 21.2%[分别为(1.49±0.45)mSv、(1.89±0.53)mSv],Sequence 扫 描 可 减 少 18.6%[分 别 为(2.75±1.06)mSv、(3.38±1.19)mSv]。
3 讨论
3.1 CCTA 一站式定量CS 的可行性 在临床工作中,常规冠状动脉CT 检查常在CCTA 之前进行一次心电门控CT 平扫,主要作用是通过测量CACS 来评估病人CHD 危险分层。随着扫描设备及技术的发展,CCTA 影像质量逐渐提高,线束硬化伪影明显减少,使得利用CCTA 直接量化钙化成为可能。Otton等[6]纳入210 例病例首次尝试CCTA 定量钙化,钙阈值设置为320 HU,结果显示CCTA-CS 评分与CACS的相关性为0.99。Mylonas 等[5]对 139 例行 CCTA 检查的病人使用高于对比剂浓度2 倍标准差(SD)作为CCTA 钙阈值,结果显示CCTA-CS 与CACS 间一致性较好(κ=0.93)。Ahmed 等[7]使用基于自动模型的图像处理算法,生成了冠状动脉管腔中心的CT值参考线,将CT 值高于此参考线的区域全自动识别为钙化并计算积分,结果显示自动计算出的CCTA-CS 与 CACS 的相关性较好(r=0.949)。上述研究结果均表明在CCTA 中定量钙化是可行的。起初Agatston 等[3]的研究使用130 HU 作为识别钙化的阈值,其阈值也是依据高于心肌2 倍SD 而得出的。而本研究依据Mylonas 等[5]的方法,选择高于左冠状动脉近端对比剂平均CT 值的2 倍SD 作为钙阈值,这样可以将约97.5%的对比剂影像排除,尽可能精准地识别钙化斑块。这种使用“个体化钙阈值”的方法可以显著减小不同管电压、管电流及扫描设备对钙化CT 值的影响。本研究样本量较以往研究明显增多,且新引入了与体积积分间的比较,测得的CCTA-CS、CCTA-VS 与标准积分间亦存在相关性。此外,本研究发现CCTA-CS 与CCTA-VS 的观察者间与观察者内一致性较好,进一步表明本研究方法是可靠的。
3.2 CCTA 一站式定量钙化积分的准确性 CACS分数较高时,钙化通常具有相同的特点(即弥漫性钙化、多支血管受累),而这类病人的危险分层并不会改变临床治疗决策[8-10],且临床中更关注这类高风险人群血管狭窄程度而非斑块负荷,因此在本研究中排除了CACS>1 000 的病例。本研究结果发现CCTA-CS、CCTA-VS 与 CACS、VS 有较好的相关性,相关系数可达到0.96 以上,且经方程校正后的CCTA 钙化积分与标准积分间一致性界值范围为-40.32~44.14 分、-44.35~48.02 分,且绝对差异随着CACS 的增加而增加。而Mylonas 等[5]的结果显示界值范围在-147.9~216.1 分,这可能是由于本研究未纳入CACS>1 000 的病例,故平均差值较小。然而,由于本研究中设定的钙阈值较高,导致CCTA-CS、CCTA-VS 数值会普遍低于标准积分,这与其他研究[5-7]的结果基本一致。另外,由于钙化和对比剂的CT 值会存在高度重叠,使得无法区分对比剂及微小钙化,因而出现少部分漏诊,即出现57 例CACS 不为 0 而 CCTA-CS 为 0 的病例。在 Ahmed 等[7]的研究中也出现类似的问题,验证组中约33%的病人被错误分组,其中10%转至较高风险组,23%转至较低风险组。然而,本研究没有遗漏较大的钙化斑块,因为在57 例受试者中,CACS 的中位数仅为1.05 分。
在本研究中,有 12 例 CACS 为 0 而 CCTA-CS 不为0,即在CCTA 中发现了少量微钙化。微钙化发生在动脉粥样硬化的早期阶段,它可能导致斑块不稳定并引发心血管事件[11]。本研究出现此类现象的原因主要是门控CT 平扫层厚较厚,通常为3 mm,可能会导致钙化与其他病变部分体积平均化,钙化CT 值降低而未能计入评分,而CCTA 层厚更薄,通常为0.75 mm,故可以更敏感地发现这类微钙化。另外,在CACS 与 CCTA-CS 均为0 的569 例受试者中观察到了非钙化斑块引起管腔不同程度狭窄的病例,非钙化斑块被认为是早期冠状动脉粥样硬化的表现[12],且与急性冠状动脉综合征密切相关。有研究[13]报道39%的急性冠状动脉综合征病人的CACS为0;而且在64 层螺旋CT 冠状动脉血管成像的多中心实验(CORE-64)[14]中也发现在狭窄程度>50%的病人中有20%病人的标准CACS 为0。综上,利用CCTA 直接定量钙化可以及时观测到这类CS 阴性的病人可能存在的危险斑块,并提醒临床关注。
3.3 CCTA 一站式定量CS 的意义 CACS 的优势是对心血管风险的预测有一定的价值,根据所处风险级别对病人进行临床决策管理。本研究中不同风险分层受试者的CCTA-CS 与CCTA-VS 均有明显差异,与CACS 分层结果一致,表明CCTA-CS、CCTA-VS 可以有效判断病人所处的风险类别。多项研究[15-18]表明高血压、糖尿病、脑血管病、高脂血症、吸烟史等是CACS 的独立影响因素。本研究结果显示,上述临床因素亦是CACS、CCTA-CS 的独立影响因素,也从一个方面说明CCTA-CS 有潜力代替CACS 应用于临床实践。
目前许多技术成功降低了CCTA 的辐射剂量,例如大螺距扫描、迭代重建、降低管电压等,而门控CT 平扫通常仍采用120 kV 的固定扫描方案,使得其在检查中所占的辐射剂量比重较前显著增加。如何在保持CACS 预测价值稳定的情况下降低检查的整体辐射剂量,是实际临床工作中面临的主要技术问题。本研究中提出的一站式CCTA 测量钙化积分的方法恰好可以直接避免了门控CT 平扫扫描,精简了扫描流程;本研究还发现临床最常见的2 种CCTA 扫描方式测量钙化积分均可减少ED,其中Flash 扫描可减少ED 21.2%,Sequence 扫描可减少ED18.6%。
本研究尚存在一些局限性。首先,本研究是一项回顾性单中心研究,从CCTA 中获得精准的钙化评分可能需要特定的校正因子,该方法还必须进行大型的多中心研究来验证其结果的普适性;其次,本研究未探讨CACS 与管腔狭窄、血流动力学改变之间的关系。
CCTA 一站式直接定量钙化斑块具有较高的重现性,其与标准积分也有较高的相关性,该方法有效降低了ED,并可同时预测不良心血管风险和评估血管狭窄程度。
