中枢神经系统肿瘤的MRI 影像标注专家共识
2021-08-05中国医师协会放射学分会互联网影像学组
中国医师协会放射学分会“互联网+”影像学组
中枢神经系统(central nervous system,CNS)肿瘤是危害公众健康的主要病种之一,2016 年华盛顿大学对全球CNS 肿瘤的统计显示,我国是全球CNS肿瘤新发病例及死亡人数最多的国家[1]。最常见的CNS 肿瘤包括原发性CNS 胶质瘤、原发性CNS 淋巴瘤、转移瘤等,以及一些脑膜起源或神经起源的颅内脑外肿瘤(如脑膜瘤、血管外皮瘤、神经鞘瘤等)。胶质瘤、原发性CNS 淋巴瘤、转移瘤共占颅内恶性肿瘤的近90%。其中,脑胶质瘤具有高致死率和致残率的特点,是40 岁以下男性和20 岁以下女性癌症死亡的首要因素[2],在老年人群发病率也逐渐增加。CT 和MRI 检查是诊断和评估CNS 肿瘤最重要的检查手段,在临床诊疗工作中被广泛用于脑肿瘤的术前、术中、术后评估。但是,传统影像始终受到人力资源、医生经验和视觉观察的限制,如何更加精准地定位、定量和定性诊断CNS 肿瘤,尤其脑恶性肿瘤,是临床工作中一直面临的挑战。
近年来,人工智能(artificial intelligence,AI)技术迅速发展,并已在多种疾病的诊疗中体现出独特优势,其能够更快地定位、更准地定性病灶[3-5]。AI 在CNS 中也已开展了多方面的研究,包括在MRI 影像上利用机器学习对CNS 病变进行自动分割,利用AI对CNS 肿瘤进行分类诊断和治疗预后的评估等[7-12]。这些研究基本都需要以医生的人工标注作为参考[13]。数据标注的质量、标注结果的优劣直接决定了模型的效能,而不同地区、不同研究所使用的采集数据和标注方式不尽相同,在很大程度上限制了AI 模型的推广及验证。
为了规范化CNS 肿瘤数据标注,中国医师协会放射医师分会“互联网+”医学影像专委会联合业内影像医学、计算机科学和AI 商业团队的专家对CNS 肿瘤的MRI 标注提出初步指导意见,旨在统一数据采集及标注规则,从而提高模型的泛化性,促进AI 模型的优化、验证及推广。
1 定义及分类
本文所述CNS 肿瘤包括常见的脑实质起源肿瘤和脑膜起源肿瘤,以原发性CNS 胶质瘤、原发性CNS 淋巴瘤、转移瘤,以及脑膜瘤、血管外皮瘤等脑膜起源肿瘤为例进行说明。脑内肿瘤在MRI 中具有共性的影像学表现,在T1WI 上呈低信号,T2WI 和液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列上呈高信号,但是由于具体肿瘤的病理类型、细胞成分的异质性(如囊变、出血、钙化等)也会造成在各个模态上的信号变化。注射对比剂增强后,大部分肿瘤实体部分可呈明显强化,病灶周围可见水肿;但少部分肿瘤(如低级别胶质瘤)增强后看不到明显强化。脑膜起源肿瘤为颅内、脑外肿瘤,结合MRI 多个模态可看到肿瘤与脑实质分界,增强后肿瘤实体及邻近脑膜明显强化。不同病理类型、不同组成成分的肿瘤在MRI 可见到囊变、钙化等引起的信号变化,及其邻近脑实质水肿。
本共识以颅内病变为主。对于侵犯邻近骨质或颅内外穿通的肿瘤在本共识中不作讨论;对于起源于鞍区、松果体区和桥小脑区等脑外肿瘤,也暂不在本共识中讨论,但可参考本共识内容加以细化。
2 影像采集规范
2.1 影像质量规范 影像质量规范参照《“互联网+”医学影像诊断中国专家共识(2019 版)》[14]。依据影像质量标准分级为:1 级,影像显示模糊,具有明显的运动伪影、线束硬化伪影或可去除的体外金属异物伪影,不能达到诊断要求;2 级,检查部位软组织或骨骼结构可分辨,有少许伪影,但不影响诊断;3 级,软组织结构清晰分辨,对比良好,无伪影,可明确诊断。影像获取标准:①获取的影像符合MRI 检查操作规范,选择合适的线圈、成像方位、序列及成像参数,参照《放射科管理规范与质控标准(2017 版)》执行。②影像能满足诊断的需要,扫描范围、对应检查部位内的结构显示清晰。③影像的大小及灰度适中,成像部位的结构与背景对比良好,无明显阶梯伪影、卷褶伪影、运动伪影及设备/异物引起的伪影,或即使有少许伪影也不影响诊断的准确性。④影像质量必须达到2 级或3 级。
2.2 序列要求 针对CNS 肿瘤,主要包含以下成像序列:①T1WI 序列,矢状面或横断面,二维或三维采集。②T2WI 序列,横断面,二维或三维采集。③FLAIR 序列,矢状面或横断面,二维或三维采集。④DWI 序列,重建的表观扩散系数(apparent diffusion coefficient,ADC)影像,横断面二维采集,b=800(1 000)s/mm2。⑤T1WI 增强序列,即 Gadolinium 增强后T1WI 影像,矢状面或横断面,二维或三维采集。⑥上述5 种序列三维采集的层厚≤2 mm,二维采集的层厚≤6 mm,层间距≤2 mm。其他序列不在本共识讨论的标注范围。
3 数据格式、标注工具和人员资质要求
3.1 数据要求 ①数据安全。数据使用需通过伦理委员会批准,并且在使用前进行数据脱敏,保证病人信息不被泄露。②数据完整。建议使用标准DICOM 格式的原始数据,保证数据无损传输,满足放大缩小、窗宽窗位调整等不失真,影像浏览无缺层或错层等。③数据规范。数据扫描参数及采集流程需符合临床规范。
3.2 标注工具 目前可使用的开源软件标注工具主要包括 3D slicer、MITK、ITK-SNAP 等。标注结果应以公开、可读取的格式保存,如 Nifity(nii)、DICOM等。标注结果与原始数据需一一对应,建议按照病人序号及序列进行命名保存(病人序号+标注序列+标注内容),便于查询及使用。
3.3 标注医生 ①人员资质:标注人员,具有5 年及以上临床或影像医学工作经验的高年资住院或主治医师;审核人员,具有10 年及以上工作经验的副主任医师或主任医师。对标注及审核人员需进行统一培训,应强调标注规范,减少个体差异;培训后进行考核,检查标注者间的一致性。②审核要求:为了保证标注影像的质量,需建立相对稳定的标注团队、统一的标注规范。标注医师完成标注后,需由审核医师再次确认,对于不符合要求的结构进行修改或重新标注。③评估办法:在培训阶段,建议由2 组标注团队的医生共同完成同一批影像的标注,以便于进行一致性评估,评估达到优秀及以上则可进行后续标注工作。
4 脑内肿瘤标注内容
结合实际临床工作经验,并参照医学影像计算和计算机辅助干预国际会议(International Conference on Medical Image Computing and Computer Assisted Intervention,MICCAI)举办的多模态脑肿瘤分割挑战赛(The Multimodal Brain Tumor Image Segmentation Benchmark,BRATS)的肿瘤分割标准[15-16],建议将脑内肿瘤分割为以下几个部分:①“全肿瘤区域”,主要在FLAIR 影像上进行勾画,包括肿瘤瘤体及肿瘤周围水肿。大部分脑肿瘤在FLAIR 上呈现明显的高信号,可通过抑制脑脊液信号将肿瘤与脑室或其他含水结构区分开来。②肿瘤瘤体部分,可在T2WI 上进行勾画,覆盖肿瘤的瘤体区域(去除水肿部分)。肿瘤瘤体相对于周围水肿呈低信号,在T2WI 上较容易分辨。对于少部分瘤体与周围水肿难以区分的情况,建议结合FLAIR、T1WI 和T1WI 增强序列多层面、多维度观察,以确定其边界。③肿瘤强化区域,主要在T1WI 增强序列上进行勾画。通过T1WI 增强序列与T1WI 平扫序列的对比,观察注射对比剂后信号明显升高部分。④肿瘤非强化区域,即T1WI 增强序列显示的肿瘤瘤体内无强化的区域,包括肿瘤实性无强化部分,肿瘤内发生坏死、囊变或出血的部分。由于部分肿瘤成分的异质性,建议根据具体研究需求调整标注区域。可以把肿瘤强化区域与非强化区域作为整体来分析,见图1-3。
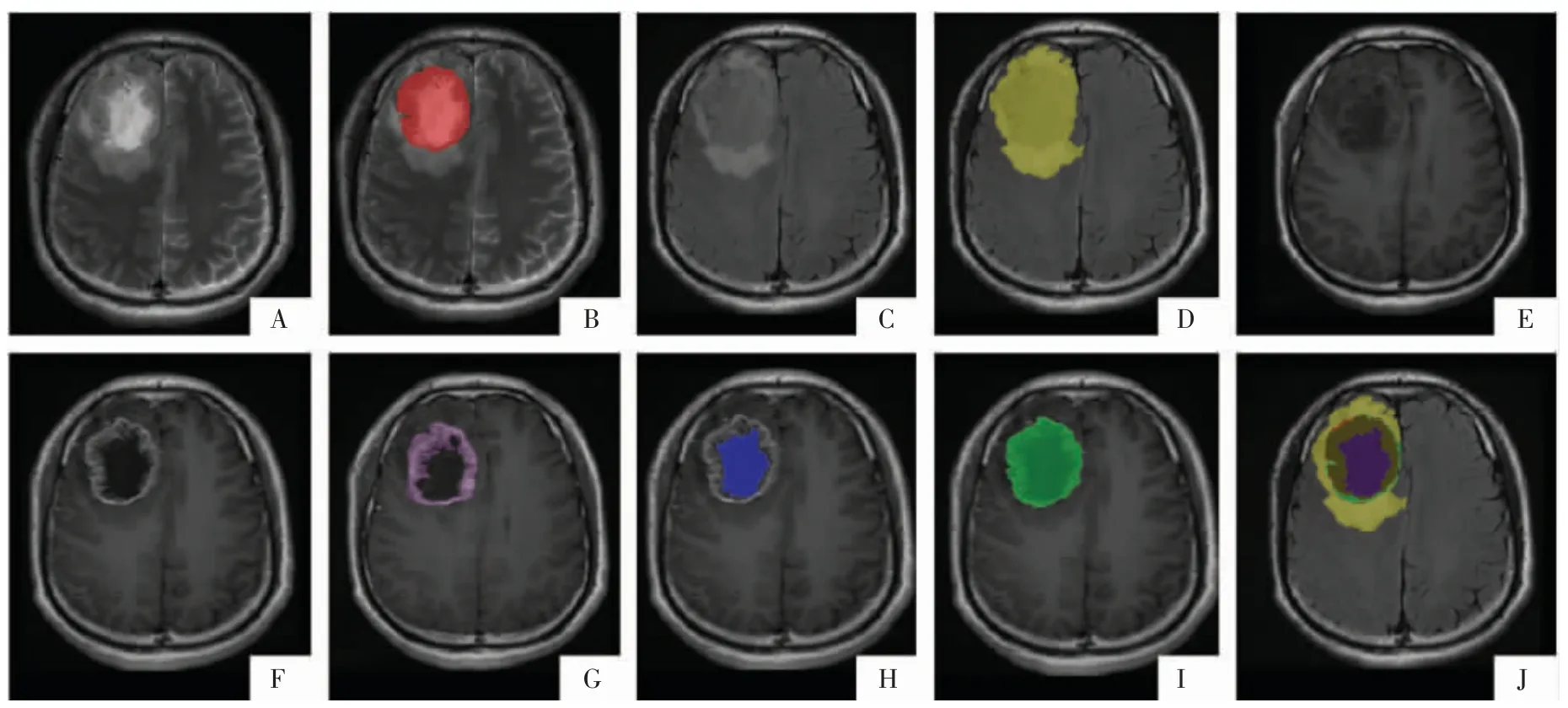
图1 胶质瘤标注示例。胶质母细胞瘤,右侧额叶肿瘤呈花环样强化,瘤内坏死囊变增强后无强化。A、B 图为T2WI 序列及标注的肿瘤瘤体(红色);C、D 图为 T2-FLAIR 序列及标注的全肿瘤区域(黄色);E 图为 T1WI 平扫序列;F 图为 T1WI 增强序列;G、H图为标注的肿瘤强化范围(紫色)和肿瘤非强化范围(蓝色);I 图为G 图与H 图叠加影像;J 图为所有标注区域融合影像。
5 脑膜起源肿瘤标注内容
脑膜起源肿瘤的标注范围与脑内肿瘤基本相同,包括“水肿区域”、肿瘤瘤体部分、肿瘤强化区域、肿瘤非强化区域。需要注意的是,脑膜起源肿瘤为脑外肿瘤,一般与脑实质有明显分界,因此这里仅标注“水肿区域”,即脑实质在FLAIR 上的高信号范围,不包括肿瘤的瘤体部分。对于明显增厚强化的脑膜应视为强化肿瘤的一部分,包含在肿瘤强化区域的标注范围内(图4)。
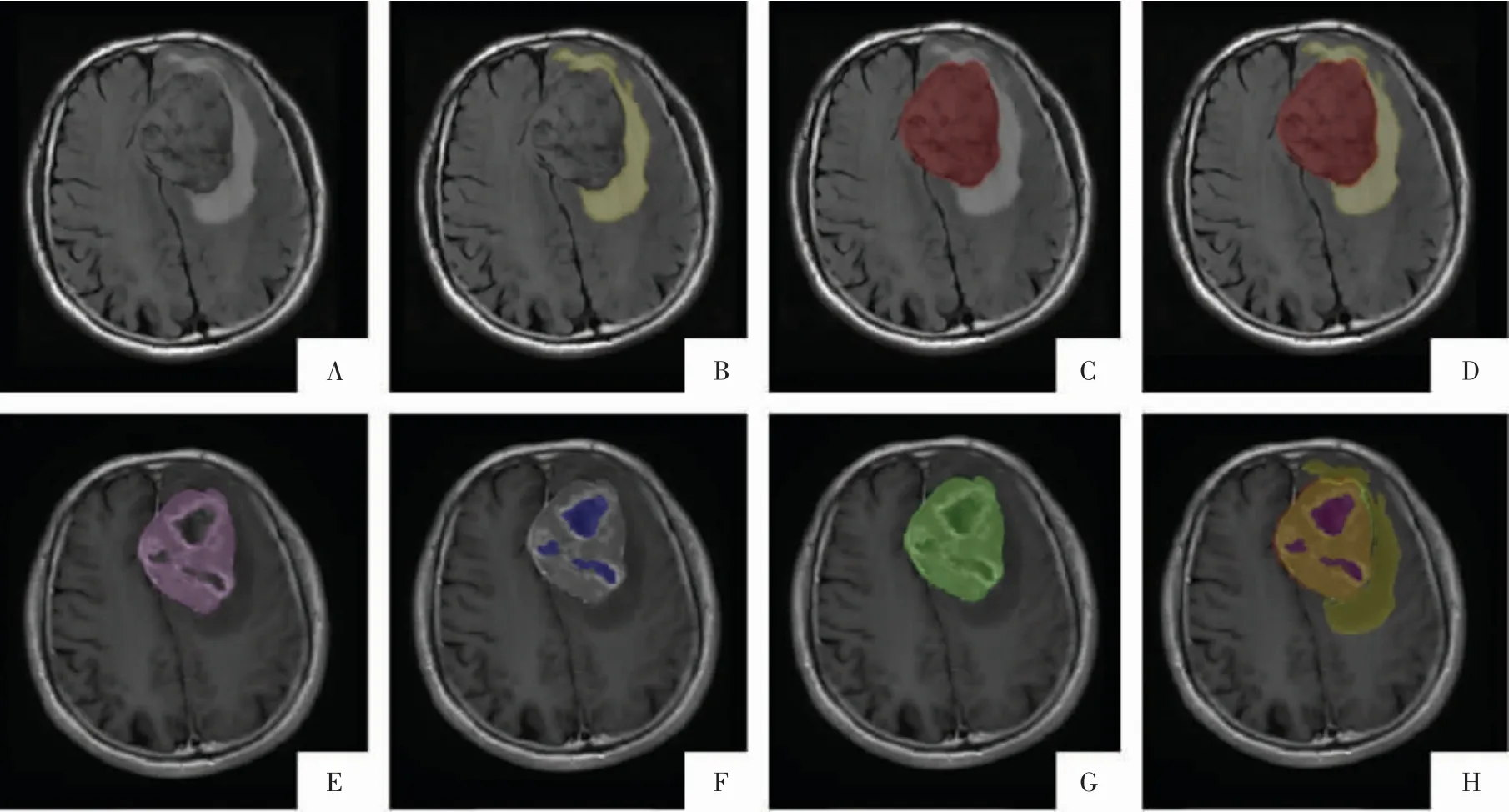
图4 脑膜瘤标注示例。左侧额部脑膜瘤,增强后肿瘤明显均匀强化,边界清楚,对强化区域进行勾画。A-C 图依次为T2-FLAIR序列、水肿区域(黄色)、标注的肿瘤瘤体(红色)。D 图为B 与C 图的叠加影像。E、F 图为肿瘤强化区域(紫色)、肿瘤非强化范围(蓝色)。G 图为E 与F 图的叠加影像。H 图为所有标注区域融合影像。
6 标注原则与策略
标注前需要结合多个序列、多个扫描层面,明确解剖结构,确认病变的位置、大小、形态、成分等相关信息后逐层进行标注。①充分认识解剖学结构,标注时要避开脑沟、脑室等正常组织,准确勾画病变范围。②充分认识CNS 影像学表现,特别是对水肿区域标注时要明确区分脑肿瘤水肿范围,不要将脑白质疏松、腔隙灶等误标为水肿。③首要完成全肿瘤区域以及增强区域的标注。由于肿瘤组成复杂,常出现坏死、钙化、出血、血管流空等复杂信号变化,导致边界无法明确,从而对精准标注产生极大影响,因此对于肿瘤瘤体和肿瘤非强化区域标注,可根据研究的实际需求而定。④对于边缘清晰的病变,首先根据其解剖结构确认病变与周围组织边界,然后沿肉眼可见的病变边缘逐层勾画。遇到与周围组织分界明显的病变,可使用软件并根据阈值设定等方法进行半自动标注,再结合手动调整。⑤对于边缘模糊的病变,需进行对比度调整。勾画明确的病变组织范围,剔除模糊或无法确认的部分。也可使用软件根据阈值设定等方法进行半自动标注,再手动剔除明确为非病变的区域。⑥对于多发病灶,遇到转移瘤、淋巴瘤、多发胶质瘤等颅内多发病灶,先浏览所有层面,建议标注所有所见病灶(图5、6)。⑦所有标注建议在横断面原始扫描图像上进行,不建议使用后处理重组影像。对于二维或三维影像选择以及是否在矢状面、冠状面标注,则根据不同研究目的自行把握。⑧标注需要逐层进行,特别是不要遗漏肿瘤首、末层,建议完成标注后自检,避免漏标或错标。
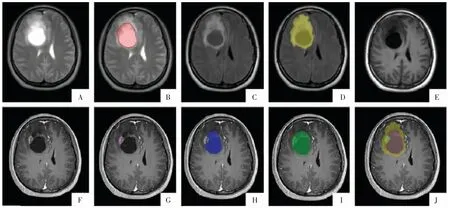
图2 胶质瘤标注示例。肥胖型星形胶质瘤,右侧额叶肿瘤呈部分强化,肿瘤非强化区域内有囊变坏死区域和肿瘤实性无强化区域。A、B 图为 T2WI 序列及标注的肿瘤瘤体(红色);C、D 图为 T2-FLAIR 序列及标注的全肿瘤区域(黄色);E 图为 T1WI 平扫序列;F 图为T1WI 增强序列;G、H 图为标注的肿瘤强化范围(紫色)和肿瘤非强化范围(蓝色);I 图为G 图与H 图叠加影像;J 图为所有标注区域融合影像。
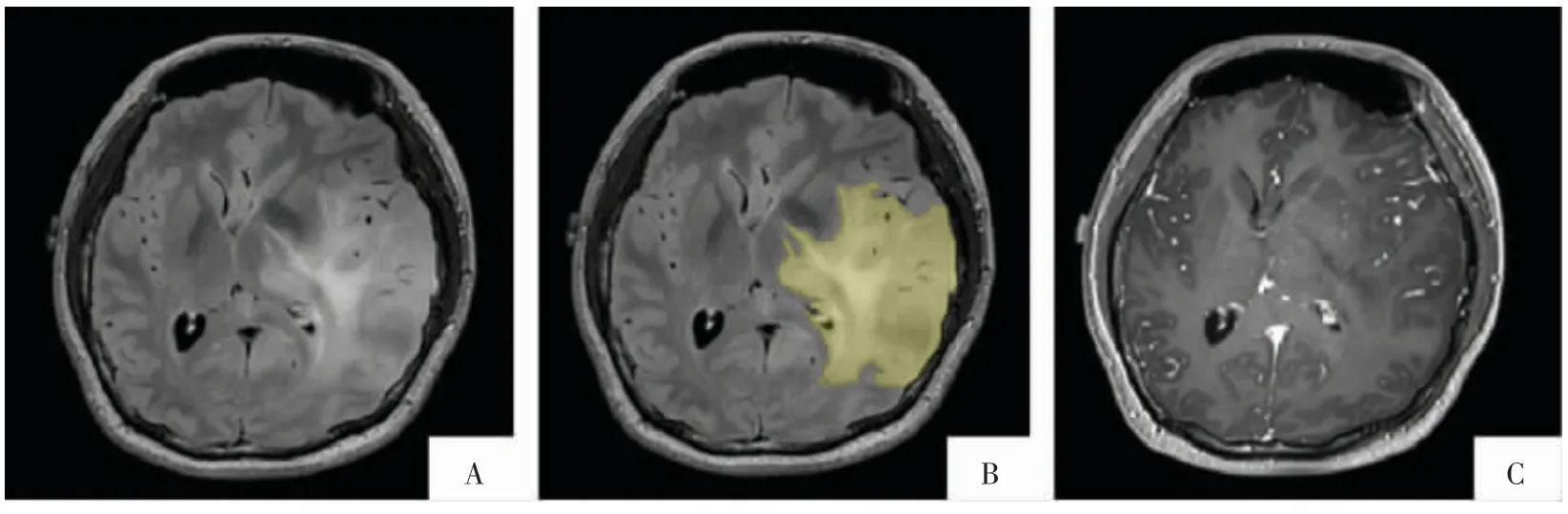
图3 胶质瘤标注示例。间变性星形细胞瘤,左侧颞叶肿瘤的边界与周围正常结构分界模糊,只对明确为病变组织的范围进行勾画,剔除模糊或无法确认的部分。增强后病变区域未见明确强化的不予标注。A、B 图为T2-FLAIR 序列及标注的全肿瘤区域(黄色);C 图为 T1WI 增强序列。
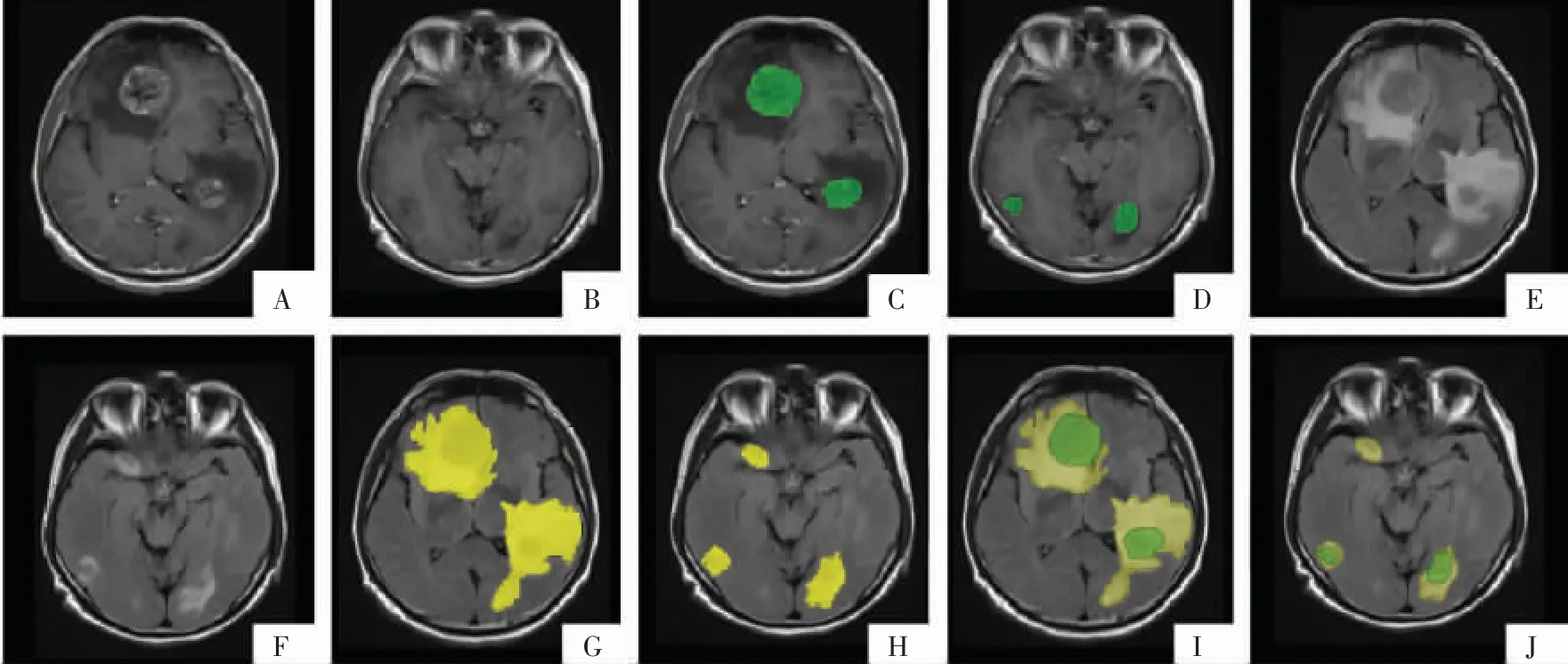
图5 转移瘤标注示例。颅内多发转移瘤,病灶总数≤5 个,逐一标注所有病灶。A、B 图为T1WI 增强序列;C、D 图为肿瘤强化及非强化范围叠加影像(绿色);E、F、G、H 图为 T2-FLAIR 序列及标注的全肿瘤区域(黄色);I、J 图为融合影像。
7 人机交互标注
为提高大规模样本数据集的构建效率,可应用深度学习算法模型,通过人机方式实现大规模医疗影像数据的标注。①首先选取少量具有典型代表性的医疗影像数据,由多名医学专家进行交叉验证标注,形成标准样本数据集。②构建基于深度神经网络的医学影像分析模型,利用标注的数据对模型进行训练。③利用训练好的算法模型对大规模医疗影像数据进行算法标注,生成大规模医疗影像样本数据集。④采用主动学习算法对算法标注的样本数据集进行策略性抽样,即由医学专家对样本数据集进行人工质量评估,对于算法标注错误的样本数据,修正或重新标注后加入到标准样本数据集,再次训练算法模型。⑤以上步骤可进行迭代优化,最终形成满足医学专家要求的大规模样本数据集。以构建脑胶质瘤样本数据集为例,其方法流程如图7所示。
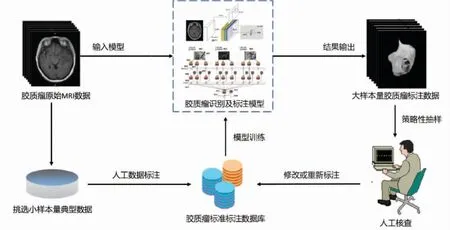
图7 人机交互样本数据标注方法流程
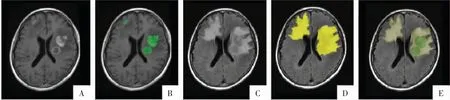
图6 淋巴瘤标注示例。颅内多发淋巴瘤,病灶总数≤5 个,逐一标注所有病灶。A 图为T1WI 增强序列;B 图为肿瘤强化及非强化范围叠加影像(绿色);C、D 图为T2-FLAIR 序列及标注的全肿瘤区域(黄色);E 图为融合影像。
8 标注流程
结合实际临床工作和研究项目的需要,参照中华医学会放射学分会提出的肝脏病变、结直肠癌的标注专家共识[17-18]中的标注流程,简要流程图见图8。
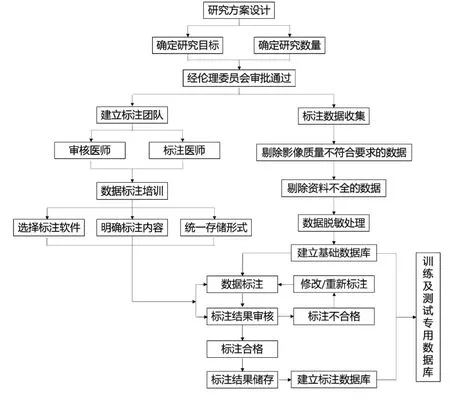
图8 CNS 肿瘤MRI 影像标注的简要流程示意图
9 小结
总之,结合目前相关研究,专家团队针对CNS肿瘤数据,尝试初步建立MRI 影像标注共识,以统一各学科团队的数据采集及标注规则,从而提高模型的泛化性,促进AI 模型的优化、验证及推广。同时,根据临床、科研工作中遇到的新问题不断完善共识内容,规范标注工作流程。
专家组成员(按姓氏笔画排序)
于泽宽(复旦大学工程与应用技术研究院)、王蓉(西安交通大学第一附属医院)、尹波(复旦大学附属华山医院)、邓克学(中国科学技术大学附属第一医院)、石峰(上海联影医疗科技有限公司)、冯瑞(复旦大学计算机科学技术学院)、朱莉(上海交通大学附属胸科医院)、刘军(上海交通大学医学院附属同仁医院)、李郁欣(复旦大学附属华山医院)、李铭(复旦大学附属华东医院)、李彩英(河北医科大学第二医院)、李朝阳(北京深睿博联科技有限责任公司)、何江波(上海市宝山区中西医结合医院)、张军(复旦大学附属华山医院)、张佳胤(上海交通大学附属第一人民医院)、张铁亮(新疆医科大学第一附属医院)、陈美娟(上海辰光医疗科技股份有限公司)、陈增爱(上海交通大学医学院附属仁济医院)、林江(复旦大学附属中山医院)、赵秋枫(上海中医药大学附属龙华医院)、赵凌霄(中国科学院苏州生物医学工程技术研究所)、胡良波(重庆医科大学附属永川医院)、姜兴岳(滨州医学院附属医院)、耿辰(中国科学院苏州生物医学工程技术研究所)、耿道颖(复旦大学附属华山医院)、夏威(中国科学院苏州生物医学工程技术研究所)、郭允博(数坤(北京)网络科技有限公司)、郭岗(北京安德医智科技有限公司)、黄丙仓(上海市浦东新区公利医院)、楼海燕(浙江大学医学院附属第一医院)、谭文莉(上海中医药大学附属曙光医院)、薛忠(上海联影医疗科技有限公司)
