可注射纳米复合甲基丙烯酸化明胶水凝胶在骨修复中的应用
2021-08-05李建江白涛胡炜黄异飞韩念荣
李建江 白涛 胡炜 黄异飞 韩念荣
骨缺损常见于外伤、肿瘤、感染等,对其重建是一项重大挑战,而自体骨移植是治疗骨缺损的金标准[1]。但自体骨来源有限,随之而来的出血、感染等各种并发症依然不容忽视[2]。基于此,包括羟基磷灰石(HAP)、磷酸三钙(TCP)、钛钽合金等在内的生物材料受到广泛的研究和应用[3-5]。然而,上述材料并不能有效的与宿主骨整合,容易出现植入物远期松动[6],生物活性尚不理想[7]。
因此,具有诱导骨再生效果的各类生物活性水凝胶[8-11]备受关注,其中可注射水凝胶因具有微创填充不规则骨缺损的优势脱颖而出[12-13]。甲基丙烯酸化明胶(GelMA)水凝胶因其良好的生物相容性和可控性广泛应用于组织工程中[14]。此外,目前已有多种生物活性成分[15-16]被尝试添加到GelMA 中,并初具成骨优化效果,然而负载物的爆发性释放、短效作用等缺陷限制了其进一步发展。
纳米锂钙石(SN)是一种表面电荷分布不均的圆盘状纳米颗粒,并可基于静电力和范德华力产生相互作用力而可逆地自发组装成“纸牌屋”式网络结构,无需依赖化学键或生物偶联;而该网络结构可通过一定外力打破而恢复SN颗粒间相互运动,即实现剪切稀化作用[17-18]。此外,SN 能在缺乏额外成骨诱导因子的情况下促进骨髓间充质干细胞(BMSCs)成骨分化[17,19]。
有效的骨愈合还需要足够的干细胞集中于骨缺损区域[20-21]。然而,单纯将干细胞植入支架内的策略[22]受限于细胞来源有限、活力低等不足,相较之下通过植入具有趋化活性的生长因子以募集干细胞归巢的替代策略显然更有价值[23]。血小板衍生生长因子(PDGF)已被证明能够指导未分化BMSCs 的归巢和迁移[24-25],此外还具有促进基质矿化、诱导新生骨质形成的功能[26]。
通过在GelMA 中简单共混入SN 和PDGF,即可成功制备可注射GelMA-SN-PDGF复合水凝胶;进一步施加紫外光可优化其力学性能,以实现最佳的成骨物理环境和受控的降解。此外,负载的SN 和PDGF 之间可借助高表面积和电荷属性而形成物理吸附[17,27],从而实现负载物的缓释,并且不引发PDGF 结构改变而使其失活,保持其低浓度下维持对BMSCs的高生物活性[28]。基于此,本研究拟构建可注射GelMA-SN-PDGF复合水凝胶,验证其体内外成骨再生效应。
材料与方法
一、实验材料和仪器
明胶(Solarbio,中国),甲基丙烯酸酐(MA,aladdin,中国),Irgacure 2959(98%,Sigma-Aldrich,德国),茜素红S染色液(Sigma-Aldrich,德国),Laponite(BYK Additives&Instruments,美国),重组大鼠PDGF-BB(Biolegend,美国),大鼠PDGF-BB ELISA Kit(ab267585,Abcam,英国),CCK-8 试剂盒(Sigma-Aldrich,德国),Live/Dead 试剂盒(Sigma-Aldrich,德国),Trizol(Invitrogen,美国),Alexa Fluor 594488-鬼笔环肽(Sigma-Aldrich,德国),4′,6-二mid 基-2-苯基吲哚(DAPI,Sigma-Aldrich,德国),Triton X-100(Sigma-Aldrich,德国),抗碱性磷酸酶(ALP)抗体(AP136A,Sigma-Aldrich,德国),抗骨钙蛋白(OCN)抗体(MABD123,Sigma-Aldrich,德国),抗骨桥蛋白(OPN)抗体(AB1870,Sigma-Aldrich,德国),抗Runt相关转录因子2(RUNX2)抗体(05-1478,Sigma-Aldrich,德国),Alexa Fluor 594488-Invitrogen(Thermo Fisher Scientific,美国),大鼠BMSCs(中国科学院上海细胞库)。流变仪(ElastoSensTM Bio2,Montreal,QC,加拿大),场发射扫描电子显微镜(FESEM,Zeiss Ultra 55,德国),万能力学试验机(Instron 5542,英国),倒置荧光显微镜(Brunel SP99F,Brunel Microscopes Ltd,英国),Micro-CT(Scanco Medical,瑞士),热循环仪(Bio-Rad MyiQ2,美国),Image J 软件(v1.8.0,National Institutes of Health,美国)。
二、可注射GelMA-SN-PDGF复合水凝胶样品的制备
将明胶完全溶解于PBS 中,加入MA 充分搅拌1 h。PBS稀释所得混合溶液并转移至透析膜中,于40℃黑暗环境中透析1周,以分离未反应的MA。透析后溶液经冷冻干燥得到白色泡沫状GelMA 前体。将GelMA前体完全溶解于PBS中,同时加入SN(Laponite,2% w/v)、PDGF(100 ng/mL),加入Irgacure 2959(0.5% w/v)作为光引发剂,将所得预聚物在充分搅拌后于紫外光下照射(6.9 mW/cm2,360~480 nm),最终即可获得复合水凝胶样品。
三、GelMA-SN-PDGF复合水凝胶的表征观察
(一)黏度和可注射性能分析
使用流变仪进行复合水凝胶的流变和应力恢复测试。在室温下以0.1~100 s-10的剪切速率范围记录负载不同SN 含量(0%,1%和2% w/v)水凝胶样品的剪切应力。在复合水凝胶的可注射性能评估中,复合水凝胶依次经受频率为1 Hz 的高应变(100%,10 min)和低应变(1%,10 min),以获得37 ℃下的复合水凝胶储存模量(G′)。复合水凝胶的可注射性采用不同直径针头的注射器在室温下注射评估。
(二)微观形貌观察
使用FESEM对冻干水凝胶样品扫描,观察水凝胶内部微观结构,分析负载SN后其微观结构变化。
(三)力学分析
将100 μL 的预聚物于定制的聚二甲基硅氧烷(PDMS)模具中经紫外光交联制成圆柱状水凝胶样品(宽8 mm,高2 mm)。使用Instron 5542 机械测试仪以1 mm/min 的速度压缩圆柱状水凝胶样品30 s,计算应力-应变曲线首个0~10%线性区域以获得样品的杨氏模量。
(四)降解和溶胀性能特征
同上所述制备圆柱形水凝胶样品以测定降解率以及溶胀率。在降解率测定中,将水凝胶样品冻干后称重以记录初始质量。随后将样品浸入37 ℃的PBS中,在预设的时间点取出样品并进行冻干称重,同时替换等量新鲜PBS,重新将样品再次浸于其中,最终描绘降解曲线。在溶胀率测试中,将圆柱形水凝胶样品在PBS中孵育1 h以达到溶胀平衡,记录溶胀的水凝胶质量为M(s),随后冻干样品并记录其质量M(l),溶胀率根据以下方程式计算得出:
溶胀率=[M(s)-M(l)]/M(l)
(五)PDGF缓释的体外分析
负载PDGF的复合水凝胶样品浸泡于1 mL PBS中,并于37 ℃下置于摇床平台(60 r/min)。到达预设时间点后,取出500 μL PBS 并以等量新鲜PBS 补充代替。使用PDGF-ELISA 试剂盒测定取出液中PDGF的浓度,计算累积释放浓度。
四、复合水凝胶封装细胞的活力、扩散、增殖和迁移分析
(一)细胞活性及铺展运动
在37 ℃,5%CO2环境下,使用a-MEM培养基(含10%胎牛血清,1%青霉素/链霉素)培养大鼠BMSCs。将BMSCs 接种于圆柱形水凝胶样品上,细胞密度控制在3×104个/孔。使用CCK-8 试剂盒以及Live/Dead 试剂盒测定样品潜在的细胞毒性和细胞活力。另一方面,使用4%多聚甲醛固定细胞后经鬼笔环肽和DAPI染色,在倒置荧光显微镜下评估接种后第3 天的细胞扩散形态,Image J 软件对细胞铺展面积进行定量分析。
(二)细胞迁移
Transwell实验中,将50 μL BMSCs悬浮液(104个/mL)转移至Transwell 小室上层,同时将400 μL 培养基和复合水凝胶样品装载于小室下层。共孵育3 h后,4%多聚甲醛固定跨膜细胞10 min,结晶紫溶液(0.1%)染色10 min。PBS轻柔冲洗后于显微镜下进行细胞计数。Scratch实验中,BMSCs以105个/mL的初始密度接种于10 cm 培养皿中,当细胞的融合度达到约70%时,使用1 mL 移液器吸头垂直刮擦皿底形成2.0 mm宽划痕,于设定时间点观察刮痕宽度变化。
五、成骨相关标志物表达水平的分析
使用qRT-PCR 量化ALP、RUNX2、OCN 和OPN的表达。如前述制备圆柱形水凝胶样品并接种BMSCs(3×104个/孔)。配置成骨诱导培养基(10 mmol/L β-磷酸甘油,50 μg/mL抗坏血酸,100 nmol/L地塞米松,10%胎牛血清)共培养复合水凝胶和BMSCs。于第14 天收集并使用Trizol 裂解细胞,热循环仪中进行qRT-PCR。
使用免疫荧光法标记评估相应的成骨相关蛋白水平。成骨诱导培养基共培养BMSCs 和复合水凝胶样品14 d 后,4%多聚甲醛固定细胞,1%Triton X-100加强细胞渗透性,4%BSA封闭非特异性抗原后,将细胞与目标蛋白一抗(ALP,OCN,OPN 和RUNX2 抗体)于4 ℃孵育过夜,随后二抗工作液中37 ℃下浸泡2 h。细胞核和肌动蛋白分别使用DAPI和Alexa Fluor 594 鬼笔环肽进行标记,于荧光显微镜下记录染色图像,Image J 软件定量蛋白质表达水平。
六、基质矿化能力测定
制备圆柱形水凝胶样品并接种BMSCs(3×104个/mL),使用骨诱导培养基共培养。分别于培养14 d和21 d后使用4%多聚甲醛固定细胞,加入茜素红染液(40 mmol/L,pH=4.2)于室温下孵育10 min。随机选择五个显微镜视野对钙结节进行计数。为进一步量化基质矿化,将茜素染色后样品浸泡在10%乙酸中30 min,10%氢氧化铵滴定中和,取上清液在酶标仪中于405 nm波长下读取吸光度。
七、复合水凝胶体内成骨再生能力的评估
(一)大鼠颅骨临界骨缺损模型的建立
60只平均体重为120 g的SPF清洁级雄性SD大鼠随机分为4 组:GelMA 组,GelMA-SN 组,GelMAPDGF 组和GelMA-SN-PDGF 组。手术大致如下:腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉大鼠,手术区域备皮后碘伏消毒。于大鼠颅顶部正中行1.5 cm纵向切口,分离骨膜以充分暴露颅骨骨质。使用8 mm环型钻机制造一个直径为8 mm 的骨缺陷。将水凝胶注入缺损区域并进行原位紫外光交联。最终缝合骨膜和皮肤,术后切口再次碘伏消毒。
(二)体内骨再生分析
术后6周腹腔注射过量戊巴比妥钠处死所有大鼠,收集颅骨标本。使用Micro-CT 扫描标本,计算新生骨体积占比(BV/TV)和骨密度(BMD)。使用Masson 三色染色法分析再生骨组织的组织学特征。通过Masson三色染色结果,使用Image J软件量化缺损区域新鲜类骨质和矿化骨质的形成分布;选取缺损长度为8 cm的组织切片,缺损区域未骨性愈合宽度记录为U(a),并根据下述公式计算骨愈合百分比:
骨愈合百分比=[8-U(a)]/8×100%
八、统计学分析
使用单因素方差分析(ANOVA)和Bonferroni 事后分析(GraphPad Prism 8.0)分析实验结果,P<0.05为差异具有统计学意义。
结 果
一、复合水凝胶的材料表征
可注射复合水凝胶在原位经紫外光交联后增强力学性能(图1 a)。在室温下,GelMA-SN 水凝胶可通过最小直径针头(27 G)的注射器,具有良好的可注射性能(图1 b)。随着SN浓度升高,GelMA-SN在一定剪切速率下黏度显著增加(图1 g),显示出明显的剪切稀化特性。
紫外光交联后电镜下观察可见GelMA 水凝胶的内部结构具有更多连通的孔隙,而加入的SN均匀散布于GelMA的多孔结构表面。SN的引入并未显著破坏GelMA 原有的网络状多孔微观结构(图1 c)。交联后4组GelMA基水凝胶(GelMA,GelMA-PDGF,GelMA-SN,GelMA-SN-PDGF)的溶胀率均降低了40%~50%,而其压缩模量均有相似的提升(图1 d、e)。
SN 强化了GelMA 的剪切恢复能力(图1 f)。在低应变(1%)情况下,GelMA预聚物的储能模量低至约5 Pa,而1%SN 和2%SN 的引入使储能模量分别增至100 Pa 和约300 Pa;而在经受高应变(100%)后,负载1% SN 的GelMA 恢复了初始储能模量的70%~80%,而2%SN的引入使GelMA的储存模量回复至初始的90%~95%。此外,交联后的GelMA基水凝胶降解时间均长达21 d(图1 i)。
在生长因子释放试验中(图1 j),GelMA-SNPDGF 水凝胶显示出受控的释放模式,第21 天依然可检测出释放的PDGF。相反,GelMA-PDGF呈爆发型释放曲线,在前3 d释放量已超过PDGF总负载量的91%。
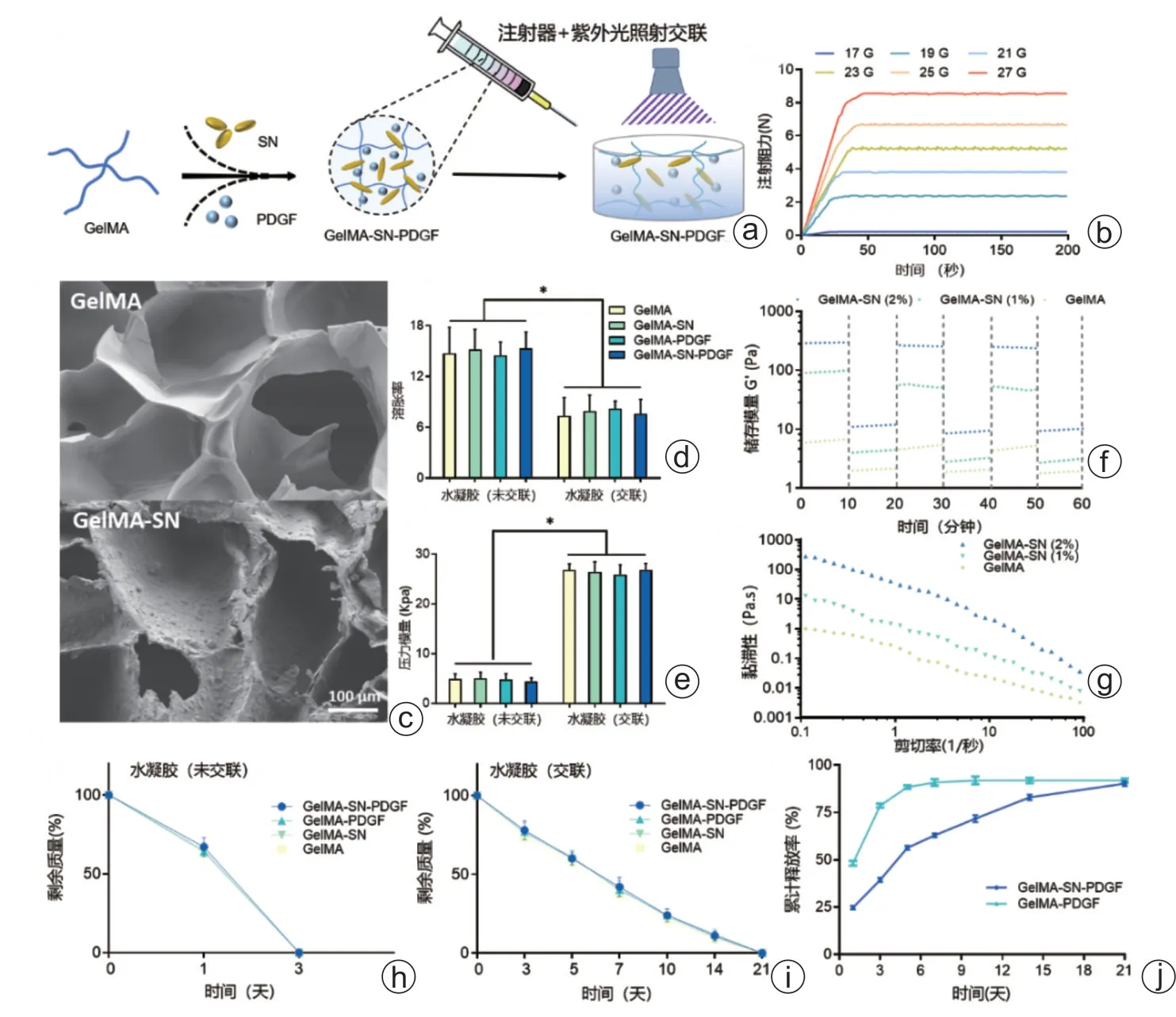
图1 GelMA-SN-PDGF 复合水凝胶的表征 a:GelMA-SN-PDGF 复合水凝胶样品的制备过程;b:复合水凝胶可通过不同直径针头被注射;c:GelMA和GelMA-SN在扫描电子显微镜下观察;d~g:复合水凝胶的溶胀率、压缩模量、储存模量、粘度-剪切速率测量;h、i:复合水凝胶在紫外光交联前后的体外降解速度;j:两种载PDGF的复合水凝胶样品的生长因子释放曲线(*P<0.05)
二、复合水凝胶封装细胞的活力、扩散和增殖
水凝胶样品表面培养的BMSCs 的活性见Live/Dead 染色结果,各组样品上培养的细胞生存力未见明显差异(图2 a、b)。DAPI-Phalloidin 染色结果(图2 c、e)体现了BMSCs在GelMA-SN-PDGF水凝胶组中铺展更广。CCK-8法分析结果如图2 d所示,各组GelMA基水凝胶样品对细胞的毒性无显著差异。
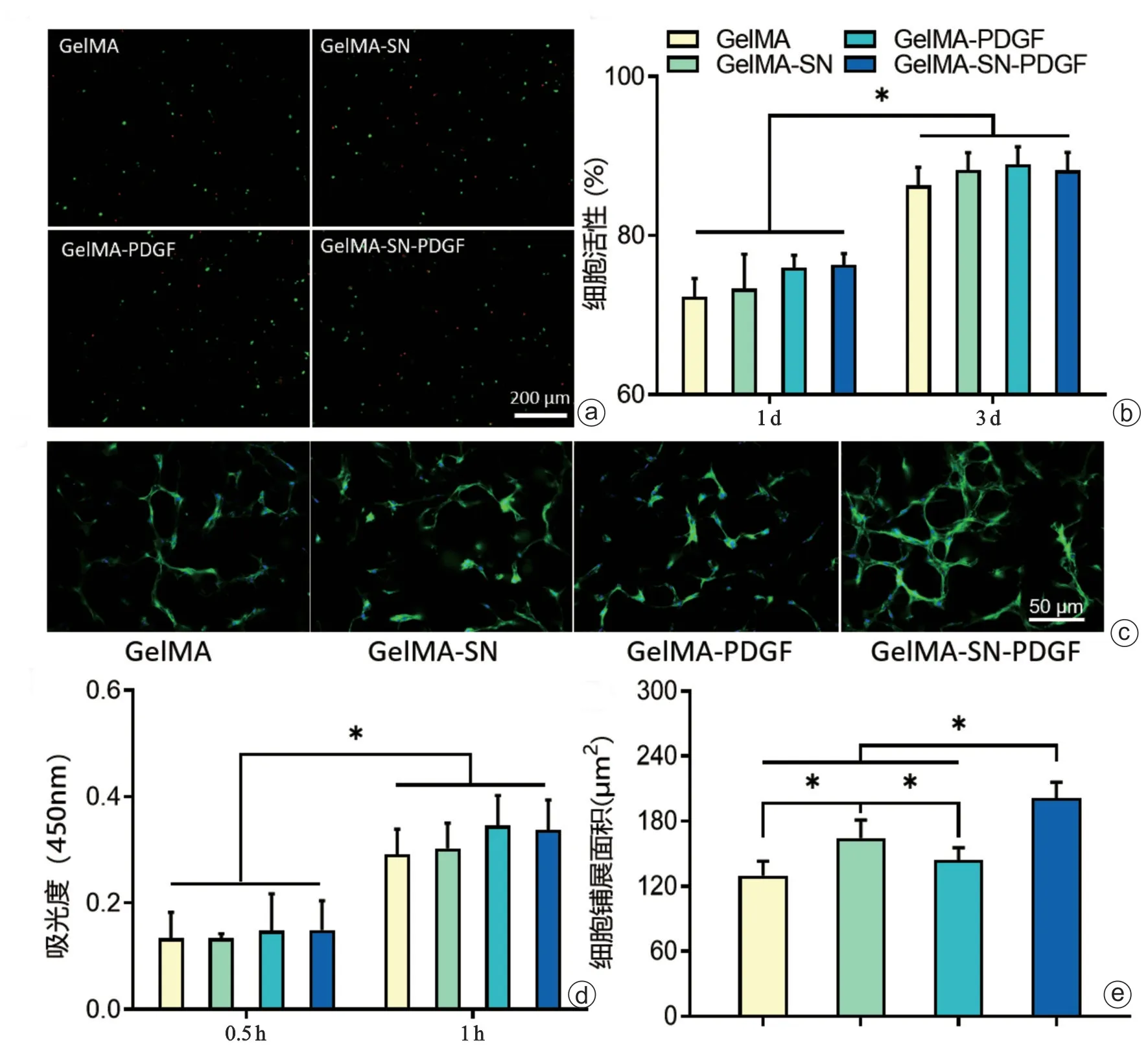
图2 GelMA-SN-PDGF复合水凝胶的生物相容性检测 a、b:Live/Dead染色复合水凝胶中细胞的成像及细胞活性量化;c:DAPI-Phalloidin 染色复合水凝胶中细胞第3天铺展形态;d:CCK-8测定SN对复合水凝胶中的细胞毒性大小;e:复合水凝胶中接种细胞第3天铺展面积的量化比较(*P<0.05)
三、BMSCs的体外募集迁移活动
在Transwell 实验中,当暴露于负载PDGF 的水凝胶中,在Transwell 膜中观察到迁移细胞增加了约2.5 倍(图3 a、c)。Scratch 试验中(图3 b、d),负载PDGF 水凝胶在24 h 使划痕闭合率分别提高到63.42%±2.08%和65.18%±1.63%。
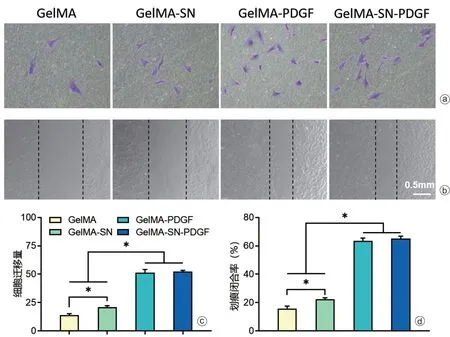
图3 GelMA-SN-PDGF复合水凝胶的趋化能力检测 a:Transwell实验中结晶紫染色迁移细胞;b:Scratch实验中各组复合水凝胶样品诱导的划痕愈合情况;c:Transwell实验4组水凝胶样品诱导细胞趋化运动的量化;d:Scratch实验4组水凝胶样品诱导细胞迁移的量化(*P<0.05)
四、复合水凝胶的基质矿化能力
第14 天GelMA-SN 和GelMA-SN-PDGF 组样 品在405 nm 处吸光度值分别为0.58±0.02 和0.61±0.04,表明SN 优化了复合水凝胶的基质矿化能力(图4)。
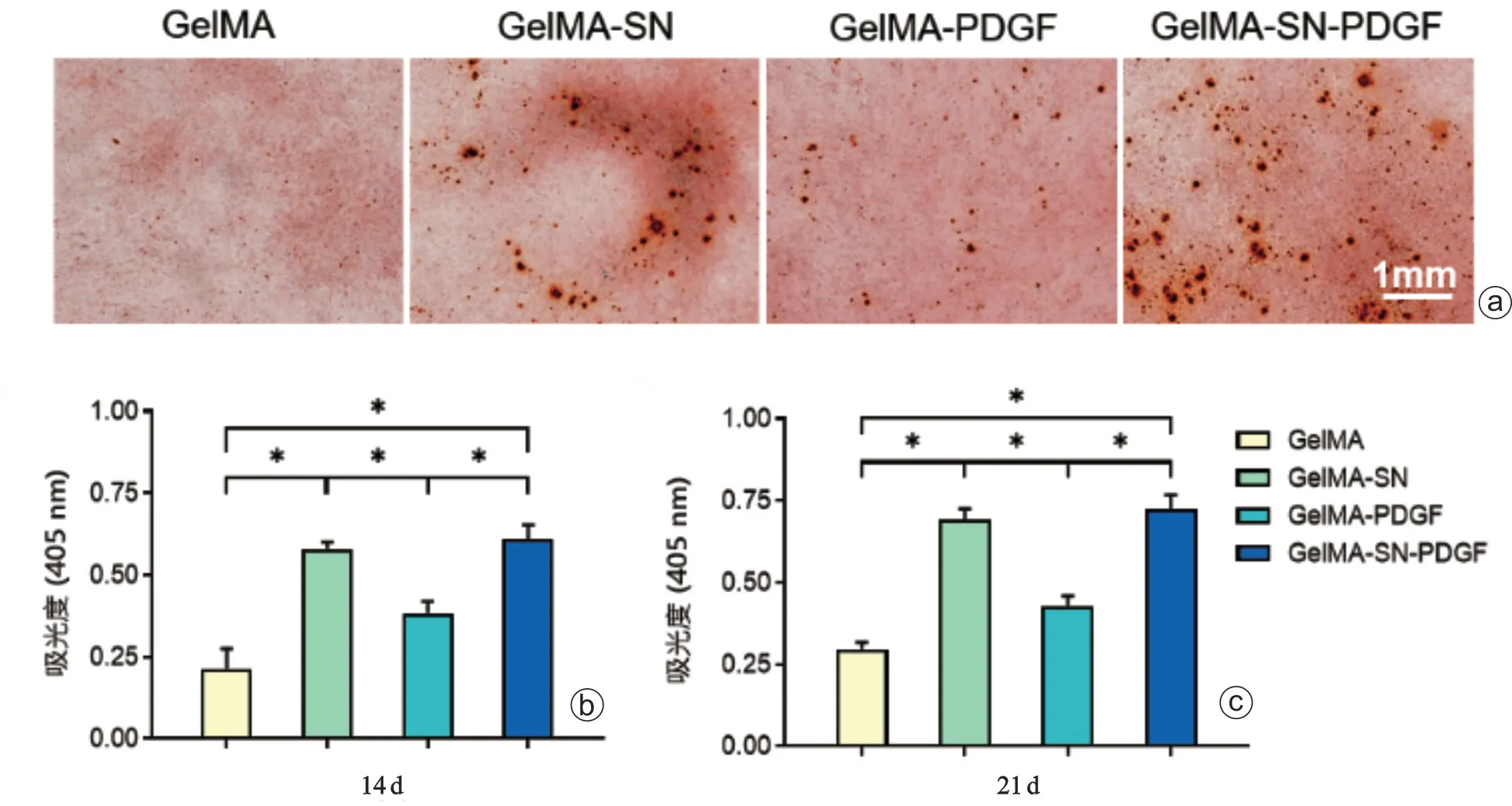
图4 GelMA-SN-PDGF 复合水凝胶的基质矿化能力评估 a:第21天通过茜素红染色测量4组复合水凝胶的基质矿化水平;b、c:酶标仪定量4组复合水凝胶在第14、21天的钙沉积量(*P<0.05)
五、复合水凝胶成骨相关标志物的表达
成骨相关基因表达水平如图5 a 所示,以单纯GelMA水凝胶为基准对比,GelMA-SN-PDGF 复合水凝胶组中ALP、RUNX2、OCN、OPN 的表达上调最显著;而GelMA-SN组和GelMA-PDGF组均有不同程度上调。免疫荧光标记量化成骨相关蛋白结果(图5 b)与基因表达结果一致,以单纯GelMA 水凝胶作为基线相比,GelMA-SN-PDGF复合水凝胶组拥有最高水平的相应蛋白表达。
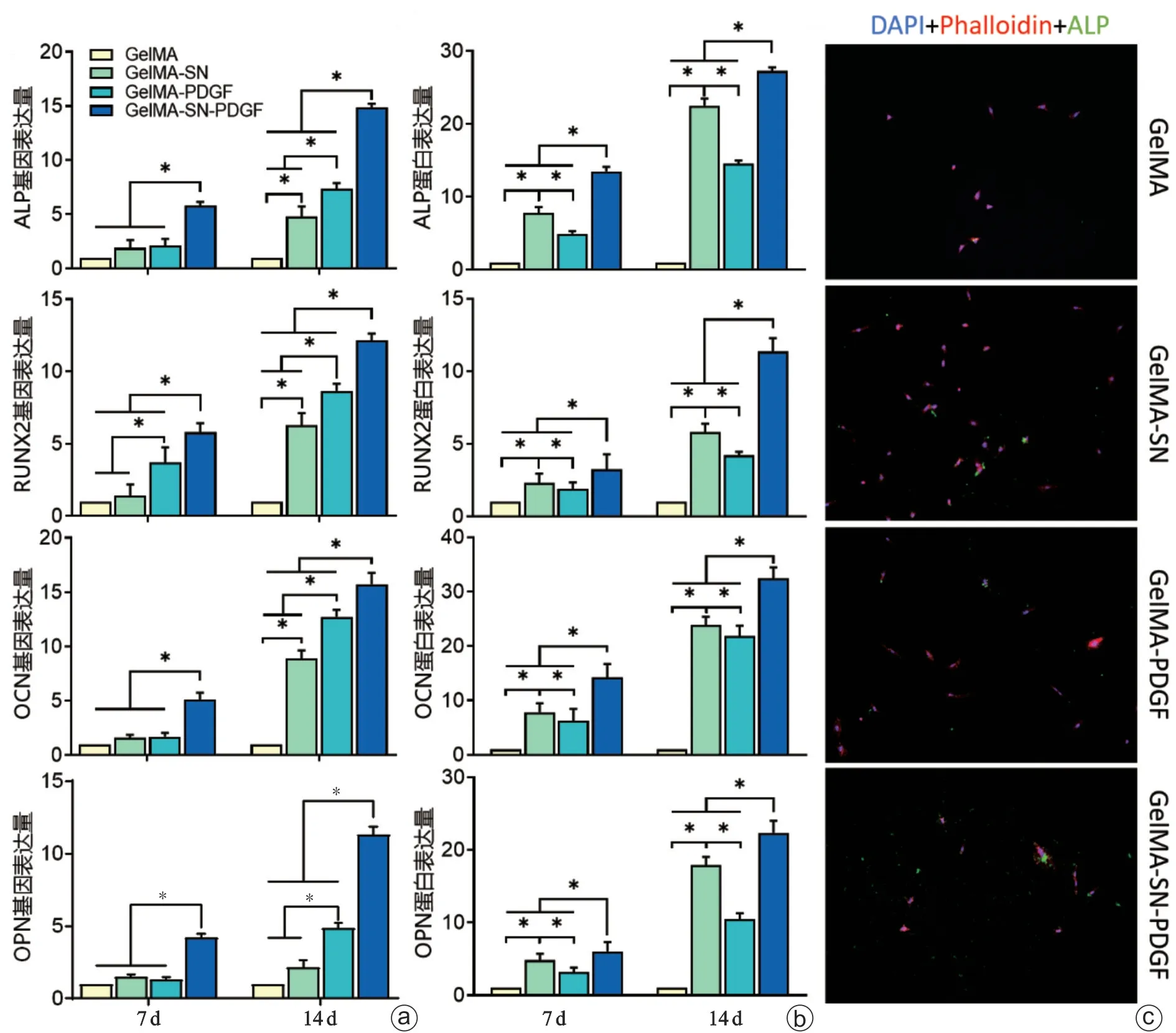
图5 GelMA-SN-PDGF复合水凝胶体外成骨相关标志物的表达 a:4组水凝胶在第7、14天的体外成骨基因表达变化;b:4组水凝胶在第7、14天的体外成骨蛋白表达变化;c:4组水凝胶样品在第7天的ALP免疫荧光成像(*P<0.05)
六、复合水凝胶体内修复大鼠颅骨缺损
如Micro-CT扫描结果(图6 a)所示,与其他三组相比,GelMA-SN-PDGF复合水凝胶植入组的大鼠骨愈合更显著,新生骨质的生成量更高,BV/TV 为66.29%±2.14%;GelMA-PDGF 水凝胶和GelMA-SN水凝胶亦促进了一定程度的骨再生。而4组GelMA基水凝胶新生骨BMD 均表现出与BV/TV 一致的趋势。
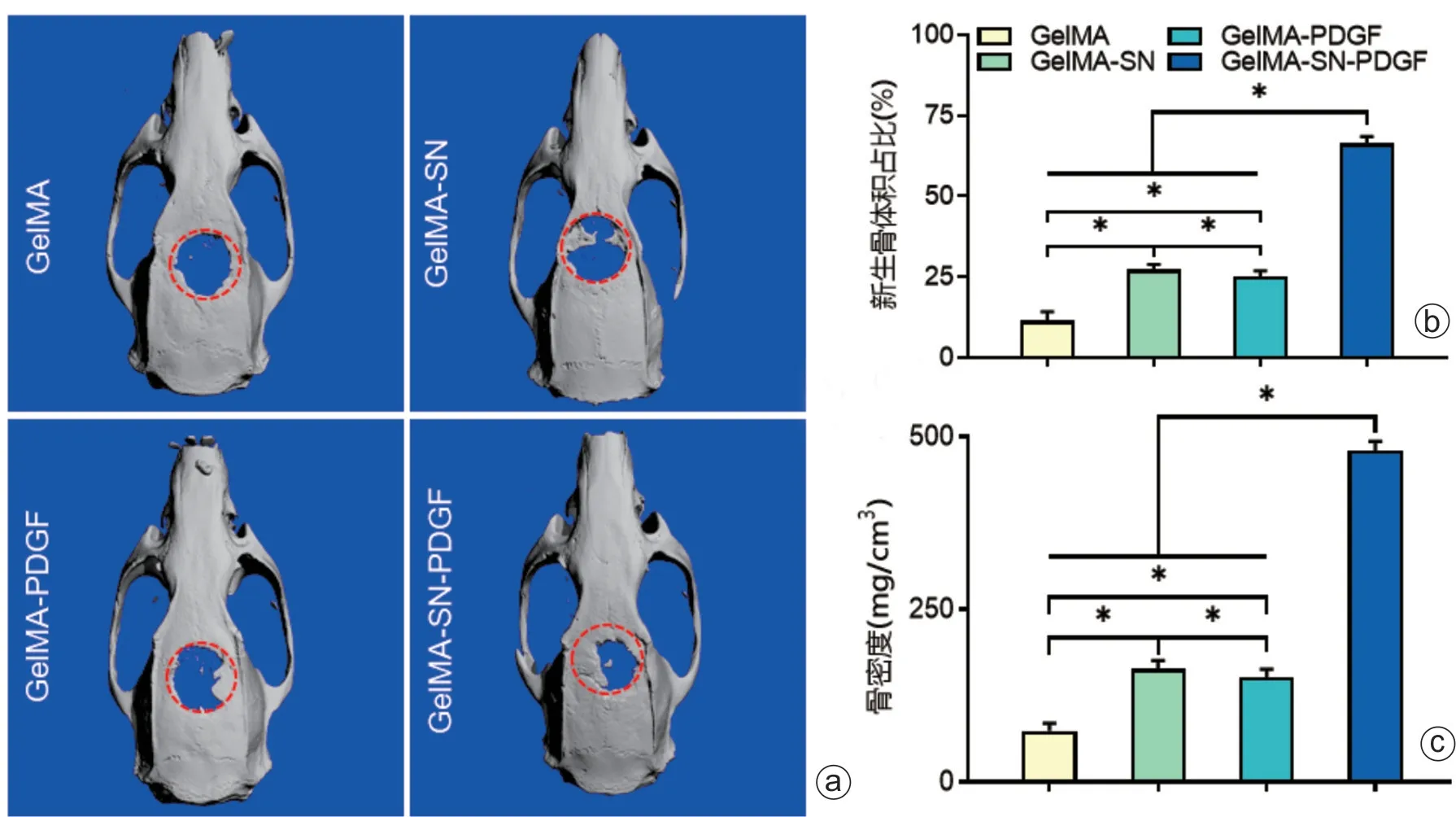
图6 复合水凝胶处理大鼠颅骨缺损的Micro-CT评估 a:Micro-CT扫描各组复合水凝胶处理大鼠颅骨缺损的成像;b、c:进一步定量分析4组大鼠颅骨缺损区域的BV/TV和BMD(*P<0.05)
Masson 三色染色结果如图7a 所示,GelMA-SNPDGF 复合水凝胶组的骨愈合百分比为67.23%±2.63%,远高于其他三组水凝胶样品;其矿化骨质和类骨质形成亦显著高于其余3组(图7 c、d),其中矿化骨质形成量约是GelMA组的12倍,而类骨质生成量约是GelMA组的14倍。
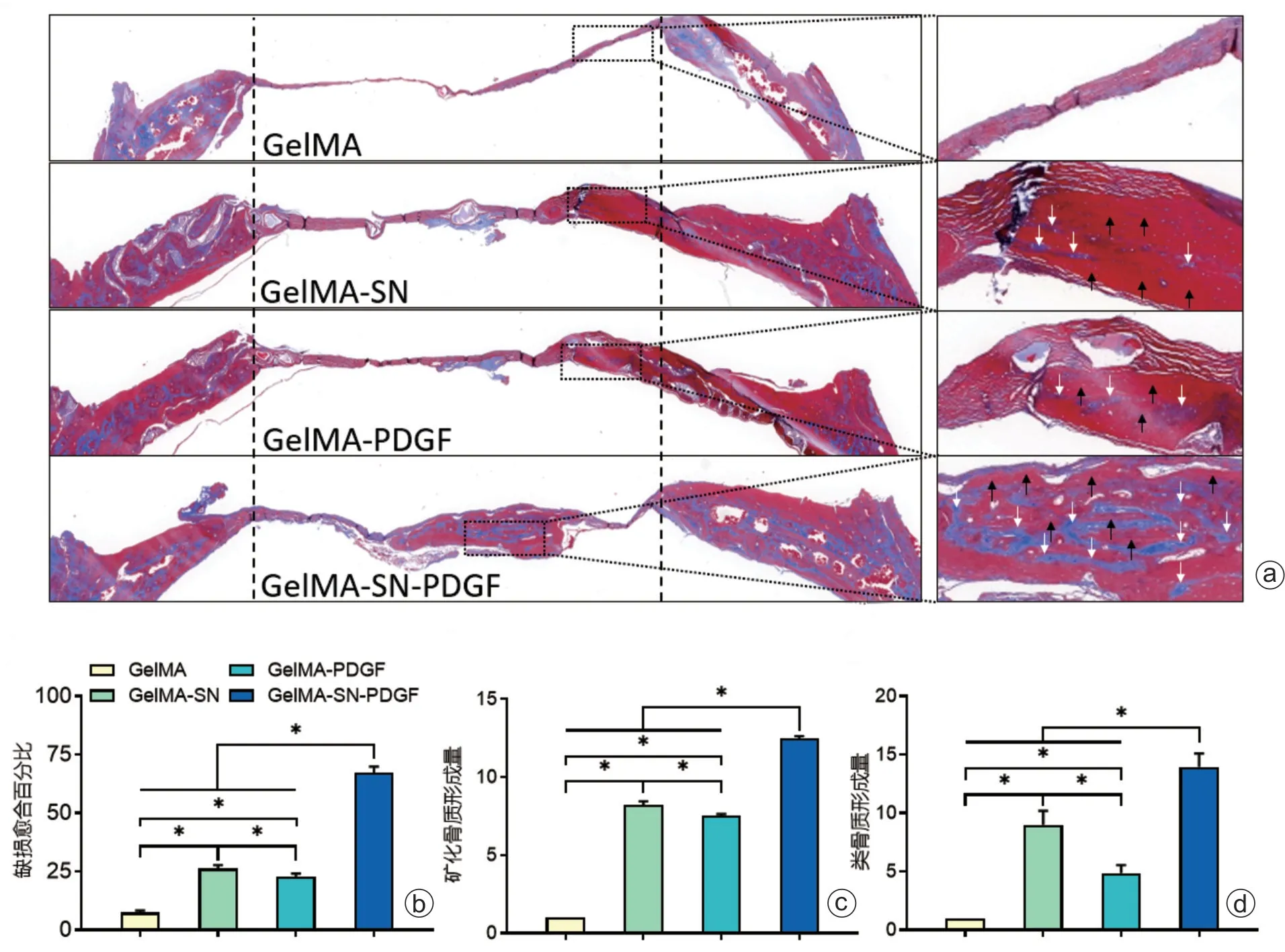
图7 复合水凝胶处理大鼠颅骨缺损的组织学评估 a:4组大鼠颅骨缺损6周后组织学Masson三色染色观察,黑色箭头指示新生的类骨质,白色箭头指示已矿化骨质;b:4组复合水凝胶处理6周后大鼠颅骨缺损的愈合百分比;c、d:4组大鼠颅骨缺损区域新生骨质的矿化骨和类骨质含量定量分析(*P<0.05)
讨 论
当前临床上自体骨移植和大部分植骨替代物并不能很好的满足创伤和肿瘤等所致病理性骨缺损修复需求[2],因此有研究不断尝试以支架负载细胞或成骨活性物质以刺激局部骨再生[15-16]。近年来可注射成骨水凝胶引起高度关注,以期实现微创填补不规则骨缺损[12-13]。然而当前的成骨水凝胶方案合成方法复杂、耗时且昂贵[29-30],并受限于有限的细胞来源和较低的细胞活力,最终疗效尚存争议[22]。
紫外光照射交联使水凝胶的力学性能得以调控。紫外光辐照30 s 后,电镜下可见GelMA 内部形成了高度交联互通的网络孔隙,且其弹性模量增至25 KPa,恰为BMSCs 成骨分化公认的最佳刚度[31]。交联后GelMA 的溶胀率显著降低、降解速度减慢,有利于实现PDGF的持续释放;结合SN的引入,Gel-MA-SN-PDGF复合水凝胶呈现出长达21 d的生长因子控释模式,显著持久于GelMA-PDGF 水凝胶产生的爆发性释放。负载物缓释可由SN 自组装形成的物理屏障和吸附药物来解释[27,32]。早期研究证实各种离子或分子可以通过范德华力、氢键、经典的离子交换或配体交换等形式吸附于SN表面[27]。因此,复合水凝胶中PDGF 释放时间可持续达数周至数月,利于骨修复愈合过程。
除了延缓负载物释放,SN 使复合水凝胶的可注射性得到显著优化,这主要归因于其剪切稀化特性[17-18]。SN 在微观下呈纳米圆盘状(平均直径为25 nm,平均厚度为0.92 nm),表面电荷呈特征性不均分布。当SN 溶解于水中,分离的单个SN 晶体可借助带负电边缘和带正电表面之间的电荷力和晶体间范德华力相互吸引,宏观上呈凝胶状[17-18];而SN胶状物呈现出强触变性,并在移除施加应力后即可快速恢复(图1 c、d)。因此相较传统工艺,SN 简化了可注射水凝胶的制备策略。
低浓度SN 亦可显著影响细胞铺展运动。鉴于上述SN晶体的吸附能力,其表面亦可吸附整联蛋白和成骨蛋白[27],因而在复合水凝胶上培养细胞时可观察到铺展面积更广的细胞。更充分的细胞铺展意味着其更易于分化为骨组织。故在这方面,SN促进诱导成骨作用的巨大潜力得以验证。而低剂量的SN并不会显著干扰细胞的存活和增殖。
干细胞归巢在伤口愈合和组织再生中起着至关重要的作用[23]。在划痕实验和迁移测试中,PDGF募集BMSCs 能力得以验证,其潜在机制涉及PDGF/PDGFR信号调控BMSCs活动[25]。因此,复合水凝胶通过PDGF 允许其调动外周BMSCs 到缺损区域,以实现后续的骨缺损修复。
PCR和免疫荧光染色从基因和蛋白质表达层面证实了GelMA-SN-PDGF 显著的成骨效果。其中,SN 的降解产物,即原硅酸[Si(OH)4]和锂(Li),可直接上调成骨蛋白表达[17,27]。当SN 的成骨性能配合PDGF 的细胞募集效果时,两者可能在成骨相关标志物表达方面上存在协同作用。另一方面,SN晶体表面上存在大量的Si-OH而吸引钙离子分布,最终导致磷酸钙成核形成钙沉积,产生更多的钙结节[27,33],解释了负载SN 的水凝胶(GelMA-SN,GelMA-SNPDGF)拥有更深的茜素红染色。
在大鼠体内,GelMA-SN-PDGF 组显著修复了颅骨临界缺损,且新生骨质不仅从缺损边缘再生,亦在缺损中心出现,提示新的骨化中心形成。这和SN的成骨诱导和钙沉积作用,以及PDGF的干细胞募集功能相关。而次生骨化中心意味着更快的骨愈合[34]。BV/TV 和BMD 结果印证了复合水凝胶修复骨缺损的质量,提示新生骨质具有更高的厚度和密度。在组织形态学层面上,GelMA-SN-PDGF拥有最高的缺损愈合率、矿化骨和类骨质形成水平。其中矿化骨质提示更成熟的骨质形成,而类骨质意味着缺损部位新生骨质的产生潜力。
本研究对于GelMA-SN-PDGF 的体内成骨效应分析仍有待更长时间的观察分析,以进一步验证GelMA-SN-PDGF 远期完全治愈严重骨缺损的能力。本研究构建的可注射GelMA-SN-PDGF 复合水凝胶,制备方法简单易行,在体外内实验中均展现出优异的生物相容性和成骨能力。这项研究将有助于可注射水凝胶治疗骨缺损的后续研究开展,以及在诱导血管和神经组织再生方面的拓展,也将有利于远期各种组织和器官再生。
