耐力运动对骨质疏松小鼠骨量、骨形态学及Linc-ROR表达的影响
2021-08-04赵仁清孙龙飞顾莤
赵仁清 孙龙飞 顾莤
扬州大学体育学院,江苏 扬州 225127
骨质疏松症是影响老年人健康的重要问题,骨质疏松可增加骨折风险,并且骨折后愈合效果不佳[1]。目前我国有近2亿老年人口,因此,预防骨质疏松症成为迫切的任务。有研究表明耐力运动明显改善骨质疏松小鼠骨组织微观结构、预防骨量丢失[2-3]。机械力刺激可通过促进成骨细胞分化、增加骨合成,抑制破骨细胞分化,减少骨吸收,维持骨代谢正平衡[4-5];但其调节机制目前还不完全清楚。Linc-ROR是新近发现的长链非编码 RNA,在转录及转录后多个层面修饰基因表达、调控成骨细胞分化[6];Linc-ROR的表达受到运动的调节;张宇等[7]研究发现耐力运动可影响小鼠脑组织Linc-ROR的表达,促进神经组织修复。最近研究表明,Linc-ROR在多种组织中与Wnt/β-catenin信号系统协同调控细胞增殖、分化[8-9]。鉴于Linc-ROR和Wnt/β-catenin 信号系统均是调节成骨细胞分化、促进骨形成的重要信号通道。因此,本研究建立小鼠骨质疏松运动干预模型,探讨linc-ROR/Wnt/β-catenin信号通道参与运动预防骨质疏松的机制。
1 材料与方法
1.1 实验动物与运动方案
24只三月龄C57BL雌性小鼠购自扬州大学比较医学动物中心,小鼠购进后随机分配每笼8只,25 ℃恒温喂养,自然光照,自由摄食饮水。小鼠适应性一周后,以4%水合氯醛经腹腔麻醉,皮肤消毒后在脊柱两侧1 cm处分别切开皮肤和肌肉层,将脂肪组织、输卵管和卵巢取出,结扎输卵管并去除卵巢,假手术安静组去除等量的卵巢周围脂肪,伤口缝合。术后将24只小鼠分为3组:(1)假手术组(Sham);(2)卵巢切除组(Ovx);(3)卵巢切运动组(Ex)。运动组小鼠于术后第3周进行适应性运动训练,逐渐达到预定负荷(0.8 km/h,45 min/d;坡度:-9 ℃;5 d/周,共8 周)[3],其余组不进行运动干预,每周记录各组小鼠体重变化。于最后一次训练结束24 h后采用4%水合氯醛麻醉小鼠,收集血液并存放在抗凝管,以5 000 r/min离心10 min,取上层血清置-80 ℃冰箱中保存,用于检测血清激素及生化因子;取双侧股骨、胫骨并在-80 ℃冰箱中保存,检测microCT、mRNA表达。本实验由扬州大学实验动物伦理委员会审核批准(YZUDWLL-201905-001)。
1.2 micro-CT检测
取小鼠取右侧股骨置于75%酒精中保存用于骨密度检测。采用美国Bruker Skyscan系统检测体积骨密度(vBMD)、BV/TV、Tb.Th(trabecular thickness)、Tb.N(trabecular number)和 Tb.Sp,分辨率为10 μm,
1.3 血清激素、生化因子检测
采用酶联免疫吸附法(ELISA)检测血液激素及相关生化指标:血清雌二醇(estradiol,E2)、骨保护素(osteoprotegerin,OPG)、RANKL(receptor activator of NF-κB ligand)。试剂盒购自江莱生物公司(上海,中国),检测流程按试剂盒生产商提供的说明书进行。
1.4 ALP 染色
左侧股骨用10%乙二胺四乙酸脱钙液脱钙,石蜡包埋、切片。把切片浸入ALP孵育液(碱性磷酸酶染色液,Solarbio),置于37 ℃孵育2~12 h。清洗2 min后,浸入硝酸钴溶液中,37 ℃孵育5 min。流水冲洗5 min,再蒸馏水清洗。配制ALP硫化工作液,切片浸入硫化工作液中,孵育2 min。流水洗10 min,再用蒸馏水清洗,然后核固红复染细胞核,蒸馏水清洗。400倍镜下 ALP+成骨细胞(OB)计数。
1.5 real time RT-PCR检测
小鼠左侧胫骨用PBS清洗后,于研磨机内液氮环境下研磨成粉,以Trizol法(Trizol试剂盒,CWBIO 康为世纪)提取总RNA(超纯RNA提取试剂盒,CWBIO 康为世纪)。采用紫外分光光度计测定RNA浓度,并通过A230 nm、A325 nm和A260 nm/A280 nm的值,观察样本被污染的程度及RNA纯度。引物序列由通用生物系统(安徽)有限公司设计并合成(表1)。
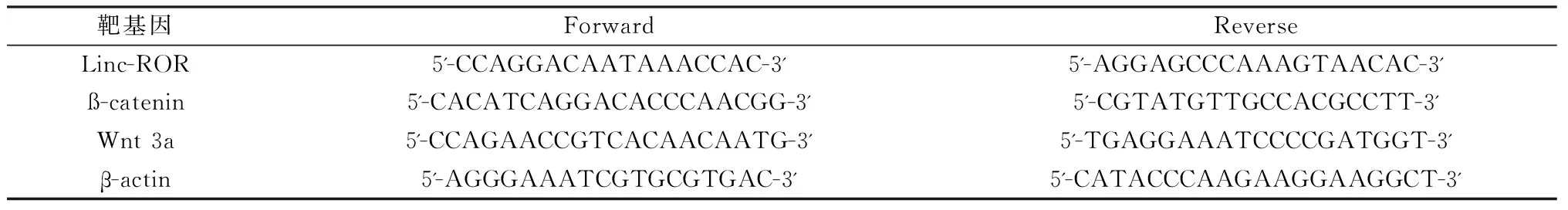
表1 目的基因引物序列Table 1 Primer sequences of the target genes
取1 μg总RNA,逆转录合成cDNA,以SYBR Green PCR Master Mix试剂盒(生命互联公司)进行荧光定量PCR测试。95 ℃ 10 min预变性后,95 ℃ 10 s,58 ℃ 30 s,72 ℃ 30 s,40 cycles。程序运行结束以后,测得Ct值并观察溶解曲线,实时荧光定量PCR测定系统自动记录目的基因及内参基因β-Actin的Ct值,采用2-△△Ct法计算各基因的相对表达量。
1.6 Western blot检测
取右胫骨于研磨机内液氮环境下研磨成粉,加入含有蛋白酶抑制剂的组织裂解液,于冰上匀速研磨15 min。4 ℃、13 000 r/min、离心15 min,取上清。以BCA法进行蛋白浓度测定,按试剂盒(普利莱基因技术有限公司)说明书完成。取各标本蛋白140 μg,加5×loading buffer,混匀,100 ℃煮沸15 min。将样品加入SDS-PAGE胶中,浓缩胶100 V,分离胶120 V,恒压电泳。采用湿式转膜法将蛋白转移至PVDF膜,冰浴中,300 mA恒流转膜160 min。用5%BSA室温封闭l h后,加入一抗(Wnt3a、β-catenin和β-actin,购自中杉金桥公司),4 ℃冰箱过夜。第2天从冰箱将PVDF膜拿出,用TBST洗膜(5 min×3次),加入二抗(购自中杉金桥公司)室温孵育1 h。曝光显影:60 min,TBST洗膜,取出PVDF膜,将超敏发光液(RJ239676,赛默飞公司)置于PVDF上以超高灵敏度化学发光成像系统进行显影拍照并进行分析。将Wnt3a及β-catenin的光密度值分别与相应的β-actin比值作为其蛋白的相对表达量。
1.7 统计学分析
数据采用组平均值±标准差进行报道,采用 one-way ANOVA方法检测各组之间的统计学差异,P<0.05为差异有统计学意义,所有数据采用 STATA15统计软件分析。
2 结果
2.1 一般状况及血清激素、生化因子变化
三组小鼠体重在实验前没有显著差异,实验结束后Ovx小鼠体重明显高于Sham组小鼠,运动可改善体重增加现象。Ovx小鼠子宫重量明显低于对照组,运动也不能改善Ovx小鼠子宫萎缩现象。运动可改善Ovx小鼠血清E2、OPG下降及RANKL升高变化趋势(表2)。

表2 实验前后小鼠一般情况变化Table 2 Changes of characteristics of the mice before and after the experiment
2.2 骨密度、骨形态学变化
Ovx导致小鼠皮质骨、松质骨 vBMD明显下降,运动可改善骨密度下降现象(图1)。Ovx小鼠骨体积(BV/TV)、骨小梁厚度(Tb.Th)及数量(Tb.N)明显减少,而骨小梁宽度(Tb.Sp)增加;运动明显改善卵巢切除导致的这些变化(图2)。
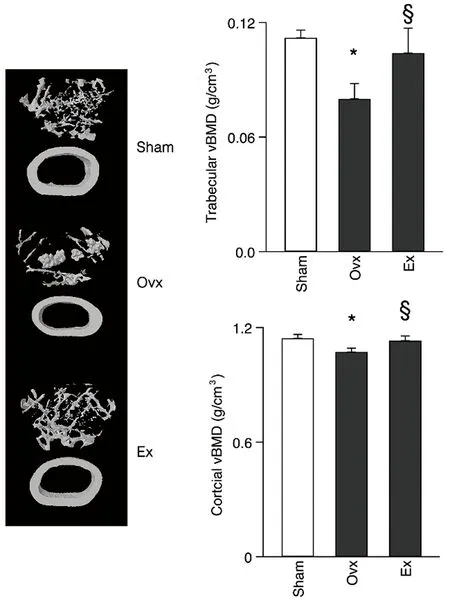
图1 各组小鼠骨密度变化Fig.1 Changes of vBMD in mice in each group
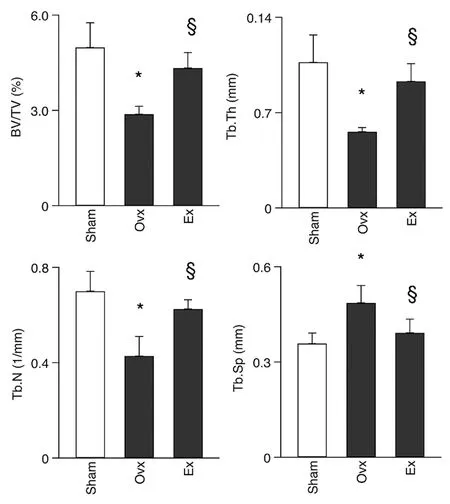
图2 各组小鼠骨形态学变化Fig.2 Changes of bone morphology in mice in each group
2.3 骨组织ALP染色
骨组织ALP染色提示,Sham组小鼠ALP+OB细胞数量较多(图3A),而 Ovx小鼠ALP+OB 细胞数量明显减少(图3B),运动可明显增加 Ovx小鼠骨组织中ALP+OB 细胞数量(图3C)

图3 各组小鼠骨组织 ALP+染色Fig.3 Changes of ALP+ in bone tissue in mice in each group
2.4 Linc-ROR、Wnt 3a和β-catenin表达变化
与 Sham 组小鼠相比,Ovx小鼠骨组织中Linc-ROR以及Wnt 3a、β-catenin mRNA水平下降,而8周运动干预可增加Linc-ROR表达,Wnt 3a和β-
catenin mRNA水平也明显升高(表3)。Ovx小鼠Wnt 3a[(0.362±0.142)%]和β-catenin[(0.275±0.160)%]蛋白表达量下降,而运动干预可明显改善Wnt 3a(0.896±0.462)和β-catenin(1.026±0.412)蛋白表达水平(图4)。
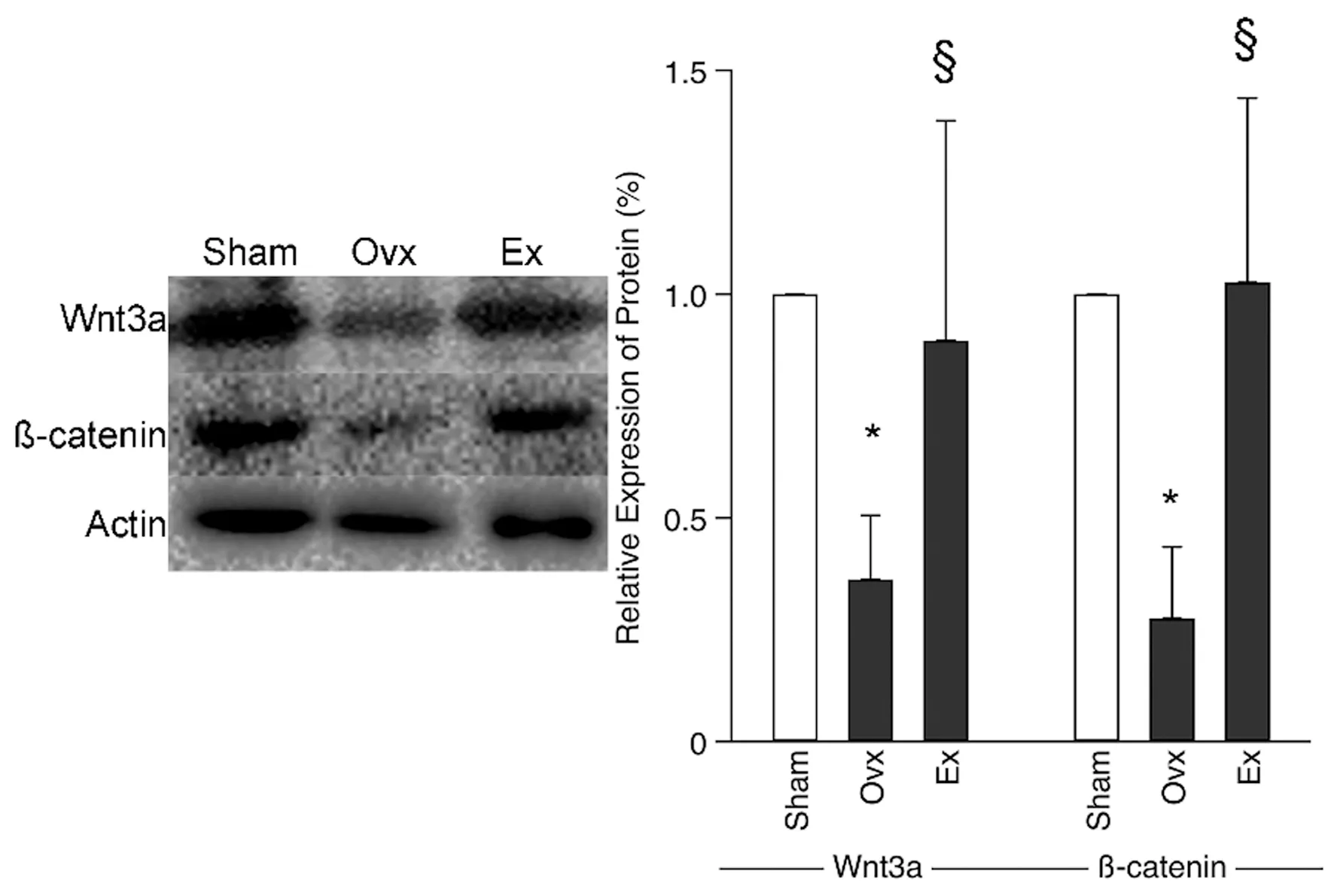
图4 各组小鼠蛋白表达变化Fig.4 Changes of proteins in mice in each group

表3 各组小鼠 Linc-ROR以及Wnt 3a、β-catenin mRNA表达变化Table 3 Changes of Linc-ROR, and Wnt 3a and β-catenin mRNAs in mice in each group
3 讨论
本研究发现8周耐力运动能明显改善卵巢切除小鼠骨量丢失、骨微观结构破坏现象,并且运动还增加骨组织中ALP+OB细胞数量;运动上调Linc-ROR、Wnt 3a和β-catenin mRNA表达,提示运动可能通过调控Linc-ROR/Wnt 3a/β-catenin信号通路、增加成骨细胞合成,从而减少骨量丢失,改善骨微观结构。
本研究发现运动改善卵巢切除小鼠骨量丢失、骨微观结构破坏现象的同时,增加骨组织中成骨细胞数量(ALP+OB),表明运动可能通过促进成骨细胞合成、增加骨量、改善骨微观结构。运动对骨组织产生的机械力刺激可直接作用于骨细胞,从而促进成骨细胞合成、增加骨量积累,抑制破骨细胞合成、减少骨吸收,预防骨质疏松[10]。机械力刺激可通过多种信号途径调节成骨细胞分化[11-12],但与Wnt/β-catenin最为密切。过表达LPR5(low density lipoprotein receptor-related protein 5)可上调机械力刺激促进成骨细胞分化[13],而敲除LPR5则下调机械力刺激促进成骨细胞分化的作用[14],这表明机械力可通过Wnt/β-catenin 信号通路调节骨代谢。Armstrong等[4]进一步发现,机械力刺激增加β-catenin 在成骨细胞中的表达,在雌激素受体-β信号系统参与下促进β-catenin向细胞核内转运,增加下游基因表达,促进成骨细胞分化、增强活性,增加骨形成。
有研究表明,机械力刺激还通过调控骨细胞增加OPG表达、抑制 SOST/sclerostin表达促进成骨细胞分化,减少RANKL分泌,从而抑制破骨细胞合成,维持骨代谢正平衡[15-16]。这与本研究结果一致,本研究发现卵巢切除小鼠血清OPG降低、RANKL升高,运动可降低血清RANKL水平,增加OPG水平,提示OPG、RANKL水平可能是促进成骨细胞合成、抑制破骨细胞数量的一个重要因素。
本研究还发现卵巢切除导致骨组织中 Linc-ROR和 Wnt 3a、β-catenin mRNA表达下降,而运动可明显上调这些基因的表达。鉴于Linc-ROR是调节成骨细胞分化的重要长链非编码 RNA,在转录及转录后水平调节基因表达(如Runx2等),调节成骨细胞分化[17];并且Linc-ROR表达也受到运动的调节[7],因此,本研究结果提示运动通过上调Linc-ROR表达,从而促进成骨细胞化、预防骨质疏松。Feng等[6]报道Linc-ROR通过与miRNA138/145竞争结合,促进Wnt/β-catenin信号系统在成骨细胞中的表达,调控成骨细胞分化。本研究也发现,运动上调Linc-ROR表达的同时,Wnt 3a/β-catenin信号通路表达也升高。鉴于Linc-ROR与Wnt/β-catenin信号系统关系密切,协同调节组织代谢[18];因此,本研究提示运动可能通过上调Linc-ROR/Wnt/β-catenin信号通路预防骨质疏松。
4 小结与展望
本研究发现运动可预防骨质疏松小鼠骨量丢失、改善骨微观结构,并且阐明运动可通过Linc-ROR/Wnt/β-catenin信号通路预防骨质疏松,为寻找安全有效的骨质疏松预防措施提供理论依据。由于本实验主要是在体(invivo)实验研究,尚有不足之处,比如机械力刺激上调成骨细胞内Linc-ROR表达之后,又通过哪些分子机制调控Wnt/β-catenin信号系统,从而调节成骨细胞分化,因此,在以后研究中将开展体外(invitro)细胞培养实验以阐明此分子机制。
