外源性硫化氢通过PI3K/Akt/eNOS通路改善过氧化氢诱导的人脐静脉内皮细胞衰老
2021-08-04牛海名李建伟陈妙莲刘定辉凌叶盛余显冠钱孝贤
牛海名,李建伟,陈妙莲,刘定辉,吴 琳,凌叶盛,余显冠,钱孝贤
(1.中山市人民医院∕中山大学附属中山医院重症医学科,广东中山 528400;2.中山大学附属第三医院心血管内科,广东广州 510630;3.中山大学中西医结合研究所,广东广州 510630)
心血管病是我国城乡居民死亡的首要原因,心血管病患者在今后的10年仍将快速增长[1],这对人们的生命健康造成了极其严重的危害。从冠心病发生发展机制的不断研究中发现,血管内皮细胞功能的障碍是冠心病发展的主要促动因素[2];更进一步的研究发现内皮细胞的衰老是心脑血管事件发生的重要因素[3]。因此,改善内皮细胞早期衰老对于动脉粥样硬化的防治有着重要的意义[4]。继一氧化碳(carbon monoxide,CO)和一氧化氮(nitric ox‐ide,NO)后,硫化氢(hydrogen sulfide,H2S)是被发现的第3 个内源性气体信使[5],能逆转动脉粥样硬化斑块形成[6]。国内外的研究已经证实H2S可以对抗被诱导的内皮细胞的衰老,使受损的内皮细胞功能有所恢复[7],详细的机制并未完全阐明。内皮细胞中的内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)可以促进NO 的产生而发挥舒张血管的作用,其活性和表达均受上游相关蛋白通路的调节;脂酰肌醇3-激酶(phosphatidylinositol 3-ki‐nase,PI3K)∕蛋白激酶B(protein kinase B,Akt)通路可以介导eNOS 的磷酸化,从而影响NO 的含量[8],发挥抗细胞衰老作用。在细胞的增殖、生长及功能等多方面,PI3K∕Akt ∕eNOS 信号通路均具有重要作用[9]。近期已经有进一步的研究表明高糖导致的内皮细胞损伤可以通过PI3K∕Akt ∕eNOS 信号通路被保护和改善[10]。因此,在内皮细胞的功能调控中,启动PI3K∕Akt∕eNOS 信号通路从而发挥精准靶向作用是至关重要的一个环节,有可能在人类动脉血管病变的防治工作中发挥重要的作用。本研究拟进一步探讨PI3K∕Akt∕eNOS 信号通路在外源性H2S 改善过氧化氢(hydrogen peroxide,H2O2)诱导的人脐静脉内皮细胞(human umbilical vein endotheli‐al cells,HUVEC)衰老中的作用机制。
1 材料与方法
1.1 材料
原代HUVEC来源于我院产科健康剖宫产产妇的脐带,实验选用第2~4 代HUVEC。内皮细胞的提取试剂包括:Ⅰ型胶原酶(GIBCO 公司)、0.05%EDTA 胰酶(GIBCO 公司);内皮细胞培养试剂包括:M199培养基(GIBCO 公司)、无血清培养基(GIBCO 公司)、胎牛血清(GIBCO 公司),以及从BD公司购买的内皮细胞生长添加剂(endothelial cell growth supplement,ECGS)。硫氢化钠(NaHS)购自于Sigma 公司,30 % H2O2购自于广州化学试剂厂,衰老相关β-半乳糖苷酶(senescence-associated βgalactosidase,SA-β-Gal)染色相关试剂。全蛋白提取试剂盒、蛋白定量试剂盒(BCA)和NO 测试盒分别购买自南京凯基生物有限公司、上海生工生物技术服务有限公司、南京建成生物工程研究所。从美国的Millipore 公司采购PVDF 膜、ECL plus 超敏免疫印迹检测试剂盒;凝胶电泳中所需要的甲叉双丙烯酰胺和丙烯酰胺购买于美国Bio-Rad 公司;牛血清白蛋白(BSA)、十二烷基磺酸钠(SDS)、Tris 碱、过硫酸铵(AP)、Tween-20 均采购自美国MBCHEM公司。封闭液的主要成分(脱脂奶粉)为中国伊利产品。依照实验所需要的蛋白抗体,从美国Cell Signaling Technology 公司购买的eNOS 兔抗、Akt 兔抗以及p-Akt 鼠抗;从美国Santa Cruz 公司购买的鼠抗Ⅰ型抗纤溶酶原激活物抑制剂(plasminogen activator inhibitor 1,PAI-1);从美国Protein Tech Group公司购买的兔抗GAPDH;从武汉博士德公司购买的辣根酶标记羊抗兔IgG,辣根酶标记羊抗鼠IgG;实验所需要的Marker 则购买自Fermentas公司。
1.2 方法
1.2.1 HUVEC 原代提取及培养 本研究经中山大学附属第三医院及中山大学附属中山医院伦理委员会批准,符合Helsinki 宣言中的原则,已取得患者知情同意。原代HUVEC分离提取及培养参照目前经典方法[11],方法如下:在无菌条件下用PBS 冲洗健康新生儿脐带3 遍,然后用0.1 %Ⅰ型胶原酶消化15 min,收集胶原酶细胞混合液,300 ×g离心7 min 后弃上清,加完全培养基(20 %FBS,20 %SFM 和60 μg∕mL ECGS)混匀种于铺有0.2 %明胶的T25 培养瓶中,置于37 ℃,含有体积分数5 %CO2的无菌培养箱中培养。经过一天的培养后,取出培养瓶在超净工作台内用PBS冲洗去掉没有贴壁生长的内皮细胞和残留未洗净的红细胞,然后继续放置于5%CO2的无菌培养箱中培养。近年来,国际上多采用血小板源内皮细胞粘附分子1(platelet endothelial cell adhesion molecule-1,CD31)来鉴定内皮细胞,因此本实验取第1代细胞,消化收集后交由我院中心实验室对同一批所取HUVEC 检测细胞表面标志物CD31;并在普通倒置显微镜下观察细胞。当细胞融合至90% 以上时,在超净工作台内用含有EDTA 的0.05 % 胰酶消化传代至T25 培养瓶中,并继续传代培养。第2~4 代HUVEC将作为我们实验所用的细胞。
1.2.2 衰老模型的建立及细胞分组建立H2O2诱导人脐静脉内皮细胞衰老模型,细胞分为空白对照组(Control)和模型组(60 μmol∕L H2O2)[12];当细胞生长至约70%时,加入60 μmol∕L H2O2刺激1 h,后换成正常培养基培养24 h。通过SA-β-Gal 染色、PAI-1 表达鉴定模型是否成功。SA-β-Gal 染色参照既往方法进行[13],简要过程如下:用PBS 轻轻清洗细胞2 次,0.5 % 戊二醛溶液固定5 min 后,每孔加入1 mL 染色工作液,用锡箔纸遮盖后将细胞置于37°C 下孵育18 h。孵育结束后倒置显微镜下进行计数和拍照,SA-β-Gal染色阳性率计算方法为:连续计数400 个细胞,计算出蓝染细胞(即SA-β-Gal 染色阳性细胞)数目∕400 个细胞的百分比。PAI-1 蛋白表达检测方法参见Western blot 部分;在探讨硫化氢改善内皮细胞早衰及其机制时分为:空白对照组(Control)、衰老模型组(60 μmol∕L H2O2)、50 μmol∕L NaHS 干预组、100 μmol∕L NaHS干预组和200 μmol∕L NaHS干预组。
1.2.3 Western Blot 蛋白提取液预先配置好,严格按照南京凯基生物有限公司全蛋白提取试剂盒说明书进行操作,将磷酸酶抑制(7 μL)、蛋白酶抑制剂(0.7 μL)和PMSF(3.5 μL)加入到每700 μL 裂解液里。实验所需每组细胞均使用PBS 清洗2 次,将已经配制好的蛋白∥取液按照培养孔底面积而计算出相应的量,逐个加入每组细胞培养孔底,并放置于冰面上进行10 min 的裂解;到时间后,使用细胞刮逐个板孔刮下每组细胞,再用移液枪将每组细胞提取液吸至预先标记好的预冷EP 管内;将装有各组细胞提取液的EP管继续放置冰上于摇床上进行15 min 的混匀裂解,结束后于4oC,14 000 ×g离心15 min;进行完以上的提取操作后,应用移液枪吸取每组管内的上清液至新的分别标记的EP管,使用BCA 法测定蛋白浓度,分装保存于-80oC冰箱,作为我们实验所用各组蛋白提取液备进行下一步实验。
每个泳道蛋白上样总量为20 μg,SDS-聚丙烯酰胺凝胶电泳分离样品蛋白,电转移至偏聚二氟乙烯(PVDF)膜上;使用5%脱脂奶粉室温封闭1 h,分别加入下列一抗:PAI-1 鼠抗(1:1 000)、eNOS 兔抗(1:1 000)、Akt 兔抗(1:1 000),以及p-Akt 鼠抗(1:2 000),GAPDH(1:10 000),并放置于4oC 冰箱摇床上过夜;第二天弃去一抗,用TBST(Tris 50 mmol∕L,NaCl 100 mmol∕L,pH7.5,含1 %Tween20)清洗3 次(每次5 min),然后分别加入二抗:辣根酶标记羊抗鼠IgG(1:10 000)、辣根酶标记羊抗兔IgG(1:10 000);室温孵育1 h 后弃去二抗,放置于1×TBST 摇床上清洗3 次;使用ECL 显影,蛋白条带使用Quantity One 软件进行分析。
1.2.4 细胞上清液NO含量测定 严格按照南京建成生物研究所NO试剂盒说明书进行操作。简要的过程如下:收集实验中各组内皮细胞上清液作为待测样本;按照步骤加入样本0.1 mL 及混合试剂0.4 mL(试剂一与试剂二1:1 混匀配制),37 ℃水浴60 min;加入试剂三0.2 mL、试剂四0.1 mL,充分旋涡混匀30 s,室温静置40 min,离心10 min;取各组上清液0.5 mL,均加入显色剂0.6 mL 混匀,室温静置10 min,波长550 nm,光径0.5 cm,测定各组吸光度值。
1.3 统计学处理
采用SPSS 21.0 分析软件,定量数据以均数±标准差()表示;只有两组计量资料时,通过正态性检验确认正态性和方差齐性后使用独立样本t检验;多组计量资料通过正态性检验和方差齐性检验确认为正态分布且方差齐后,数据组间差异性比较采用单因素方差分析(one-way ANOVA),差异有统计学意义时采用LSD-t法进行组间两两比较。P<0.05可认为差异具有统计学意义。
2 结果
2.1 内皮细胞的鉴定与衰老模型的建立
在倒置显微镜下,从脐带静脉消化下来的HU‐VEC初为圆形,接种24 h后,细胞完全贴壁,早期细胞呈现多角形,胞浆丰富,核清晰,核分裂相多见,细胞融合后,呈典型的铺路石样排列(图1A);48~72 h 后原代细胞融合度90%左右,以1:2 或者1:3传代。我院中心实验室检测细胞表面标志物CD31的结果显示所取细胞的第一代细胞CD31 表达率98.99%,符合内皮细胞特性(图1B)。按照我们既往的研究成果,选择60 μmol∕L H2O2作用于内皮细胞1 h可以有效诱导内皮细胞衰老而不出现明显凋亡[14]。60 μmol∕L H2O2加入到生长至约70%的内皮细胞进行刺激,1 h 后换成正常培养基再培养24 h。通过SA-β-gal 衰老染色(图2A、B),发现60 μmol∕L H2O2刺激组SA-β-gal 阳性率显著增多(P<0.001),两组数据满足方差齐性(F=5.374,P=0.081);通过Western blot 实验(图2C、D),60 μmol∕L H2O2刺激组PAI-1 表达显著增加(P<0.001),两组数据满足方差齐性(F=4.000,P=0.116);均通过t检验分析,与正常对照组相比,差异均具有统计学意义。

图1 人脐静脉内皮细胞的鉴定Fig.1 The identification of HUVEC
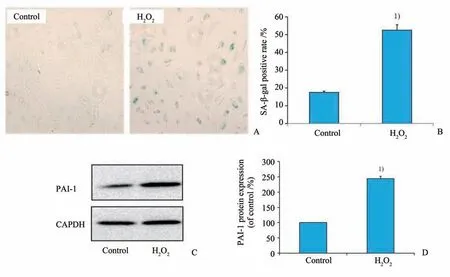
图2 H2O2预处理对细胞衰老的影响Fig.2 The effects of H2O2 pretreatment on cell senescence
2.2 NaHS对内皮细胞衰老的影响
根据我们既往的分组、研究,用不同浓度的NaHS预处理细胞24 h后,再加入60 μmol∕L H2O2刺激细胞1 h,并继续培养24 h后,收集组细胞固定后进行SA-β-gal 染色,以及各组蛋白进行PAI-1 蛋白水平的测定。从图3A、B 中可以看出,与对照组相比,60 μmol∕L H2O2诱导衰老模型组SA-β-gal 阳性率明显增加(P<0.001),而加入50 μmol∕L,100 μmol∕L 及200 μmol∕L NaHS 预孵育24 h 组细胞SA-β-gal阳性率明显低于衰老模型组(P<0.001),其改善程度具有浓度依赖性。同样,在图3C、D中,60 μmol∕L H2O2诱导衰老模型组PAI-1表达增加(P<0.001),而加入不同浓度NaHS 预孵育组能减少PAI-1 蛋白水平表达(P<0.001),提示NaHS 可改善内皮细胞的衰老,其改善程度具有浓度依赖性。

图3 NaHS预处理对各组细胞衰老的影响Fig.3 Effect of NaHS pretreatment on the senescence of HUVEC
2.3 NaHS预处理对PI3K/Akt/eNOS通路的影响
首先,我们对各组细胞中的p-Akt 蛋白进行检测。从图4A、B 看出,与对照组相比,60 μmol∕L H2O2诱导衰老模型组p-Akt 蛋白表达增多(P<0.01),与衰老模型组相比,50 μmol∕L,100 μmol∕L及200 μmol∕LNaHS 预孵育24 h 组p-Akt 蛋白表达进一步增多(P<0.01),其增加程度具有NaHS浓度依赖性;而各组Akt蛋白表达无明显差别。
然后我们进行了各组细胞eNOS 蛋白的检测。60 μmol∕L H2O2诱导衰老模型组eNOS 蛋白表达明显减少(P<0.001),与衰老模型组相比,100 μmol∕L 及200 μmol∕L NaHS 预孵育24 h 组eNOS 蛋白表达显著增加(P<0.001),其增加程度具有NaHS 浓度依赖性(图4C、D)。提示NaHS 可提高老年内皮细胞的eNOS 蛋白活性,进而我们推测NaHS 可能通过激活PI3K∕Akt∕eNOS 通路来对抗衰老。
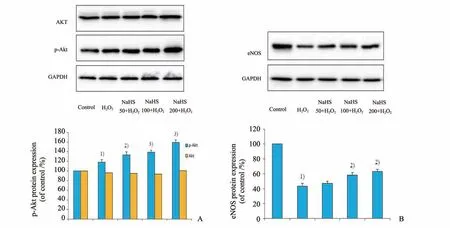
图4 NaHS预处理对各组细胞PI3K/Akt/eNOS通路的影响Fig.4 Effect of NaHS pretreatment on PI3K/Akt/eNOS signaling pathway in HUVEC
2.4 NaHS预处理对衰老内皮细胞NO含量的影响
为了更加完整的证明和阐述PI3K∕Akt∕eNOS信号通路可以促进内皮细胞中NO的产生从而发挥舒张血管的作用,我们对每组细胞上清液中的NO 含量也进行了相关检测。与对照组相比,60 μmol∕L H2O2诱导衰老模型组NO 含量显著减少(P<0.001)。而 加 入50 μmol∕L,100 μmol∕L 及200 μmol∕L NaHS 预孵育24 h 的3 组NO 含量较早衰模型组升高(P<0.01),并且对NO含量的影响具有浓度依赖性(图5)。
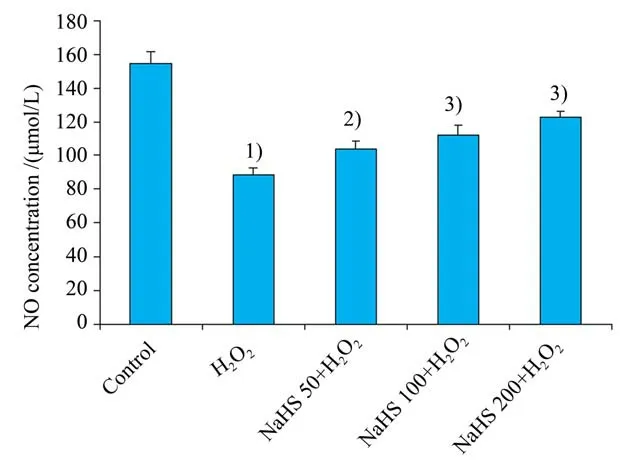
图5 NaHS预处理对各组细胞内NO含量的影响Fig.5 Effect of NaHS pretreatment on NO concentration in HUVEC
3 讨论
我们在本研究中发现,HUVEC 衰老模型组中的PAI-1 蛋白表达和SA-β-gal 阳性细胞率均可被外源性H2S 减少,即外源性H2S 成功的延缓了HU‐VEC的老化过程。NaHS的预处理可以改善H2O2诱导的HUVEC 的衰老,可能是通过激活PI3K∕Akt∕eNOS通路来发挥其影响衰老的HUVEC的作用。
H2S 是人体内的第3 种气体信号分子,在心血管系统的功能保护中发挥了重要的作用[14],有研究发现,硫化氢可以延缓动脉粥样硬化斑块的形成,及减小斑块,动脉粥样硬化形成的其中一个重要原因就是体内H2S 水平的下降[15]。我们课题组既往研究也证实外源性H2S 可以通过抗氧化应激[12]、调控Sirt1∕eNOS信号通路[16]来改善内皮细胞衰老。
另一种气体信号分子NO 主要由内eNOS 在内皮细胞中产生[17],可以减少细胞凋亡、抑制白细胞和血小板对血管壁的粘附、舒张血管等。NO 可以单独或者与H2S 协同舒张血管平滑肌;血管舒张效应在单独应用H2S 的情况下很微弱,而其舒张效应在有NO存在的情况下可以增加13倍[18]。
PI3K 是一种重要的细胞脂质激酶,它通过磷酸化磷脂酰肌醇将磷脂酰肌醇-4,5 二磷酸盐转化为磷脂酰肌醇-3,4,5 三磷酸盐,后者作为细胞内重要的二级信使,将Akt 招募到质膜上并使其发生磷酸化。Akt 在PI3K∕Akt 信号通路中处于中心环节,可以被上游很多种信号分子激活而被磷酸化,同样,磷酸化的Akt 则可进一步调节下游多种效应分子的活化、表达等状态。磷酸化激活的Akt 可通过提高凋亡调控蛋白的表达来抑制细胞凋亡[19],也可以通过抑制磷酸酶和张力蛋白同源物来减轻血管平滑肌细胞存活的抑制,从而保护心肌细胞免受伤害[20]。eNOS 同样是Akt 下游重要的一种底物,可以被Akt 直接磷酸化其ser177 位点而被激活[21]。磷酸化Akt 调节可以通过PI3K∕Akt∕eNOS 信号通路增强eNOS 释放NO,发挥舒张血管的作用[22],小鼠主动脉内皮细胞功能障碍也可以通过PI3K∕Akt∕eNOS信号通路得到缓解[23]。目前,国内外关于H2S与Akt 磷酸化相互关系的研究也逐渐增多,例如H2S 可以抑制Akt 过度磷酸化从而延缓内皮细胞的衰老[24-25],而在另外的研究中发现H2S 促进存活大鼠模型中的新生血管的形成和生长,依赖于血管内皮细胞中PI3K∕Akt 通道的激活。我们本次的研究也进一步丰富了H2S 改善内皮细胞衰老,尤其是使用H2O2诱导的内皮细胞早期衰老的机制。
在我们的实验研究中,衰老模型的p-Akt 表达增多,说明Akt 能影响衰老的进程,eNOS 蛋白表达减少,NO含量减少。而与衰老模型组相比,加入不同浓度硫氢化钠预保护组p-Akt 蛋白表达进一步增加,eNOS 蛋白表达增加,同时,NO 含量也呈现出与H2S 浓度梯度相关的增加。这样的结果,我们推测可能是通过上调PI3K∕Akt 路径,增加eNOS 蛋白的表达,进而出现细胞NO含量的增加,从而发挥抗内皮细胞衰老的作用。本研究经过实验发现NaHS对内皮细胞衰老的改善作用可能与激活PI3K∕Akt∕eNOS 信号通路有关,若要确定该信号通路在NaHS改善衰老中的作用,还需要进一步使用信号通路特异性抑制剂进行验证。综上所述,本次研究进一步证实了H2S 防治内皮细胞衰老的可行性,以及可能作用机制;也为内皮细胞衰老和动脉粥样硬化的临床干预都提供了新的思路和靶点。
