糖尿病合并脓毒症小鼠肠损伤特点
2021-08-04庞昌季曹钰玲邓颖青池信锦
庞昌季,谭 芳,郑 磊,曹钰玲,邓颖青,池信锦
(中山大学附属第七医院麻醉科,广东深圳 518107)
糖尿病的检出率及患病率逐年上升[1-2],已成为威胁人类健康的世界性公共卫生难题,在中国这一情况更为严重[3-4]。脓毒症是由感染引起的全身炎症反应综合征,是重症病房中非心脏病人死亡的首要病因,病死率高达17%~26%[5]。糖尿病并发脓毒症的风险是非糖尿病患者的2.5~6.0 倍[6]。糖尿病可加重脓毒症时心脑血管、呼吸、泌尿等全身重要器官功能障碍,但其具体损伤机制尚未明确[7-9]。肠道损伤是脓毒症发展为多器官功能障碍(MODS)的始动环节,肠道中肠黏膜屏障功能的存在保障了机体在肠道内寄居多种细菌下不会被感染[10-11]。肠内巨噬细胞在肠黏膜屏障中识别内毒素,吞噬病原体,并进一步激活下游免疫功能。激活的M1 型巨噬细胞可分泌IL6、IL8、TNF 等促炎因子,介导炎症反应和免疫监视作用,但是释放一氧化氮(NO)、超氧和基质金属蛋白酶(MMPs)等可诱导组织损伤。巨噬细胞极化在炎症相关疾病的发生发展中发挥关键性的作用[12-13]。Liu 等[14]研究证实促进巨噬细胞向M1 转化,M1∕M2 比例增高加重肠缺血再灌注损伤,而逆转这一变化,则具有显著的防治效果。然而,糖尿病合并脓毒症时肠损伤情况及巨噬细胞极化特点目前相关研究较少。本研究拟通过构建糖尿病脓毒症小鼠模型,观察糖尿病合并脓毒症时肠损伤特点,并结合体外细胞实验,初步探讨巨噬细胞极化在其中的可能作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF 级BKS-DB(Lepr wt/wt)野生型小鼠12 只,体质量20~25g;SPF 级BKS-DB(Lepr ko/ko)糖尿病小鼠12只,体质量40~45 g,均为雄性,6~8 周龄,由广东省药康生物科技有限公司提供,许可证号:SCXK(粤)20200054。实验动物饲养于SPF 屏障环境:动物房环境在(23±2)℃,相对湿度在(55±5)%,及12 h 光∕暗循环,水和食物获取自由。实验动物的管理及处置遵循广东省动物管理委员会准则及动物福利准则。
1.1.2 实验试剂 脂多糖(Lipopolysaccharide,LPS)(Sigma,L4524);DMEM 培养基(凯基);West‐ern Blot 抗 体Occludin(abcam)、ZO-1(abclonal)、GAPDH(abclonal);免疫荧光抗体F4∕80(赛维尔);RNA 提取试剂Trizol(Invitrogen);RNA 逆转录试剂盒 和SYBR®Green Real-time PCR Master Mix(TOYOBO);qPCR 引物序列(广州复能生物技术有限公司);CD86 流式抗体(Biolegend);CD163 流式抗体(Biolegend)。
1.2 实验方法
1.2.1 小鼠脓毒症模型的建立 小鼠随机分成4组(n=6):非糖尿病假手术组(NDMS)、非糖尿病脓毒症模型组(NDMCLP)、糖尿病假手术组(DMS)、糖尿病脓毒症模型组(DMCLP)。模型组采用盲肠结扎穿孔法(CLP)建立脓毒症模型。雄性小鼠,常规禁食8 h后,腹腔注射100 g∕L 水合氯醛0.3 mL∕kg麻醉小鼠。在腹部正中间沿腹白线做一个长1 cm的切口。取出盲肠,将盲肠全长分为3等分,用4-0尼龙缝线结扎其近回盲瓣端1∕3 处,在结扎处与盲肠盲端之间中点处用22G 无菌注射器针头从系膜缘向对系膜缘贯通穿刺,然后轻轻挤压穿刺点附近盲肠并挤出少许肠内容物,将盲肠连同挤出的内容物一同还纳入腹腔,逐层缝合并关闭腹腔。术后给予4 mL∕100g生理盐水皮下注射进行液体复苏。假手术组的动物不进行盲肠的结扎和穿孔,其余的处理与模型组相同。手术过程尽量避免动物体液的大量丢失,并注意实验动物体温的维持。
1.2.2 细胞培养与处理 采用小鼠巨噬细胞样细胞系RAW264.7 细胞株(中国科学院细胞库,目录号SCSP-538)培养条件:100 ml∕L FBS 的DMEM 培养基加1% PSG 双抗,于37 ℃、含体积分数为5%CO2的培养箱中传代培养。细胞以5×104∕mL 的密度铺板于6 孔板,利用35 mmol∕L 高糖和LPS 1 μg∕mL 共同刺激24 h 后收集细胞,分别用于流式细胞和RT-qPCR检测。
1.2.3 病理学检测 取小肠组织用40 g∕L 多聚甲醛固定,常规石蜡包埋,制作3~4 μm 蜡切片,行苏木素-伊红(HE)染色,于光学显微镜下观察肠组织病理改变。每张片随机选取10个视野,按照Chiu's评分标准进行评分。
1.2.4 蛋白免疫印迹(Western blot)取小鼠小肠组织,称质量后加入预冷的组织蛋白裂解液(RI‐PA:PMSF 100:1),冰上碾磨组织,4 ℃条件下12 000×g离心20 min,收集上清,采用BCA 法测定蛋白浓度。取25 μg 蛋白进行SDS‐PAGE 电泳分离蛋白,并将蛋白转移PVDF 膜上,5%脱脂牛奶室温封闭1 h,分别加入Occludin、ZO-1 抗体,4 ℃孵育过夜。次日,加入相应二抗室温孵育1 h,ECL 试剂曝光显影,在全自动凝胶成像系统中曝光显影,以GAPDH为内参照,分析蛋白水平。
1.2.5 实时荧光定量PCR(RT-qPCR)应用Trizol提取组织和细胞总RNA,采用逆转录试剂盒将RNA逆转录为cDNA,应用SYBR Green法进行定量PCR 反应,以上步骤按照说明书操作。TNF-α、IL-1β、IL-6、iNOS、CRR7、Arg1、Fizz1 引物由广州复能提供验证后引物。
1.2.6 免疫荧光染色 组织石蜡切片常规固定、脱蜡、高压修复和封闭。封闭后加入一抗:兔多克隆抗体(1:1 000,F4∕80,赛维尔),4 ℃湿盒孵育过夜后,PBS 清洗一抗,敷相应已稀释的FITC 标记的山羊抗兔二抗(1∶200;激发波长:492 nm,发射波长:520 nm)中,室温避光孵育1 h,PBS 清洗二抗。晾干后于荧光显微镜(EVOS FL,Life Technologies,Carlsbad,CA)下观察并拍照。
1.2.7 流式细胞术 经高糖和LPS 处理后的细胞用PBS 清洗3 次,离心收集细胞。然后细胞4 ℃CD86 和CD163流式抗体(Biolegend)共孵育30 min,流式细胞缓冲液清洗细胞3 次,流式细胞术检测CD86 和CD163 表达,最后使用软件FlowJo 分析数据。
1.3 统计分析
采用GraphPad Prism 8 软件进行数据分析,实验数据以均数±标注差(xˉ+s)表示,多组间比较采用单因素方差分析ANOVA 分析,组间两两比较采用Bonferroni 校正的t检验行组间两两比较,检验水准α=0.05(双尾),P<0.05 为差异有统计学意义。
2 结果
2.1 肠组织病理学改变及评分
HE 染色显示NDMS 组小鼠肠黏膜完整,绒毛排列整齐;DMS组小肠粘膜增厚,绒毛轻度水肿,绒毛顶端上皮下间隙增大;NDMCLP 组小鼠肠黏膜失去完整性,绒毛脱落,炎性细胞浸润;DMCLP 组肠黏膜破坏严重,绒毛上皮成块脱落,炎性细胞浸润,绒毛固有层间隙扩大,充血明显。Chiu’s 评分显示,糖尿病鼠脓毒症模型组肠黏膜损伤程度比非糖尿病鼠模型组更严重;各组间差异具有统计学意义(F=73.94,P=0.000;图1)。

图1 四组小鼠肠组织病理评分的比较Fig.1 Intestinal pathological changes and Chiu’s scores
2.2 Western Blot检测肠组织Occludin、ZO-1表达
为了观察肠道屏障功能改变,我们采用West‐ern Blot 检测肠屏障功能核心蛋白Occludin、ZO-1的表达,结果显示,糖尿病小鼠肠组织Occludin、ZO-1 蛋白表达降低(NDMS 组和DMS 组);与非糖尿病模型组相比,糖尿病模型组Occludin、ZO-1 蛋白表达显著降低。各组间差异具有统计学意义(Occludin:F=178.5,P=0.000;ZO-1:F=16.55,P=0.001;图2)。
2.3 肠巨噬细胞极化情况
为了观察巨噬细胞数量与分布,我们采用免疫荧光的方法检测巨噬细胞标记F4∕80 的表达,结果显示DMCLP 组肠组织中巨噬细胞明显增加(图3 A)。为了进一步探究巨噬细胞极化特点,我们选用qPCR 方法分别检测M1 和M2 巨噬细胞标志物iNOS、CRR7和Arg1、Fizz1 mRNA 表达情况,结果显示,与NDMCLP 组相比,DMCLP 组肠道组织M1 型巨噬细胞特异性标志物iNOS、CRR7 表达明显增加,M2 型巨噬细胞标志物Arg1 表达无统计学差异(iNOS:F=137.4,P=0.000;CRR7:F=20.70,P=0.000;Arg1:F=3.42,P=0.07;Fizz1:F=7.59,P=0.01;图3 B)。
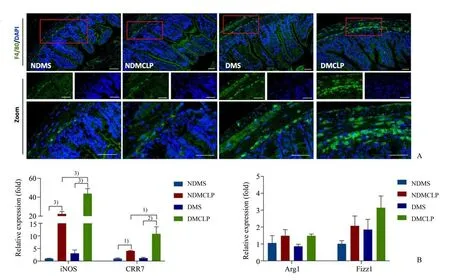
图3 糖尿病脓毒症小鼠肠组织M1型巨噬细胞表达升高Fig.3 Increased expression of M1 macrophages in intestinal tissues of diabetic mice after CLP
2.4 肠组织TNF-α、IL-1β、IL-6 mRNA表达水平
CLP 模型组与相应的对照组相比,肠组织TNF-α、IL-1β 和IL-6 mRNA 表达明显上升(P<0.05);与NDCLP 组相比,DCLP 组TNF-α、IL-1β 和IL-6 mRNA 表达升高更加明显。各组间差异具有统计学意义(TNF-α:F=105.9,P=0.000;IL-1β:F=86.63,P=0.000;IL-6:F=42.46,P=0.000;图4)。

图4 糖尿病脓毒症小鼠肠组织TNF-α、IL-1β、IL-6 mRNA表达升高Fig.4 Increased mRNA expression of inflammatory factors in intestinal tissues of mice after CLP
2.5 高糖促进LPS 诱导的巨噬细胞向M1 极化和炎症因子的释放
为了初步观察高糖与巨噬细胞极化的关系,我们采用高糖与LPS 共同刺激巨噬细胞模拟体外糖尿病合并脓毒症细胞模型。流式细胞检测显示,LPS组和HG+LPS组M1巨噬细胞标志CD86表达量增加,但HG+LPS 组更加显著,各组间差异具有统计学意义(CD86:F=289.2,P=0.000;图5 A、B)。同时我们采用qPCR 方法检测炎症因子TNF-α、IL-1β 和IL-6 mRNA 表达情况,结果显示与M1巨噬细胞标志CD86 表达情况相似,各组间差异具有统计学 意 义(TNF-α:F=94.73,P=0.000;IL-1β:F=149.8,P=0.000;IL-6:F=1406,P=0.000;图5 C)。
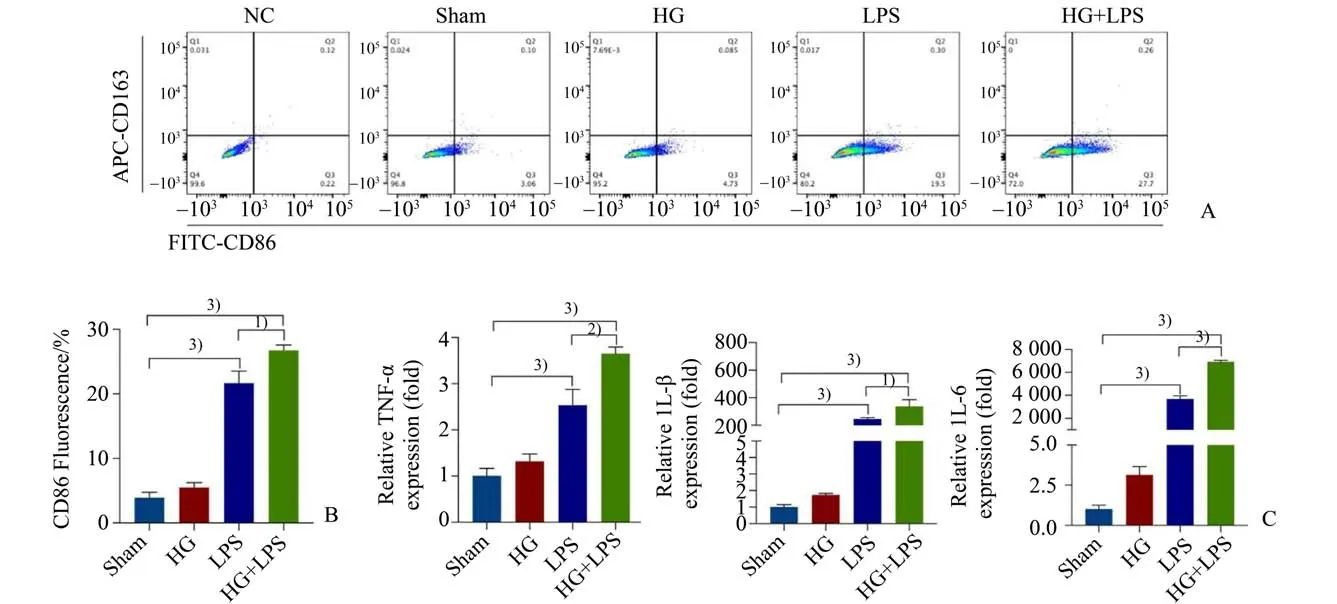
图5 高糖与LPS共刺激时巨噬细胞标记物和炎症因子mRNA表达增加Fig.5 High glucose increased expression of M1 macrophages markers and inflammatory factors mRNA expression in LPScondition
3 讨论
本研究发现糖尿病合并脓毒症小鼠肠损伤较非糖尿病小鼠明显加重,其肠损伤病理评分显著增加,肠道屏障功能改变。同时,我们发现糖尿病合并脓毒症小鼠肠组织中巨噬细胞浸润显著增加,M1巨噬细胞数量增加,TNF-α、IL-1β和IL-6mRNA 表达上调,而M2 巨噬细胞标志物表达无统计学差异,这提示M1 型巨噬细胞可能参与了糖尿病合并脓毒症小鼠的肠损伤。细胞实验进一步确认LPS 刺激下M1巨噬细胞标志物CD68表达增加,伴炎症因子基因表达上调,更多细胞向M1型极化,在高糖联合LPS 共刺激下,巨噬细胞表现出更高的M1 极化倾向,这提示糖尿病合并脓毒症时巨噬细胞更易向M1 型极化,使得肠损伤较非糖尿病小鼠更严重。
高血糖是许多疾病的危险因素[15-18],包括心血管疾病、肾脏疾病、肠道疾病和脓毒症。糖尿病合并脓毒症时肠道损伤特点较少关注。本实验采用BKS-DB(Lepr ko/ko)糖尿病小鼠经CLP术建立脓毒症小鼠模型,观察其肠道损伤的情况,结果发现糖尿病合并脓毒症时肠损伤更加显著。肠道屏障功能是人体抵御肠道有害物质的重要防线,肠道紧密连接蛋白是肠道机械屏障的基础结构,可通过维持正常的细胞旁通透性,来达到防止细菌代谢产物和大分子有毒物质等通过细胞旁连接入侵机体的作用。紧密连接由跨膜蛋白(Occludin、Claudin-3、Claudin-5)和胞质蛋白(ZO-1、ZO-2、ZO-3)组成[19]。Occludin、ZO-1是肠屏障功能的核心。ZO-1缺乏会扰乱细胞间的紧密连接,因此ZO-1水平降低与肠组织的屏障破坏紧密相有关[20]。Yoseph[21]等研究验证了紧密连接蛋白Occludin 和ZO-1的含量下降与肠道通透性增加的关系。同样Wu[22]研究也使用了紧密连接蛋白Occludin 和ZO-1 的含量来证实肠损伤。因此,本研究通过检测Occludin 和ZO-1 来评估肠道屏障功能损伤情况。分别比较糖尿病或非糖尿病小鼠假手术组和脓毒症组,发现Occludin 和ZO-1 表达量在脓毒症组下降显著,说明脓毒症造成了显著的肠道损伤,并且糖尿病合并脓毒症小鼠的Occludin 和ZO-1 表达下降最为明显。这与我们的病理结果是一致的。Zhong[23]研究发现糖尿病患者肠道黏膜水肿率高达78.9%,远高于健康对照人群。Yuan[24]研究也发现糖尿病患者肠道屏障功能受损,且血糖控制不佳与更差的肠道屏障功能相关。这都提示我们在糖尿病患者中,肠道黏膜水肿,肠道轻度损伤长期存在,在遭遇脓毒症时极易出现肠道损伤,且肠道损伤程度也会更重。
糖尿病导致的高血糖会触发机体的慢性低程度炎症反应,研究表明持续的高血糖会激发激活Toll 样受体诱发代谢活跃的脂肪细胞炎症因子的分泌,进而加重全身的慢性代谢性炎症反应[25]。Newton[26]发现Treg 细胞功能的缺陷和数目减少与糖尿病发生发展存在关联。不管糖尿病患者是否存在并发症,均出现T 淋巴细胞亚群的活性与数量异常的情况,说明机体处于免疫失衡状态。肠巨噬细胞存在于肠粘膜固有层内,是维持肠内稳态和肠道免疫屏障的重要组成部分,同时肠巨噬细胞也是炎症反应中重要的效应细胞。巨噬细胞在对抗损伤的过程中根据微环境的不同表现出可塑性和多能性,呈现不同的表型。当机体遭受细菌毒素入侵时巨噬细胞可被大量激活发挥吞噬、抗原提呈和免疫调节作用[27]。M1∕M2 动态平衡对机体炎症反应程度和疾病转归具有重要意义[28~29]。Huang等[30]充分讨论了M1∕M2 极化状态在急性肺损伤过程中的作用,M1 可促进急性肺损伤的发展,而M2 则发挥保护作用。Liu 等[14]研究发现巨噬细胞M1 转化与肠道缺血再灌注损伤密切相关,逆转这一变化可以改善肠道损伤。我们研究发现,脓毒症小鼠,肠道巨噬细胞数量明显增加,M1 型巨噬细胞特异性标志物iNOS、CRR7 表达明显增加,炎症因子TNF-α、IL-1β、IL-6 mRNA 表达上调,而M2 型巨噬细胞标志物Arg1 表达无显著差异,这与肠道损伤情况一致,提示巨噬细胞M1型极化,在脓毒症肠损伤时发挥重要作用。值得注意的是在糖尿病合并脓毒症时表达最多,糖尿病脓毒症情况下M1 极化趋势及炎症因子表达更加显著,免疫荧光可见糖尿病肠组织中巨噬细胞浸润显著,细胞实验也证实高糖联合LPS 共刺激下M1 极化更明显,因此,我们推测糖尿病的高糖状态可能易化了巨噬细胞向M1 极化,导致糖尿病小鼠合并脓毒症时肠损伤程度更严重。
本研究的局限性在于仅观察到糖尿病合并脓毒症小鼠肠损伤更加严重,高糖时巨噬细胞更易在LPS 的作用下向M1 极化;对具体的机制与联系尚有待于进一步深入研究。
综上所述,本研究结果表明糖尿病合并脓毒症时肠损伤更加显著,可能与高血糖时巨噬细胞更易在LPS的作用下向M1极化有关。
